Классификация Гольдшмидта [1] [ 2] , разработанная Виктором Гольдшмидтом (1888–1947), представляет собой геохимическую классификацию , которая группирует химические элементы в пределах Земли в соответствии с их предпочтительными фазами-хозяевами на литофильные ( любящие горные породы ), сидерофильные ( любящие железо ), халькофильные ( любящие сульфидные руды или халькогены ) и атмофильные (любящие газы) или летучие (элемент или соединение, в котором он встречается, находится в жидком или газообразном состоянии в условиях окружающей поверхности).
Некоторые элементы имеют сродство к более чем одной фазе. Основное сродство указано в таблице ниже, а обсуждение каждой группы следует за этой таблицей.
Классификация Гольдшмидта: Литофильный Сидерофил Халькофильный Атмофил След/Синтетический
Литофильные элементы (от древнегреческого λῐ́θος ( líthos ) «камень» и φίλος ( philos ) «дорогой, любимый») — это те элементы, которые остаются на поверхности или близко к ней, поскольку они легко соединяются с кислородом, образуя соединения, которые не погружаются в ядро Земли . К литофильным элементам относятся Al , B , Ba , Be , Br , Ca , Cl , Cr , Cs , F , I , Hf , K , Li , Mg , Na , Nb , O , P , Rb , Sc , Si , Sr , Ta , Th , Ti , U , V , Y , Zr , W и лантаноиды или редкоземельные элементы (РЗЭ).
Литофильные элементы в основном состоят из высокореакционных металлов s- и f-блоков . Они также включают небольшое количество реактивных неметаллов и более реактивные металлы d-блока, такие как титан , цирконий и ванадий .
Большинство литофильных элементов образуют очень стабильные ионы с электронной конфигурацией благородного газа (иногда с дополнительными f-электронами). Те немногие, которые этого не делают, такие как кремний, фосфор и бор, образуют прочные ковалентные связи с кислородом, часто с участием pi-связей . Их сильное сродство к кислороду заставляет литофильные элементы очень сильно связываться с кремнием , образуя относительно низкоплотные минералы, которые таким образом поднимались к коре во время планетарной дифференциации . Более растворимые минералы, образованные щелочными металлами, имеют тенденцию концентрироваться в морской воде или засушливых регионах , где они могут кристаллизоваться. Менее растворимые литофильные элементы концентрируются на древних континентальных щитах , где растворимые минералы были выветрены .
Из-за их сильного сродства к кислороду большинство литофильных элементов обогащены в земной коре относительно их распространенности в солнечной системе. Наиболее реактивные s- и f-металлы, которые образуют либо солевые, либо металлические гидриды , как известно, чрезвычайно обогащены на Земле в целом относительно их солнечного распространенности. Это связано с тем, что на самых ранних стадиях формирования Земли распространенность стабильных форм каждого элемента определялась тем, насколько легко он образует летучие гидриды; эти летучие вещества затем могли «ускользнуть» от прото-Земли, оставив позади элементы, не реагирующие с водородом. В этих условиях s- и f-металлы были сильно обогащены во время формирования Земли. Наиболее обогащенными элементами являются рубидий , стронций и барий , которые вместе составляют более 50 процентов по массе всех элементов тяжелее железа в земной коре.
Неметаллические литофилы – фосфор и галогены – существуют на Земле в виде ионных солей с s-блочными металлами в пегматитах и морской воде. За исключением фтора , гидрид которого образует водородные связи и поэтому имеет относительно низкую летучесть, эти элементы имели свои концентрации на Земле значительно сниженные из-за утечки летучих гидридов во время формирования Земли. Хотя они присутствуют в земной коре в концентрациях, довольно близких к их солнечному содержанию, фосфор и более тяжелые галогены, вероятно, значительно истощены на Земле в целом относительно их солнечного содержания.
Несколько переходных металлов, включая хром , молибден , железо и марганец , проявляют как литофильные , так и сидерофильные характеристики и могут быть обнаружены в обоих этих слоях. Хотя эти металлы образуют прочные связи с кислородом и никогда не встречаются в земной коре в свободном состоянии, считается, что металлические формы этих элементов весьма вероятно существуют в ядре Земли как реликты с тех времен, когда атмосфера не содержала кислорода. Как и «чистые» сидерофилы, эти элементы (кроме железа) значительно истощены в коре относительно их солнечного содержания.
Из-за своего сильного сродства к кислороду литофильные металлы, хотя они и составляют большую часть металлических элементов в земной коре, никогда не были доступны в виде свободных металлов до развития электролиза . С развитием этого процесса многие литофильные металлы приобрели значительную ценность как структурные металлы ( магний , алюминий , титан , ванадий ) или как восстановители ( натрий , магний , кальций ).
Неметаллы фосфор и галогены также не были известны ранним химикам, хотя производство этих элементов менее сложно, чем металлических литофилов, поскольку электролиз требуется только с фтором. Элементарный хлор особенно важен как окислитель – обычно его получают электролизом хлорида натрия .
Сидерофильные элементы (от древнегреческого σίδηρος ( sídēros ) «железо») — это переходные металлы , которые имеют тенденцию опускаться к ядру во время планетарной дифференциации , поскольку они легко растворяются в железе либо в виде твердых растворов , либо в расплавленном состоянии. Некоторые источники [3] включают элементы, которые не являются переходными металлами, в свой список сидерофилов, такие как германий . Другие источники также могут отличаться в своем списке в зависимости от обсуждаемой температуры — ниобий , ванадий , хром и марганец могут считаться сидерофилами или нет, в зависимости от предполагаемой температуры и давления. [4] Также запутывает вопрос то, что некоторые элементы, такие как вышеупомянутый марганец , а также молибден , образуют прочные связи с кислородом, но в свободном состоянии (как они существовали на ранней Земле, когда свободного кислорода не было ) могут так легко смешиваться с железом, что они не концентрируются в кремнистой коре, как это делают настоящие литофильные элементы. Железо , между тем, просто повсюду .
Сидерофильные элементы включают в себя высокосидерофильные рутений , родий , палладий , рений , осмий , иридий , платину и золото , умеренно сидерофильные кобальт и никель , в дополнение к «спорным» элементам, упомянутым ранее – некоторые источники [3] даже включают вольфрам и серебро . [5]
Большинство сидерофильных элементов практически не имеют сродства к кислороду: действительно, оксиды золота термодинамически нестабильны . Они образуют более прочные связи с углеродом или серой , но даже они недостаточно прочны, чтобы отделиться от халькофильных элементов. Таким образом, сидерофильные элементы связаны с железом посредством металлических связей в ядре Земли, где давление может быть достаточно высоким, чтобы поддерживать железо в твердом состоянии. Марганец, железо и молибден действительно образуют прочные связи с кислородом, но в свободном состоянии (как на ранней Земле) могут так легко смешиваться с железом, что они не концентрируются в кремнистой коре, как это делают настоящие литофильные элементы. Однако руды марганца встречаются во многом в тех же местах, что и руды алюминия и титана, из-за большой реакционной способности марганца по отношению к кислороду.
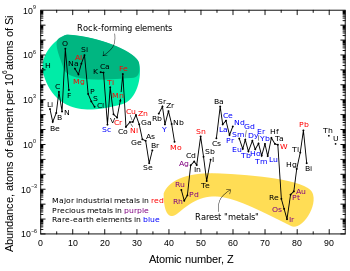
Поскольку они так сконцентрированы в плотном ядре, сидерофильные элементы известны своей редкостью в земной коре. Большинство из них всегда были известны как драгоценные металлы из-за этого. Иридий является самым редким переходным металлом, встречающимся в земной коре, с распространенностью по массе менее одной части на миллиард. Извлекаемые месторождения драгоценных металлов обычно образуются в результате эрозии ультраосновных пород , но не являются высококонцентрированными даже по сравнению с их распространенностью в земной коре , которая обычно на несколько порядков ниже их солнечной распространенности. Однако, поскольку они сконцентрированы в мантии Земли и ядре Земли , считается, что сидерофильные элементы присутствуют в Земле в целом (включая ядро) в чем-то приближающемся к их солнечной распространенности.
К халькофильным элементам (от др.-греч. χαλκός ( khalkós ) «медь, латунь, бронза», также «руда») относятся Ag , As , Bi , Cd , Cu , Ga , Ge , Hg , In , Pb , S , Sb , Se , Sn , Te , Tl и Zn . [6]
Халькофильные элементы — это те, которые остаются на поверхности или близко к ней, поскольку они легко соединяются с серой и некоторыми другими халькогенами, отличными от кислорода, образуя соединения, которые не погружаются вместе с железом в ядро Земли. Халькофильные элементы — это те металлы и более тяжелые неметаллы, которые имеют низкое сродство к кислороду и предпочитают связываться с серой в виде крайне нерастворимых сульфидов .
Поскольку эти сульфиды намного плотнее силикатных минералов, образованных литофильными элементами, халькофильные элементы отделились ниже литофилов во время первой кристаллизации земной коры. Это привело к их истощению в земной коре относительно их солнечного содержания, хотя, поскольку образуемые ими минералы являются неметаллическими, это истощение не достигло уровней, обнаруженных для сидерофильных элементов.
Однако, поскольку они образовали летучие гидриды в аккрецирующей протосолнечной туманности , когда контролирующей окислительно-восстановительной реакцией было окисление или восстановление водорода, менее металлические халькофильные элементы сильно истощены на Земле в целом относительно космического изобилия. Это особенно верно для халькогенов селена и теллура (которые образовали летучие селенид водорода и теллурид водорода , соответственно), которые по этой причине являются одними из самых редких элементов, обнаруженных в земной коре (для иллюстрации, теллур встречается примерно так же часто, как платина ).
Наиболее металлические халькофильные элементы (группы меди, цинка и бора) могут в некоторой степени смешиваться с железом в ядре Земли. Они, скорее всего, не будут истощены на Земле в целом относительно их солнечного изобилия, поскольку они не образуют летучих гидридов. Цинк и галлий являются в некоторой степени «литофильными» по своей природе, поскольку они часто встречаются в силикатах или родственных минералах и образуют довольно прочные связи с кислородом. Галлий, в частности, добывается в основном из бокситов , руды гидроксида алюминия , в которой ионы галлия заменяют химически схожий алюминий.
Хотя ни один халькофильный элемент не имеет высокой распространенности в земной коре, халькофильные элементы составляют большую часть коммерчески важных металлов. Это связано с тем, что, в то время как литофильные элементы требуют энергоемкого электролиза для извлечения, халькофилы могут быть легко извлечены путем восстановления и геохимической концентрации халькофилов, которая в экстремальных случаях может превышать в 100 000 раз их среднюю распространенность в земной коре. Эти самые большие обогащения происходят на высоких плато, таких как Тибетское плато и Боливийское Альтиплано , где большие количества халькофильных элементов были подняты в результате тектоники плит . Побочным эффектом этого в наше время является то, что самые редкие халькофилы (например, ртуть ) настолько полностью эксплуатируются, что их ценность как минералов почти полностью исчезла.
Атмофильные элементы (от древнегреческого ἀτμός ( atmós ) «пар, пар, дым») — это H , C , N и благородные газы . [7]
Атмофильные элементы (также называемые « летучими элементами ») определяются как те, которые остаются в основном на поверхности Земли или над ней, поскольку они являются жидкостями и/или газами при температурах и давлениях, существующих на поверхности. Благородные газы не образуют стабильных соединений и встречаются в виде одноатомных газов , в то время как азот , хотя и очень реактивен в качестве свободного атома, так сильно связывается с двухатомным молекулярным азотом, что все оксиды азота термодинамически нестабильны по отношению к азоту и кислороду. Следовательно, с развитием свободного кислорода в атмосфере Земли аммиак окислился до молекулярного азота, который стал составлять четыре пятых атмосферы Земли. Углерод также классифицируется как атмофил, поскольку он образует очень сильные множественные связи с кислородом в оксиде углерода (медленно окисляющемся в атмосфере) и диоксиде углерода . Последний является четвертым по величине компонентом атмосферы Земли, в то время как окись углерода естественным образом образуется в различных источниках ( вулканы , горение) и сохраняется в атмосфере несколько месяцев.
Водород, который содержится в воде, также классифицируется как атмофил. Вода классифицируется как летучее вещество, потому что большая ее часть находится в жидком или газообразном состоянии, хотя она может существовать в виде твердого соединения на поверхности Земли. Вода также может быть включена в другие минералы как вода кристаллизации (как в гипсе ) или через ионные и водородные связи (как в тальке ), что придает водороду некоторые литофильные свойства.
Поскольку все атмофильные элементы являются либо газами, либо образуют летучие гидриды, атмофильные элементы сильно истощены на Земле в целом относительно их солнечного содержания из-за потерь из атмосферы во время формирования Земли . Более тяжелые благородные газы ( криптон , ксенон ) являются самыми редкими стабильными элементами на Земле. (На самом деле они, наряду с неоном , были впервые выделены и описаны Уильямом Рамзаем и Моррисом Трэверсом и их помощниками, которые дали им названия с древнегреческими производными от «скрытый», «чужой» и «новый» соответственно.)
Аргон является исключением среди благородных газов: это третий по распространенности компонент современной атмосферы Земли после азота и кислорода, составляющий около 1%. Аргон-40 является стабильной дочерней молекулой радиоактивного калия-40, и аргон достаточно тяжел, чтобы быть гравитационно захваченным постаккреционной Землей, поэтому, хотя первичный аргон прото-Земли был в основном вытеснен, этот радиогенный аргон накапливался в течение геологического времени. Это делает распространенность аргона на Земле существенно отличной от космических соотношений распространенности аргона, будучи чрезвычайно обогащенным40
Ар
, пока36
Ар
преобладает в космическом плане.
Синтетические элементы исключены из классификации, поскольку они не встречаются в природе.
Следовые радиоактивные элементы (а именно Tc, Pm, Po, At, Rn, Fr, Ra, Ac, Pa, Np, Pu) также рассматриваются как синтетические. Хотя они встречаются в природе, [8] [9] [10] их возникновение зависит от их долгоживущих родителей Th и U, и они не очень мобильны. Например, химия полония предсказывает, что он будет халькофилом, но вместо этого он имеет тенденцию встречаться как литофил вместе со своим родителем ураном . Даже радон , газ при стандартных условиях , обычно не успевает далеко уйти от исходного источника урана, прежде чем распадется. При необходимости эти элементы обычно производятся синтетически в ядерных реакторах, а не извлекаются из руд.