
Структурная формула химического соединения — это графическое представление молекулярной структуры (определяемой методами структурной химии ), показывающее, как атомы могут быть расположены в реальном трехмерном пространстве . Химическая связь внутри молекулы также отображается явно или неявно. В отличие от других типов химических формул , [a] , которые имеют ограниченное количество символов и способны иметь только ограниченную описательную силу, структурные формулы обеспечивают более полное геометрическое представление молекулярной структуры. Например, многие химические соединения существуют в различных изомерных формах, которые имеют различные энантиомерные структуры, но одну и ту же молекулярную формулу . Существует несколько типов способов изображения этих структурных формул, таких как: структуры Льюиса , конденсированные формулы, скелетные формулы , проекции Ньюмена , конформации циклогексана , проекции Хауорта и проекции Фишера . [2]
Несколько систематических форматов химических названий , как в химических базах данных , используются, которые эквивалентны и столь же мощны, как геометрические структуры. Эти системы химической номенклатуры включают SMILES , InChI и CML . Эти систематические химические названия могут быть преобразованы в структурные формулы и наоборот, но химики почти всегда описывают химическую реакцию или синтез, используя структурные формулы, а не химические названия, потому что структурные формулы позволяют химику визуализировать молекулы и структурные изменения, которые происходят в них во время химических реакций. ChemSketch и ChemDraw — популярные загрузки/веб-сайты, которые позволяют пользователям рисовать реакции и структурные формулы, как правило, в стиле структуры Льюиса.
Связи часто изображаются в виде линии, которая соединяет один атом с другим. Одна линия обозначает одинарную связь . Две линии обозначают двойную связь , а три линии обозначают тройную связь . В некоторых структурах атомы между каждой связью указаны и показаны. Однако в некоторых структурах молекулы углерода не выписаны специально. Вместо этого эти атомы углерода обозначены углом, который образуется при соединении двух линий. Кроме того, атомы водорода подразумеваются и обычно не вычерчиваются. Их можно вывести на основе того, к скольким другим атомам присоединен углерод. Например, если углерод A присоединен к одному другому углероду B, углерод A будет иметь три водорода, чтобы заполнить свой октет. [3]



Электроны обычно изображаются в виде цветных кружков. Один кружок обозначает один электрон. Два кружка обозначают пару электронов. Обычно пара электронов также обозначает отрицательный заряд. С помощью цветных кружков указывается количество электронов в валентной оболочке каждого соответствующего атома, что дает дополнительную описательную информацию относительно реактивной способности этого атома в молекуле. [3]
Часто атомы будут иметь положительный или отрицательный заряд , поскольку их октет может быть неполным. Если у атома отсутствует пара электронов или есть протон, он будет иметь положительный заряд. Если у атома есть электроны, которые не связаны с другим атомом, будет отрицательный заряд. В структурных формулах положительный заряд обозначается знаком ⊕, а отрицательный заряд обозначается знаком ⊖. [3]


Хиральность в скелетных формулах обозначается методом проекции Натта . Стереохимия используется для отображения относительного пространственного расположения атомов в молекуле. Для этого используются клинья, и они бывают двух типов: пунктирные и заполненные. Заполненный клин указывает, что атом находится в передней части молекулы; он направлен выше плоскости бумаги к передней части. Пунктирный клин указывает, что атом находится позади молекулы; он направлен ниже плоскости бумаги. Когда используется прямая, непунктирная линия, атом находится в плоскости бумаги. Такое пространственное расположение дает представление о молекуле в трехмерном пространстве, и существуют ограничения относительно того, как могут быть организованы пространственные расположения. [3]
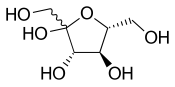
Волнистые одинарные связи представляют неизвестную или неопределенную стереохимию или смесь изомеров. Например, на соседней диаграмме показана молекула фруктозы с волнистой связью с группой HOCH 2 - слева. В этом случае две возможные кольцевые структуры находятся в химическом равновесии друг с другом, а также со структурой с открытой цепью. Кольцо автоматически открывается и закрывается, иногда закрываясь с одной стереохимией, а иногда с другой.
Скелетные формулы могут отображать цис- и транс- изомеры алкенов. Волнистые одинарные связи являются стандартным способом представления неизвестной или неопределенной стереохимии или смеси изомеров (как в случае с тетраэдрическими стереоцентрами). Иногда использовалась перекрещенная двойная связь, но больше не считается приемлемым стилем для общего использования. [4]
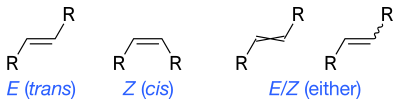

Структуры Льюиса (или «структуры точек Льюиса») представляют собой плоские графические формулы, которые показывают связь атомов и неподеленные пары или неспаренные электроны, но не трехмерную структуру. Эта нотация в основном используется для небольших молекул. Каждая линия представляет два электрона одинарной связи . Две или три параллельные линии между парами атомов представляют двойные или тройные связи соответственно. В качестве альтернативы пары точек могут использоваться для представления пар связей. Кроме того, указываются все несвязанные электроны (спаренные или неспаренные) и любые формальные заряды на атомах. Благодаря использованию структур Льюиса размещение электронов, будь то в связи или в неподеленных парах , позволит идентифицировать формальные заряды атомов в молекуле, чтобы понять стабильность и определить наиболее вероятную молекулу (на основе разницы в молекулярной геометрии ), которая будет образована в реакции. Структуры Льюиса действительно дают некоторое представление о геометрии молекулы, поскольку часто связи рисуются под определенными углами, чтобы представить молекулу в реальной жизни. Структуру Льюиса лучше всего использовать для расчета формальных зарядов или того, как атомы связываются друг с другом, поскольку показаны как электроны, так и связи. Структуры Льюиса дают представление о молекулярной и электронной геометрии, которая меняется в зависимости от наличия связей и неподеленных пар, и посредством этого можно также определить углы связей и гибридизацию .
В ранних публикациях по органической химии, где использование графики было сильно ограничено, возникла типографская система для описания органических структур в строке текста. Хотя эта система, как правило, проблематична в применении к циклическим соединениям, она остается удобным способом представления простых структур:
Скобки используются для обозначения нескольких идентичных групп, указывая на присоединение к ближайшему неводородному атому слева, если он находится в формуле, или к атому справа, если он находится в начале формулы:
Во всех случаях показаны все атомы, включая атомы водорода. Также полезно показать карбонилы, где
подразумевается через то, что находится в скобках. Например:
( ацетон )
Поэтому важно смотреть слева от атома в скобках, чтобы убедиться, к какому атому он присоединен. Это полезно при преобразовании из сжатой формулы в другую форму структурной формулы, такую как скелетная формула или структуры Льюиса . Существуют разные способы показать различные функциональные группы в сжатых формулах, такие как альдегид как , карбоновые кислоты как или , сложные эфиры как или . Однако использование сжатых формул не дает немедленного представления о молекулярной геометрии соединения или количестве связей между атомами углерода, его необходимо распознавать на основе количества атомов, присоединенных к атомам углерода, и наличия каких-либо зарядов на углероде. [5]
Скелетные формулы являются стандартным обозначением для более сложных органических молекул. В этом типе диаграммы, впервые использованном органическим химиком Фридрихом Августом Кекуле фон Страдоницем [6], подразумевается , что атомы углерода расположены в вершинах (углах) и на концах отрезков линий, а не обозначены атомным символом C. Атомы водорода, присоединенные к атомам углерода, не обозначены: подразумевается, что каждый атом углерода связан с достаточным количеством атомов водорода, чтобы дать атому углерода четыре связи. Наличие положительного или отрицательного заряда у атома углерода занимает место одного из подразумеваемых атомов водорода. Атомы водорода, присоединенные к атомам, отличным от углерода, должны быть записаны явно. Дополнительной особенностью скелетных формул является то, что путем добавления определенных структур можно определить стереохимию , то есть трехмерную структуру соединения. Часто скелетная формула может указывать стереохимию с помощью использования клиньев вместо линий. Сплошные клинья представляют связи, направленные выше плоскости бумаги, тогда как пунктирные клинья представляют связи, направленные ниже плоскости.
Проекция Ньюмена и проекция козла используются для изображения определенных конформеров или для различения вицинальной стереохимии. В обоих случаях в центре внимания находятся два определенных атома углерода и их соединительная связь. Единственное отличие заключается в немного иной перспективе: проекция Ньюмена смотрит прямо вниз на интересующую связь, проекция козла смотрит на ту же связь, но с несколько наклонной точки зрения. В проекции Ньюмена круг используется для представления плоскости, перпендикулярной связи, отличая заместители на переднем углероде от заместителей на заднем углероде. В проекции козла передний углерод обычно находится слева и всегда немного ниже. Иногда для обозначения переднего углерода используется стрелка. Проекция козла очень похожа на скелетную формулу, и она даже может использовать клинья вместо линий для обозначения стереохимии молекулы. Проекция козла отделена от скелетных формул, потому что проекция козла не является очень хорошим индикатором геометрии молекулы и молекулярного расположения. Для создания проекции Фишера можно использовать как проекцию Ньюмена, так и проекцию Коня.
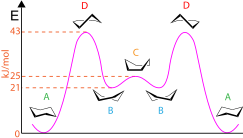
Некоторые конформации циклогексана и других соединений с малыми кольцами можно показать с помощью стандартной конвенции. Например, стандартная конформация кресла циклогексана включает перспективный вид немного выше средней плоскости атомов углерода и четко показывает, какие группы являются аксиальными (направленными вертикально вверх или вниз), а какие являются экваториальными (почти горизонтальными, слегка наклоненными вверх или вниз). Связи спереди могут быть выделены или не выделены более четкими линиями или клиньями. Конформации развиваются следующим образом: кресло в полукресло в твист-лодку в лодку в твист-лодку в полукресло в кресло. Конформации циклогексана также можно использовать для отображения потенциальной энергии, присутствующей на каждой стадии, как показано на диаграмме. Конформации кресла (A) имеют самую низкую энергию, тогда как конформации полукресла (D) имеют самую высокую энергию. В конформации лодки (C) есть пик/локальный максимум, а в конформациях твист-лодка (B) есть долины/локальные минимумы. Кроме того, конформации циклогексана можно использовать для указания того, имеет ли молекула какие-либо 1,3-диаксиальные взаимодействия, которые представляют собой стерические взаимодействия между аксиальными заместителями на 1,3 и 5 атомах углерода. [7]
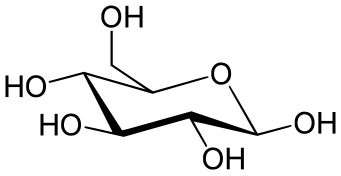
Проекция Хаворта используется для циклических сахаров . Аксиальное и экваториальное положения не различаются; вместо этого заместители располагаются непосредственно над или под атомом кольца, с которым они связаны. Водородные заместители обычно опускаются.
Однако важно помнить при чтении проекции Хаворта, что кольцевые структуры не плоские. Поэтому Хаворт не предоставляет трехмерную форму. Сэр Норман Хаворт был британским химиком, который получил Нобелевскую премию за свою работу по углеводам и открытие структуры витамина С. Во время своего открытия он также вывел различные структурные формулы, которые теперь называются проекциями Хаворта. В проекции Хаворта пиранозный сахар изображается как шестиугольник, а фуранозный сахар изображается как пятиугольник. Обычно кислород помещается в правом верхнем углу пиранозы и в верхнем центре фуранозного сахара. Более тонкие связи в верхней части кольца относятся к связям, находящимся дальше, а более толстые связи в нижней части кольца относятся к концу кольца, который находится ближе к наблюдателю. [8]

Проекция Фишера в основном используется для линейных моносахаридов . В любом заданном углеродном центре вертикальные линии связей эквивалентны стереохимическим хэшированным отметкам, направленным от наблюдателя, в то время как горизонтальные линии эквивалентны клиньям, направленным к наблюдателю. Проекция нереалистична, так как сахарид никогда не примет эту многократно затмеваемую конформацию. Тем не менее, проекция Фишера является простым способом изображения нескольких последовательных стереоцентров, который не требует и не подразумевает никаких знаний о фактической конформации. Проекция Фишера ограничит трехмерную молекулу до двухмерной, и, следовательно, существуют ограничения на изменение конфигурации хиральных центров. Проекции Фишера используются для определения конфигурации R и S на хиральном углероде, и это делается с использованием правил Кана-Ингольда-Прелога . Это удобный способ представления и различения энантиомеров и диастереомеров . [8]
Структурная формула — это упрощенная модель, которая не может представлять определенные аспекты химических структур. Например, формализованная связь может быть неприменима к динамическим системам, таким как делокализованные связи . Ароматичность — это такой случай, и для представления связи требуется соглашение. Различные стили структурных формул могут представлять ароматичность по-разному, что приводит к разным изображениям одного и того же химического соединения. Другим примером являются формальные двойные связи , где электронная плотность распределена за пределами формальной связи, что приводит к частичному характеру двойной связи и медленному взаимопревращению при комнатной температуре. Для всех динамических эффектов температура будет влиять на скорости взаимопревращений и может изменить то, как должна быть представлена структура. Не существует явной температуры, связанной со структурной формулой, хотя многие предполагают, что это будет стандартная температура .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )