Дикислородные комплексы представляют собой координационные соединения , содержащие O 2 в качестве лиганда . [1] [2] Изучение этих соединений вдохновлено кислородпереносящими белками, такими как миоглобин , гемоглобин , гемэритрин и гемоцианин . [3] Несколько переходных металлов образуют комплексы с O 2 , и многие из этих комплексов образуются обратимо. [4] Связывание O 2 является первым шагом во многих важных явлениях, таких как клеточное дыхание , коррозия и промышленная химия. Первый синтетический кислородный комплекс был продемонстрирован в 1938 году с комплексом кобальта(II), обратимо связанным с O 2 . [5]
O 2 связывается с одним металлическим центром либо «концом» ( η 1 - ), либо «боком» ( η 2 - ). Связи и структуры этих соединений обычно оцениваются с помощью монокристаллической рентгеновской кристаллографии , уделяя особое внимание как общей геометрии, так и расстояниям O–O, что позволяет выявить порядок связи лиганда O 2 .

Аддукты O 2 , полученные из комплексов кобальта (II) и железа (II) порфирина (и родственных анионных макроциклических лигандов), демонстрируют этот способ связывания. Миоглобин и гемоглобин являются известными примерами, и было описано много синтетических аналогов, которые ведут себя аналогично. Связывание O 2 обычно описывается как протекающее путем переноса электронов от центра металла (II) с образованием супероксида ( O−
2) комплексы центров металла(III). Как показывают механизмы цитохрома P450 и альфа-кетоглутарат-зависимой гидроксилазы , связывание Fe -η 1 -O 2 способствует образованию оксоцентров Fe(IV). O 2 может связываться с одним металлом биметаллического блока через те же режимы, которые обсуждались выше для моноядерных комплексов. Хорошо известным примером является активный центр белка гемеритрина , который имеет дикарбоксилат железа , который связывает O 2 с одним центром Fe. Двуядерные комплексы также могут сотрудничать в связывании, хотя начальная атака O 2, вероятно, происходит с одним металлом.
η 2 -связывание является наиболее распространенным мотивом, наблюдаемым в координационной химии дикислорода. Такие комплексы могут быть получены путем обработки низковалентных комплексов металлов кислородом. Например, комплекс Васки обратимо связывает O 2 (Ph = C 6 H 5 ):
Превращение описывается как окислительно-восстановительный процесс 2 e − : Ir(I) превращается в Ir(III), а дикислород превращается в пероксид . Поскольку O 2 имеет триплетное основное состояние, а комплекс Васки является синглетным, реакция идет медленнее, чем при использовании синглетного кислорода . [7] Магнитные свойства некоторых комплексов η 2 -O 2 показывают, что лигандом на самом деле является супероксид, а не пероксид. [8]
Большинство комплексов η 2 -O 2 генерируются с использованием перекиси водорода , а не из O 2 . Хромат ([CrO 4 )] 2− ) может, например, быть преобразован в тетрапероксид [Cr(O 2 ) 4 ] 2− . Реакция перекиси водорода с водным титаном(IV) дает ярко окрашенный пероксидный комплекс, который является полезным тестом как на титан, так и на перекись водорода. [9]

Эти режимы связывания включают μ 2 - η 2 , η 2 -, μ 2 - η 1 , η 1 - и μ 2 - η 1 , η 2 -. В зависимости от степени переноса электронов из диметаллической единицы эти лиганды O 2 можно снова описать как пероксо или супероксо. Гемоцианин является переносчиком O 2 , который использует мостиковый мотив связывания O 2 . Он имеет пару медных центров. [10]

.
Салкомин , комплекс кобальта(II) с саленовым лигандом, является первым синтетическим переносчиком O 2 . [12] Сольватированные производные твердого комплекса связывают 0,5 эквивалента O 2 :
Обратимые реакции переноса электронов наблюдаются в некоторых двуядерных комплексах O2 . [13]
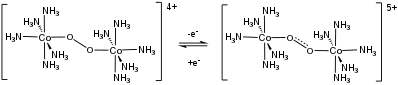
Дикислородные комплексы являются предшественниками других семейств кислородных лигандов. Оксосоединения металлов возникают в результате разрыва связи O–O после комплексообразования. Гидропероксокомплексы образуются в ходе восстановления дикислорода металлами. Восстановление O 2 металлическими катализаторами является ключевой полуреакцией в топливных элементах .
Катализируемое металлами окисление с O 2 происходит через посредничество дикислородных комплексов, хотя фактическими окислителями часто являются оксопроизводные. Обратимое связывание O 2 с металлическими комплексами использовалось как средство очистки кислорода из воздуха, но криогенная перегонка жидкого воздуха остается доминирующей технологией.