Этан ( США : / ˈɛθeɪn / ETH -ayn , Великобритания : / ˈiː- / EE- ) — это встречающееся в природе органическое химическое соединение с химической формулой C
2ЧАС
6. При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха . Как и многие углеводороды , этан выделяется в промышленных масштабах из природного газа и как нефтехимический побочный продукт переработки нефти . Его основное применение — в качестве сырья для производства этилена . Этильная группа формально, хотя и редко на практике, получена из этана.
Этан был впервые синтезирован в 1834 году Майклом Фарадеем , применив электролиз раствора ацетата калия . Он принял углеводородный продукт этой реакции за метан и не исследовал его далее. [6] Этот процесс теперь называется электролизом Кольбе :
В период 1847–1849 годов, пытаясь доказать радикальную теорию органической химии , Герман Кольбе и Эдвард Франкланд получили этан путем восстановления пропионитрила ( этилцианида ) [7] и этилиодида [8] металлическим калием , а также, как и Фарадей, путем электролиза водных ацетатов. Они ошибочно приняли продукт этих реакций за метильный радикал ( CH3 ) , димером которого является этан ( C2H6 ) .
Эта ошибка была исправлена в 1864 году Карлом Шорлеммером , который показал, что продуктом всех этих реакций на самом деле является этан. [9] Этан был обнаружен растворенным в легкой сырой нефти Пенсильвании Эдмундом Рональдсом в 1864 году. [10] [11]
При стандартной температуре и давлении этан представляет собой бесцветный газ без запаха. Он имеет температуру кипения −88,5 °C (−127,3 °F) и температуру плавления −182,8 °C (−297,0 °F). Твердый этан существует в нескольких модификациях. [12] При охлаждении при нормальном давлении первой появляющейся модификацией является пластичный кристалл , кристаллизующийся в кубической системе. В этой форме положения атомов водорода не фиксированы; молекулы могут свободно вращаться вокруг длинной оси. Охлаждение этого этана ниже примерно 89,9 К (−183,2 °C; −297,8 °F) изменяет его в моноклинный метастабильный этан II ( пространственная группа P 21/n). [13] Этан очень плохо растворяется в воде.
Параметры связи этана были измерены с высокой точностью с помощью микроволновой спектроскопии и электронной дифракции: r C−C = 1,528(3) Å, r C−H = 1,088(5) Å и ∠CCH = 111,6(5)° с помощью микроволновой спектроскопии и r C−C = 1,524(3) Å, r C−H = 1,089(5) Å и ∠CCH = 111,9(5)° с помощью электронной дифракции (числа в скобках представляют собой неопределенности в конечных цифрах). [14]
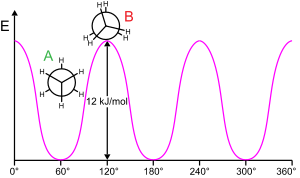
Вращение молекулярной субструктуры вокруг скручиваемой связи обычно требует энергии. Минимальная энергия для создания вращения связи на 360° называется вращательным барьером .
Этан дает классический, простой пример такого вращательного барьера, иногда называемого «этановым барьером». Одно из самых ранних экспериментальных доказательств этого барьера (см. диаграмму слева) было получено путем моделирования энтропии этана. [16] Три водорода на каждом конце могут свободно вращаться вокруг центральной связи углерод-углерод, если им предоставлено достаточно энергии для преодоления барьера. Физическое происхождение барьера все еще не полностью установлено, [17] хотя перекрытие (обменное) отталкивание [18] между атомами водорода на противоположных концах молекулы, возможно, является самым сильным кандидатом, при этом стабилизирующий эффект гиперконъюгации на ступенчатую конформацию способствует этому явлению. [19] Теоретические методы, которые используют соответствующую начальную точку (ортогональные орбитали), обнаруживают, что гиперконъюгация является наиболее важным фактором в происхождении вращательного барьера этана. [20] [21]
Еще в 1890–1891 годах химики предположили, что молекулы этана предпочитают ступенчатую конформацию с двумя концами молекулы, наклоненными друг относительно друга. [22] [23] [24] [25]

Этан встречается в качестве следового газа в атмосфере Земли , в настоящее время его концентрация на уровне моря составляет 0,5 ppb . [26] Глобальные количества этана менялись с течением времени, вероятно, из-за сжигания на месторождениях природного газа . [27] Глобальные темпы выбросов этана снизились с 1984 по 2010 год, [27] хотя увеличение добычи сланцевого газа в формации Баккен в США остановило снижение вдвое. [28] [29]
Хотя этан является парниковым газом , он гораздо менее распространен, чем метан, имеет продолжительность жизни всего несколько месяцев по сравнению с более чем десятилетием, [30] и также менее эффективен в поглощении радиации относительно массы. Фактически, потенциал этана для глобального потепления в значительной степени является результатом его преобразования в атмосфере в метан. [31] Он был обнаружен как следовой компонент в атмосферах всех четырех гигантских планет и в атмосфере спутника Сатурна Титана . [ 32]
Атмосферный этан возникает в результате фотохимического воздействия Солнца на метановый газ, также присутствующий в этих атмосферах: ультрафиолетовые фотоны с длиной волны менее 160 нм могут фотодиссоциировать молекулу метана на метильный радикал и атом водорода . Когда два метильных радикала рекомбинируют, получается этан:
В атмосфере Земли гидроксильные радикалы преобразуют этан в пары метанола с периодом полураспада около трех месяцев. [30]
Предполагается, что этан, произведенный таким образом на Титане, выпадает обратно на поверхность луны и со временем накапливается в углеводородных морях, покрывающих большую часть полярных регионов луны. В середине 2005 года орбитальный аппарат Кассини обнаружил озеро Онтарио в южных полярных регионах Титана. Дальнейший анализ данных инфракрасной спектроскопии, представленных в июле 2008 года [33], предоставил дополнительные доказательства наличия жидкого этана в озере Онтарио. Несколько значительно более крупных углеводородных озер, Ligeia Mare и Kraken Mare являются двумя крупнейшими, были обнаружены вблизи северного полюса Титана с использованием радиолокационных данных, собранных Кассини. Считается, что эти озера заполнены в основном смесью жидкого этана и метана.
В 1996 году этан был обнаружен в комете Хиякутаке , [34] и с тех пор он был обнаружен в некоторых других кометах . Присутствие этана в этих далеких телах солнечной системы может указывать на то, что этан является первичным компонентом солнечной туманности , из которой, как полагают, образовались Солнце и планеты.
В 2006 году Дейл Крукшенк из NASA/Ames Research Center (один из исследователей New Horizons ) и его коллеги объявили о спектроскопическом открытии этана на поверхности Плутона . [35]
Реакции этана включают в себя в основном свободнорадикальные реакции . Этан может реагировать с галогенами , особенно хлором и бромом , путем свободнорадикальной галогенизации . Эта реакция протекает через распространение этильного радикала: [36]
При сгорании этана выделяется 1559,7 кДж/моль, или 51,9 кДж/г, тепла, а также образуются углекислый газ и вода в соответствии с химическим уравнением :
Горение может также происходить без избытка кислорода, давая оксид углерода , ацетальдегид , метан , метанол и этанол . При более высоких температурах, особенно в диапазоне 600–900 °C (1,112–1,652 °F), этилен является важным продуктом:
Такие реакции окислительной дегидрогенизации имеют отношение к производству этилена . [37]
После метана этан является вторым по величине компонентом природного газа . Содержание этана в природном газе из разных газовых месторождений варьируется от менее 1% до более 6% по объему. До 1960-х годов этан и более крупные молекулы, как правило, не отделялись от метанового компонента природного газа, а просто сжигались вместе с метаном в качестве топлива. Сегодня этан является важным нефтехимическим сырьем и отделяется от других компонентов природного газа на большинстве хорошо разработанных газовых месторождений. Этан также можно отделить от нефтяного газа , смеси газообразных углеводородов, получаемых в качестве побочного продукта переработки нефти .
Этан наиболее эффективно отделяется от метана путем его сжижения при криогенных температурах. Существуют различные стратегии охлаждения: наиболее экономичный процесс, который в настоящее время широко используется, использует турбодетандер и может извлечь более 90% этана из природного газа. В этом процессе охлажденный газ расширяется через турбину , снижая температуру примерно до -100 °C (-148 °F). При этой низкой температуре газообразный метан может быть отделен от сжиженного этана и более тяжелых углеводородов путем перегонки . Дальнейшая перегонка затем отделяет этан от пропана и более тяжелых углеводородов.
Основное применение этана — производство этилена (этена) путем парового крекинга . Паровой крекинг этана довольно селективен по этилену, в то время как паровой крекинг более тяжелых углеводородов дает смесь продуктов, бедную этиленом и богатую тяжелыми алкенами (олефинами) , такими как пропен (пропилен) и бутадиен , а также ароматическими углеводородами .
Эхан исследовался в качестве сырья для других товарных химикатов. Окислительное хлорирование этана долгое время казалось потенциально более экономичным путем получения винилхлорида, чем хлорирование этилена. Существует много патентов на эту тему, но плохая селективность для винилхлорида и коррозионные условия реакции препятствовали коммерциализации большинства из них. В настоящее время INEOS управляет пилотной установкой по превращению этана в винилхлорид производительностью 1000 т/г ( тонн в год ) в Вильгельмсхафене , Германия .
SABIC управляет заводом в Янбу производительностью 34 000 тонн в год для производства уксусной кислоты путем окисления этана. [38] Экономическая жизнеспособность этого процесса может зависеть от низкой стоимости этана вблизи саудовских нефтяных месторождений, и он может быть неконкурентоспособным с карбонилированием метанола в других местах мира. [39]
Этан может использоваться в качестве хладагента в криогенных холодильных системах.
В гораздо меньших масштабах, в научных исследованиях, жидкий этан используется для остекловывания образцов, богатых водой, для криоэлектронной микроскопии . Тонкая пленка воды, быстро погруженная в жидкий этан при температуре −150 °C или ниже, замерзает слишком быстро для кристаллизации воды. Более медленные методы замораживания могут генерировать кубические кристаллы льда, которые могут нарушить мягкие структуры , повредив образцы, и снизить качество изображения, рассеивая электронный луч до того, как он достигнет детектора.
При комнатной температуре этан является чрезвычайно огнеопасным газом. При смешивании с воздухом в концентрации 3,0–12,5% по объему образует взрывоопасную смесь.
Этан не является канцерогеном . [40]
Насыщенные неразветвленные ациклические углеводороды C 2 H 6 , C 3 H 8 и C 4 H 10 имеют сохраненные названия этан, пропан и бутан соответственно.