Рекомбинация V(D)J (перестройка вариабельности–разнообразия–объединения) — это механизм соматической рекомбинации , который происходит только в развивающихся лимфоцитах на ранних стадиях созревания Т- и В-клеток. Он приводит к очень разнообразному репертуару антител/иммуноглобулинов и рецепторов Т-клеток (TCR), обнаруженных в В- и Т-клетках соответственно. Этот процесс является определяющей чертой адаптивной иммунной системы .
Рекомбинация V(D)J у млекопитающих происходит в первичных лимфоидных органах ( костный мозг для В-клеток и тимус для Т-клеток) и почти случайным образом перестраивает вариабельные (V), соединяющие (J) и, в некоторых случаях, разнообразные (D) сегменты генов. Процесс в конечном итоге приводит к появлению новых аминокислотных последовательностей в антигенсвязывающих областях иммуноглобулинов и TCR, которые позволяют распознавать антигены почти всех патогенов, включая бактерии , вирусы , паразитов и червей , а также «измененные собственные клетки», как это наблюдается при раке . Распознавание также может быть аллергическим по своей природе ( например , к пыльце или другим аллергенам ) или может соответствовать тканям хозяина и приводить к аутоиммунитету .
В 1987 году Сусуму Тонегава был удостоен Нобелевской премии по физиологии и медицине «за открытие генетического принципа генерации разнообразия антител» [1] .
Молекулы антител человека (включая рецепторы В-клеток ) состоят из тяжелых и легких цепей, каждая из которых содержит как константные (C), так и вариабельные (V) области, генетически кодируемые в трех локусах :
Каждый ген тяжелой цепи или легкой цепи содержит несколько копий трех различных типов генных сегментов для вариабельных областей белков антител. Например, область тяжелой цепи человеческого иммуноглобулина содержит 2 константных (Cμ и Cδ) генных сегмента и 44 вариабельных (V) генных сегмента, плюс 27 сегментов гена разнообразия (D) и 6 соединительных (J) генных сегментов. [2] Гены легкой цепи обладают либо одним (Cκ), либо четырьмя (Cλ) константными генными сегментами с многочисленными сегментами генов V и J, но не имеют сегментов генов D. [3] Перестройка ДНК приводит к тому, что одна копия каждого типа генного сегмента попадает в любой данный лимфоцит, создавая огромный репертуар антител; возможны примерно 3×10 11 комбинаций, хотя некоторые удаляются из-за самореактивности.
Большинство рецепторов Т-клеток состоят из вариабельной альфа-цепи и бета-цепи. Гены рецепторов Т-клеток похожи на гены иммуноглобулинов тем, что они также содержат множественные сегменты генов V, D и J в своих бета-цепях (и сегменты генов V и J в своих альфа-цепях), которые перестраиваются в процессе развития лимфоцита, чтобы обеспечить эту клетку уникальным рецептором антигена. В этом смысле рецептор Т-клеток является топологическим эквивалентом антигенсвязывающего фрагмента антитела, оба из которых являются частью суперсемейства иммуноглобулинов.
Аутоиммунный ответ предотвращается путем устранения клеток, которые самореагируют. Это происходит в тимусе путем тестирования клетки против массива аутоантигенов, экспрессируемых через функцию аутоиммунного регулятора (AIRE). Локус легкой цепи иммуноглобулина лямбда содержит гены, кодирующие белок, которые могут быть утрачены при его перестройке. Это основано на физиологическом механизме и не является патогенетическим для лейкемии или лимфомы. Клетка сохраняется, если она создает успешный продукт, который не самореагирует, в противном случае она обрезается посредством апоптоза .
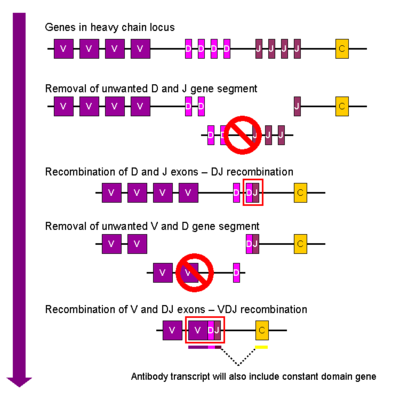
В развивающейся В-клетке первое событие рекомбинации происходит между одним сегментом гена D и одним сегментом гена J локуса тяжелой цепи. Любая ДНК между этими двумя сегментами гена удаляется. За этой рекомбинацией DJ следует присоединение одного сегмента гена V из области выше новообразованного комплекса DJ, образуя перестроенный сегмент гена VDJ. Все остальные сегменты гена между сегментами V и D теперь удаляются из генома клетки. Генерируется первичный транскрипт (несплайсированная РНК), содержащий область VDJ тяжелой цепи и обе константные цепи mu и delta (C μ и C δ ). (т. е. первичный транскрипт содержит сегменты: VDJC μ -C δ ). Первичная РНК обрабатывается для добавления полиаденилированного (поли-A) хвоста после цепи C μ и для удаления последовательности между сегментом VDJ и этим константным сегментом гена. Трансляция этой мРНК приводит к образованию белка тяжелой цепи IgM .
Цепи каппа (κ) и лямбда (λ) локусов легкой цепи иммуноглобулина перестраиваются очень похожим образом, за исключением того, что легкие цепи не имеют сегмента D. Другими словами, первый шаг рекомбинации для легких цепей включает соединение цепей V и J для получения комплекса VJ перед добавлением гена константной цепи во время первичной транскрипции. Трансляция сплайсированной мРНК для цепей каппа или лямбда приводит к образованию белка легкой цепи Ig κ или Ig λ.
Сборка тяжелой цепи Ig μ и одной из легких цепей приводит к образованию мембраносвязанной формы иммуноглобулина IgM, которая экспрессируется на поверхности незрелой В-клетки.
Во время развития тимоцитов цепи рецепторов Т-клеток (TCR) по сути претерпевают ту же последовательность упорядоченных событий рекомбинации, что и описанная для иммуноглобулинов. Рекомбинация D-в-J происходит сначала в β-цепи TCR. Этот процесс может включать либо присоединение сегмента гена D β 1 к одному из шести сегментов J β 1, либо присоединение сегмента гена D β 2 к одному из шести сегментов J β 2. [3] За рекомбинацией DJ следуют (как указано выше) перестройки V β -в-D β J β . Все сегменты генов между сегментами генов V β -D β -J β в новообразованном комплексе удаляются, и синтезируется первичный транскрипт, который включает ген константного домена (V β -D β -J β -C β ). Транскрипция мРНК удаляет любую промежуточную последовательность и обеспечивает трансляцию полноразмерного белка для β-цепи TCR.
Перестройка альфа (α) цепи TCR следует за перестройкой β цепи и напоминает перестройку V-в-J, описанную для легких цепей Ig (см. выше). Сборка β- и α-цепей приводит к образованию αβ-TCR, который экспрессируется на большинстве Т-клеток .
Процесс рекомбинации V(D)J опосредован рекомбиназой VDJ, которая представляет собой разнообразный набор ферментов. Ключевыми участвующими ферментами являются гены активации рекомбинации 1 и 2 (RAG), терминальная дезоксинуклеотидилтрансфераза (TdT) и нуклеаза Artemis , член повсеместного пути негомологичного соединения концов (NHEJ) для репарации ДНК. [4] Известно, что в этом процессе участвуют несколько других ферментов, в том числе ДНК-зависимая протеинкиназа (DNA-PK), белок 4 перекрестного комплементарного восстановления рентгеновских лучей (XRCC4), ДНК-лигаза IV , фактор негомологичного соединения концов 1 (NHEJ1; также известный как фактор Cernunnos или XRCC4 [XLF]), недавно обнаруженный паралог XRCC4 и XLF (PAXX) и ДНК-полимеразы λ и μ. [5] Некоторые задействованные ферменты специфичны для лимфоцитов ( например , RAG, TdT), в то время как другие встречаются в других типах клеток и даже повсеместно ( например , компоненты NHEJ).
Для поддержания специфичности рекомбинации рекомбиназа V(D)J распознает и связывается с последовательностями сигналов рекомбинации (RSS), фланкирующими сегменты генов переменной (V), разнообразия (D) и соединения (J). RSS состоят из трех элементов: гептамера из семи консервативных нуклеотидов, спейсерной области длиной 12 или 23 пары оснований и нонамера из девяти консервативных нуклеотидов. В то время как большинство RSS различаются по последовательности, консенсусные последовательности гептамера и нонамера — это CACAGTG и ACAAAAACC соответственно; и хотя последовательность спейсерной области плохо консервативна, длина высоко консервативна. [6] [7] Длина спейсерной области соответствует приблизительно одному (12 пар оснований) или двум виткам (23 пары оснований) спирали ДНК. Следуя так называемому правилу 12/23, сегменты генов, которые должны быть рекомбинированы, обычно примыкают к RSS с разной длиной спейсера ( т.е. один имеет «12RSS», а другой — «23RSS»). [8] Это важная особенность в регуляции рекомбинации V(D)J. [9]
Рекомбинация V(D)J начинается, когда рекомбиназа V(D)J (через активность RAG1) связывает RSS, фланкирующий кодирующий сегмент гена (V, D или J), и создает одноцепочечный надрез в ДНК между первым основанием RSS (прямо перед гептамером) и кодирующим сегментом. Это по существу энергетически нейтрально (нет необходимости в гидролизе АТФ ) и приводит к образованию свободной 3'- гидроксильной группы и 5'- фосфатной группы на той же цепи. Реактивная гидроксильная группа позиционируется рекомбиназой для атаки фосфодиэфирной связи противоположной цепи, образуя два конца ДНК: шпильку (стебель-петля) на кодирующем сегменте и тупой конец на сигнальном сегменте. [10] Текущая модель заключается в том, что надрез ДНК и образование шпильки происходят на обеих цепях одновременно (или почти одновременно) в комплексе, известном как центр рекомбинации . [11] [12] [13] [14]
Тупые концы сигнала лигируются вместе, образуя кольцевой фрагмент ДНК, содержащий все промежуточные последовательности между кодирующими сегментами, известный как сигнальный сустав (хотя он и кольцевой по своей природе, его не следует путать с плазмидой ) . Хотя первоначально считалось, что они теряются во время последовательных делений клеток, есть доказательства того, что сигнальные суставы могут повторно входить в геном и приводить к патологиям, активируя онкогены или прерывая функцию(и) гена-супрессора опухолей [Ref].
Кодирующие концы обрабатываются далее перед их лигированием несколькими событиями, которые в конечном итоге приводят к межцепочечному разнообразию. [15] Обработка начинается, когда ДНК-ПК связывается с каждым разорванным концом ДНК и привлекает несколько других белков, включая Artemis, XRCC4, ДНК-лигазу IV, Cernunnos и несколько ДНК-полимераз. [16] ДНК-ПК образует комплекс, который приводит к его автофосфорилированию , что приводит к активации Artemis. Шпильки кодирующего конца открываются активностью Artemis. [17] Если они открываются в центре, получится тупой конец ДНК; однако во многих случаях открытие происходит «смещено от центра» и приводит к тому, что на одной нити остаются дополнительные основания (выступ). Они известны как палиндромные (P) нуклеотиды из-за палиндромной природы последовательности, образующейся, когда ферменты репарации ДНК разрешают выступ. [18] Процесс открытия шпильки Артемисом является важнейшим этапом рекомбинации V(D)J и является дефектным в мышиной модели тяжелого комбинированного иммунодефицита (SCID) .
Затем XRCC4, Cernunnos и DNA-PK выравнивают концы ДНК и привлекают терминальную дезоксинуклеотидилтрансферазу (TdT), независимую от шаблона ДНК-полимеразу, которая добавляет нешаблонные (N) нуклеотиды к кодирующему концу. Добавление в основном случайное, но TdT проявляет предпочтение к нуклеотидам G/C. [19] Как и все известные ДНК-полимеразы, TdT добавляет нуклеотиды к одной цепи в направлении от 5' к 3'. [20]
Наконец, экзонуклеазы могут удалять основания из кодирующих концов (включая любые нуклеотиды P или N, которые могли образоваться). ДНК-полимеразы λ и μ затем вставляют дополнительные нуклеотиды по мере необходимости, чтобы сделать два конца совместимыми для соединения. Это стохастический процесс, поэтому может произойти любая комбинация добавления нуклеотидов P и N и экзонуклеолитического удаления (или вообще ничего). Наконец, обработанные кодирующие концы лигируются вместе ДНК-лигазой IV. [21]
Все эти события обработки приводят к паратопу , который является высоковариабельным, даже когда рекомбинируются те же самые сегменты генов. Рекомбинация V(D)J позволяет генерировать иммуноглобулины и рецепторы Т-клеток к антигенам, с которыми ни организм, ни его предок(и) не должны были ранее сталкиваться, что позволяет обеспечить адаптивный иммунный ответ на новые патогены, которые развиваются или на те, которые часто меняются ( например , сезонный грипп ). Однако основным предостережением к этому процессу является то, что последовательность ДНК должна оставаться в рамке , чтобы поддерживать правильную последовательность аминокислот в конечном белковом продукте. Если полученная последовательность находится вне рамки, развитие клетки будет остановлено, и клетка не доживет до зрелости. Таким образом, рекомбинация V(D)J является очень дорогостоящим процессом, который должен (и является) строго регулироваться и контролироваться.