Генетическое улучшение человека или генная инженерия человека относится к улучшению человека посредством генетической модификации . Это может быть сделано для лечения болезней ( генная терапия ), предотвращения возможности получения определенной болезни [1] (аналогично вакцинам), улучшения результатов спортсменов в спортивных мероприятиях ( генный допинг ) или для изменения внешнего вида, метаболизма и даже улучшения физических возможностей и умственных способностей, таких как память и интеллект. Эти генетические улучшения могут или не могут быть сделаны таким образом, чтобы изменение было наследственным (что вызвало обеспокоенность в научном сообществе). [2]
Генетика — это изучение генов и наследственных признаков, и хотя продолжающиеся достижения в этой области привели к развитию здравоохранения на многих уровнях, этические соображения стали особенно важными. Генная инженерия всегда была темой моральных дебатов среди биоэтиков. [3] Несмотря на то, что технологические достижения в этой области представляют захватывающие перспективы для биомедицинского усовершенствования, они также вызывают необходимость этических, общественных и практических оценок для понимания его влияния на биологию человека, эволюцию и окружающую среду. [4] Генетическое тестирование , генная инженерия и исследования стволовых клеток часто обсуждаются вместе из-за взаимосвязанных моральных аргументов, окружающих эти темы. Различие между восстановлением генов и улучшением генов является центральной идеей во многих моральных дебатах, касающихся генетического улучшения, поскольку некоторые утверждают, что восстановление генов морально допустимо, но что генетическое улучшение не связано с его потенциалом приводить к социальной несправедливости из-за дискриминационных евгенических инициатив. [5]
Моральные вопросы, связанные с генетическим тестированием, часто связаны с обязанностью предупреждать членов семьи в случае обнаружения наследственного заболевания, с тем, как врачи должны соблюдать автономию пациента и конфиденциальность в отношении генетического тестирования, с этикой генетической дискриминации и с моральной допустимостью использования генетического тестирования для предотвращения появления людей с серьезными нарушениями, например, посредством селективных абортов. [5] [6] [7]
Обязанность специалистов общественного здравоохранения заключается в определении потенциальных контактов и предложении тестирования на инфекционные заболевания, требующие отчетности. Специалисты общественного здравоохранения могут столкнуться с проблемами раскрытия информации, если расширение обязательного скрининга приведет к тому, что генетические аномалии будут классифицированы как состояния, подлежащие отчетности. [8] Генетические данные являются персональными и тесно связаны с личностью человека. Конфиденциальность касается не только работы, медицинского обслуживания и страхового покрытия, но и результаты генетических тестов всей семьи могут быть затронуты. У затронутых лиц также могут быть родители, дети, братья и сестры, сестры и даже дальние родственники, если состояние является либо генетически доминирующим, либо является их носителями. Более того, решения человека могут изменить всю его жизнь в зависимости от результата генетического теста. Результаты генетического тестирования могут быть раскрыты во всех аспектах жизни человека. [8] [9]
Неинвазивное пренатальное тестирование (НИПТ) позволяет точно определить пол плода на ранней стадии гестации, что вызывает опасения относительно потенциального упрощения прерывания беременности по половому признаку (ППП) из-за его простоты, сроков и точности. Несмотря на то, что ультразвуковая технология способна сделать то же самое, НИПТ в последнее время изучается, поскольку его способность точно определять пол плода на ранней стадии беременности достижима, с повышением точности уже на 7 неделе беременности. Этот временной интервал предшествует типичному сроку для других методов определения пола, таких как ультразвук или биопсия ворсин хориона (БВХ). [10] [11] Высокая ранняя точность НИПТ снижает неопределенность, связанную с другими методами, такими как вышеупомянутые, что приводит к более обоснованным решениям и устраняет риск неточных результатов, которые могут повлиять на принятие решений относительно ППП по половому признаку. Кроме того, НИПТ позволяет проводить селективный по полу ТОП в первом триместре, что более практично и позволяет беременным женщинам отложить установление связи между матерью и плодом. Эти соображения могут значительно облегчить проведение селективного по полу ТОП при использовании НИПТ. Поэтому крайне важно изучить этические проблемы в рамках принятия НИПТ. [12]
Этические вопросы, связанные с генной терапией и генетическим улучшением человека, касаются медицинских рисков и преимуществ терапии, обязанности использовать процедуры для предотвращения страданий, репродуктивной свободы в генетическом выборе и морали практики позитивной генетики, которая включает попытки улучшить нормальные функции. [5]
В каждом генетическом исследовании, проводимом для человечества, исследования должны проводиться в соответствии с заявлением об одобрении этического комитета, этическими, правовыми нормами и человеческой моралью. Терапия CAR T-клетками, которая должна стать новым методом лечения, направлена на изменение генетики T-клеток и преобразование клеток иммунной системы, которые не распознают рак, в клетки, которые распознают и борются с раком. Она работает с методом терапии T-клетками, который организован с помощью палиндромных повторов через определенные короткие интервалы, называемые CRISPR. [13]
Все исследования с участием людей в медицинских учреждениях должны быть зарегистрированы в публичной базе данных до набора участников первого испытания. Заявление о согласии на информированное согласие должно включать адекватную информацию о возможных конфликтах интересов, ожидаемых преимуществах исследования, его потенциальных рисках и других вопросах, связанных с дискомфортом, который оно может повлечь. [14]
Технологические достижения играют неотъемлемую роль в новых формах человеческого улучшения. В то время как фенотипические и соматические вмешательства для человеческого улучшения создают заслуживающие внимания этические и социологические дилеммы, наследственное генетическое вмешательство зародышевой линии требует еще более всесторонних обсуждений на индивидуальном и общественном уровнях. [15]
Моральные суждения основаны на эмпирических данных и подразумевают оценку перспективных соотношений риска и пользы, особенно в области биомедицины. Технология редактирования генома CRISPR поднимает этические вопросы по нескольким причинам. Если говорить более конкретно, существуют опасения относительно возможностей и технологических ограничений технологии CRISPR. Кроме того, долгосрочные эффекты измененных организмов и возможность передачи отредактированных генов последующим поколениям и возникновения непредвиденных эффектов — это еще две проблемы, которые следует учитывать. Принятие решений по вопросам морали становится более сложным, когда неопределенность этих обстоятельств препятствует адекватной оценке риска и пользы. [16]
Потенциальные преимущества революционных инструментов, таких как CRISPR, безграничны. Например, поскольку CRISPR/Cas9 может применяться непосредственно в эмбрионе, он сокращает время, необходимое для модификации целевых генов по сравнению с технологиями нацеливания генов, которые полагаются на использование эмбриональных стволовых (ЭС) клеток. Биоинформатические инструменты, разработанные для определения оптимальных последовательностей для проектирования направляющих РНК и оптимизации экспериментальных условий, предоставили очень надежные процедуры, которые гарантируют успешное введение желаемой мутации. [17] Основные преимущества, вероятно, появятся от использования безопасного и эффективного HGGM, что делает позицию предосторожности против HGGM неэтичной. [18]
В дальнейшем многие люди поддерживают создание организации, которая будет предоставлять рекомендации о том, как лучше всего контролировать этические сложности, упомянутые выше. Недавно группа ученых основала Ассоциацию ответственных исследований и инноваций в области редактирования генома (ARRIGE) для изучения и предоставления рекомендаций по этическому использованию редактирования генома. [19] [20]
Кроме того, Джанасов и Херлбат недавно выступили за создание и международное развитие междисциплинарной «глобальной обсерватории по регуляции генов». [21]
Исследователи предложили, чтобы дебаты по редактированию генов не контролировались научным сообществом. Предполагается, что сеть сосредоточится на сборе информации из разрозненных источников, выдвигая на первый план перспективы, которые часто упускаются из виду, и способствуя обмену через дисциплинарные и культурные различия. [22]
Подчеркивается, что вмешательства, направленные на улучшение человеческих черт с генетической точки зрения, зависят от понимания генной инженерии, а понимание результатов этих вмешательств требует понимания взаимодействия между людьми и другими живыми существами. Поэтому регулирование генной инженерии подчеркивает важность изучения знаний между людьми и окружающей средой. [15]
Чтобы справиться с этическими проблемами и неопределенностями, возникающими в связи с генетическими достижениями, было подчеркнуто, что разработка всеобъемлющих руководящих принципов, основанных на универсальных принципах, имеет важное значение. Важность принятия осторожного подхода для защиты фундаментальных ценностей, таких как автономия, глобальное благополучие и индивидуальное достоинство, была разъяснена при преодолении этих проблем. [23]
При рассмотрении генетического улучшения, генетические технологии следует рассматривать с широкой точки зрения, используя определение, которое охватывает не только прямую генетическую манипуляцию, но и косвенные технологии, такие как биосинтетические препараты. Было подчеркнуто, что следует уделять внимание ожиданиям, которые могут формировать маркетинг и доступность этих технологий, предвосхищая привлекательность новых методов лечения. Было отмечено, что эти ожидания потенциально означают поощрение соответствующей государственной политики и эффективных профессиональных правил. [24]
Клинические исследования стволовых клеток должны проводиться в соответствии с этическими ценностями. Это подразумевает полное соблюдение этических принципов, включая точную оценку баланса между рисками и выгодами, а также получение информированного и добровольного согласия участников. Необходимо усилить дизайн исследования, эффективно скоординировать научные и этические обзоры, предоставить гарантии того, что участники понимают основные особенности исследования, и обеспечить полное соблюдение дополнительных этических требований для раскрытия отрицательных результатов. [25]
Клиницисты должны понимать роль геномной медицины в точной диагностике пациентов и принятии решений о лечении. Было подчеркнуто, что подробная клиническая информация и экспертные мнения имеют решающее значение для точной интерпретации генетических вариантов. Хотя персонализированные медицинские приложения являются захватывающими, было отмечено, что воздействие и доказательная база каждого вмешательства должны быть тщательно оценены. Геном человека содержит миллионы генетических вариантов, поэтому следует проявлять осторожность и искать экспертные мнения при анализе геномных результатов. [26]
С открытием различных типов иммунных расстройств возникла необходимость в диверсификации профилактики и лечения. Изучаются разработки в области генной терапии для включения в сферу этого лечения, но, конечно, необходимы дополнительные исследования для увеличения положительных результатов и минимизации негативных эффектов применения генной терапии. [27] Система CRISPR/Cas9 также разработана как технология редактирования генов для лечения ВИЧ-1/СПИДа. CRISPR/Cas9 была разработана как новейшая технология редактирования генов, которая позволяет вставлять, удалять и модифицировать последовательности ДНК и обеспечивает преимущества в разрушении латентного вируса ВИЧ-1. Однако производство некоторых векторов для клеток, инфицированных ВИЧ-1, все еще ограничено, и необходимы дальнейшие исследования [28] Носительство ВИЧ также играет важную роль в заболеваемости раком шейки матки. Хотя существует множество личных и биологических факторов, способствующих развитию рака шейки матки, носительство ВИЧ коррелирует с его возникновением. Однако долгосрочные исследования эффективности профилактического лечения все еще продолжаются. Раннее образование, доступное во всем мире, будет играть важную роль в профилактике. [29] Когда лекарства и методы лечения последовательно соблюдаются, поддерживаются безопасные сексуальные практики и внедряются здоровые изменения образа жизни, риск передачи снижается у большинства людей, живущих с ВИЧ. Последовательно реализуемые проактивные профилактические стратегии могут значительно снизить заболеваемость ВИЧ-инфекцией. Обучение безопасным сексуальным практикам и изменениям, снижающим риск, для всех, независимо от того, являются ли они носителями ВИЧ или нет, имеет решающее значение для профилактики заболевания. [30] Однако контроль эпидемии ВИЧ и устранение стигмы, связанной с заболеванием, может быть невозможен только посредством общей кампании по повышению осведомленности о СПИДе. Замечено, что осведомленность о ВИЧ, особенно среди людей в регионах с низким социально-экономическим положением, значительно ниже, чем среди населения в целом. Хотя нет четкого решения для предотвращения передачи ВИЧ и распространения заболевания половым путем, сочетание профилактических мер может помочь контролировать распространение ВИЧ. Повышение знаний и осведомленности играет важную роль в предотвращении распространения ВИЧ, способствуя улучшению поведенческих решений с высоким восприятием риска. [31] Генетика играет ключевую роль в профилактике заболеваний, предлагая понимание предрасположенности человека к определенным состояниям и прокладывая путь для персонализированных стратегий по снижению риска заболеваний. Растущая область генетического тестирования и анализа предоставила ценные инструменты для определения генетических маркеров, связанных с различными заболеваниями, что позволяет принимать упреждающие меры по профилактике заболеваний [32]Профилактика заболеваний с помощью генетического тестирования становится проще, поскольку генетическое тестирование может раскрыть генетическую восприимчивость человека к определенным заболеваниям, что позволяет проводить раннее выявление и вмешательство, что может быть очень важным при таких заболеваниях, как наследственные виды рака, такие как рак груди [33] [34] и рак яичников. [35] [36] Наличие генетической информации может информировать о разработке подходов к точной медицине и целевых методов лечения для профилактики заболеваний в целом. Выявляя генетические факторы, способствующие восприимчивости к заболеваниям, такие как специфические мутации генов, связанные с аутоиммунными расстройствами, исследователи могут разрабатывать целевые методы лечения для модуляции иммунного ответа и предотвращения возникновения или прогрессирования этих состояний. [37] [38] [39]
Существует множество типов нейродегенеративных заболеваний. Болезнь Альцгеймера является одним из наиболее распространенных заболеваний, и она поражает миллионы людей во всем мире. Методы CRISPR-Cas9 могут быть использованы для предотвращения болезни Альцгеймера. Например, они обладают потенциалом для исправления аутосомно-доминантных мутаций, проблемных нейронов, восстановления связанных с ними электрофизиологических дефицитов и снижения пептидов Aβ. [40] Боковой амиотрофический склероз (БАС) является еще одним высоколетальным нейродегенеративным заболеванием. И технология CRISPR-Cas9 проста и эффективна для изменения специфических точечных мутаций при БАС. Также с помощью этой технологии Чен и его коллеги обнаружили некоторые важные изменения в основных показателях БАС, таких как уменьшение фокусов РНК, полипептидов и гаплодостаточности. [41] [40]
Некоторые люди испытывают иммунодефицит , состояние, при котором их иммунная система ослаблена и менее эффективна в защите от различных заболеваний, включая, но не ограничиваясь гриппом . Эта восприимчивость к инфекциям может быть связана с рядом факторов, включая генетические недостатки и генетические заболевания, такие как тяжелый комбинированный иммунодефицит (ТКИД). Некоторые генные терапии уже разработаны или разрабатываются для исправления этих генетических недостатков/заболеваний, тем самым делая этих людей менее восприимчивыми к подхватыванию дополнительных заболеваний (например, гриппа, ). [42] Эти генетические недостатки и заболевания могут существенно повлиять на способность организма вырабатывать эффективный иммунный ответ, делая людей уязвимыми для широкого спектра патогенов. Однако достижения в исследованиях и разработках генной терапии показали многообещающий потенциал в устранении этих генетических недостатков, однако не без связанных с этим проблем [43] [44]
Технология CRISPR является многообещающим инструментом не только для коррекции генетических заболеваний, но и для профилактики вирусных и бактериальных инфекций. Используя терапии CRISPR–Cas, исследователи нацелились на вирусные инфекции, такие как HSV-1, EBV, HIV-1, HBV, HPV и HCV, с продолжающимися клиническими испытаниями стратегии очистки от ВИЧ под названием EBT-101 . Кроме того, CRISPR продемонстрировал эффективность в профилактике вирусных инфекций, таких как IAV и SARS-CoV-2, путем нацеливания на геномы вирусной РНК с помощью Cas13d, и он использовался для сенсибилизации антибиотикорезистентного S. aureus к лечению с помощью Cas9, доставляемого через бактериофаги. [45]
Достижения в области редактирования генов и генной терапии обещают профилактику заболеваний путем устранения генетических факторов, связанных с определенными состояниями. Такие методы, как CRISPR-Cas9, предлагают потенциал для исправления генетических мутаций, связанных с наследственными заболеваниями, тем самым предотвращая их проявление в будущих поколениях и снижая бремя болезней. В ноябре 2018 года были созданы Лулу и Нана . [46] Используя кластеризованный регулярно интерспейсированный короткий палиндромный повтор (CRISPR)-Cas9, метод редактирования генов, они отключили ген под названием CCR5 в эмбрионах, стремясь закрыть белковый проход, который позволяет ВИЧ проникать в клетку, и сделать субъектов невосприимчивыми к вирусу ВИЧ.
Несмотря на имеющиеся доказательства технологии CRISPR, достижения в этой области продолжают сокращать ограничения. Исследователи разработали новый, щадящий метод редактирования генов для эмбрионов с использованием наночастиц и пептидных нуклеиновых кислот. Предоставляя инструменты редактирования без резких инъекций, метод успешно исправил гены у мышей, не нанося вреда развитию. Хотя этические и технические вопросы остаются, это исследование прокладывает путь для потенциального будущего использования в улучшении домашнего скота и подопытных животных, а может быть, даже в человеческих эмбрионах для профилактики или терапии заболеваний. [47]
Информирование будущих родителей об их восприимчивости к генетическим заболеваниям имеет решающее значение. Предимплантационная генетическая диагностика также имеет значение для профилактики заболеваний по наследству, поскольку амплификация и анализ всего генома помогают выбрать здоровый эмбрион для имплантации, предотвращая передачу фатального метаболического расстройства в семье. [48]
Генетическое улучшение человека становится потенциальным рубежом в профилактике заболеваний путем точного воздействия на генетическую предрасположенность к различным заболеваниям. С помощью таких методов, как CRISPR, можно редактировать или модифицировать определенные гены, связанные с заболеваниями, что открывает перспективы снижения наследственного риска таких состояний, как рак, сердечно-сосудистые заболевания или нейродегенеративные заболевания. Этот подход не только потенциально способен разорвать цикл определенных генетических нарушений, но и повлиять на траектории здоровья будущих поколений.
Более того, генетическое улучшение может расширить свое воздействие, сосредоточившись на укреплении иммунной системы и оптимизации общих параметров здоровья. Усиливая иммунные реакции и настраивая генетические факторы, связанные с общим благополучием, можно минимизировать восприимчивость к инфекционным заболеваниям. Этот проактивный подход к здоровью может способствовать тому, что население будет менее подвержено болезням и более устойчиво к экологическим вызовам.
Однако этические аспекты генетической манипуляции нельзя переоценивать. Нахождение тонкого баланса между научным прогрессом и этическими соображениями является обязательным. Надежные нормативные рамки и прозрачные руководящие принципы имеют решающее значение для обеспечения того, чтобы генетическое улучшение человека использовалось ответственно, избегая непреднамеренных последствий или потенциального неправильного использования. По мере развития этой области интеграция этических, правовых и социальных перспектив становится первостепенной для использования всего потенциала генетического улучшения человека для профилактики заболеваний при соблюдении индивидуальных прав и общественных ценностей. [49]
В целом, технология требует улучшения эффективности, точности и приложений. Иммуногенность, нецелевые эффекты, мутации, системы доставки и этические вопросы являются основными проблемами, с которыми сталкивается технология CRISPR. Проблемы безопасности, этические соображения и потенциальная возможность неправильного использования подчеркивают необходимость тщательного и ответственного изучения этих технологий. [50] Технология CRISPR-Cas9 предлагает так много для профилактики и лечения заболеваний, однако ее будущие аспекты, особенно те, которые влияют на следующие поколения, должны быть тщательно изучены.
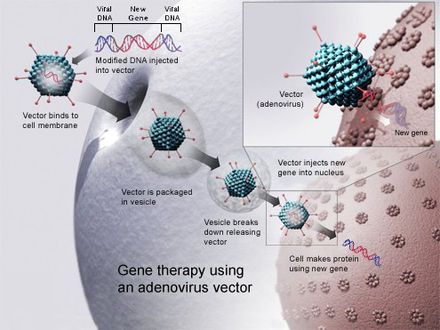
Модификация человеческих генов для лечения генетических заболеваний называется генной терапией . Генная терапия — это медицинская процедура, которая включает в себя введение генетического материала в клетки пациента для восстановления или исправления неисправного гена с целью лечения наследственных заболеваний. В период с 1989 по декабрь 2018 года было проведено более 2900 клинических испытаний генной терапии, более половины из которых находились в фазе I. [ 51] С тех пор стало доступно множество препаратов на основе генной терапии, таких как Золгенсма и Патисиран . Большинство этих подходов используют вирусные векторы , такие как аденоассоциированные вирусы (AAV), аденовирусы (AV) и лентивирусы (LV), для вставки или замены трансгенов in vivo или ex vivo . [52] [53]
В 2023 году были созданы наночастицы , которые действуют подобно вирусным векторам. Эти наночастицы, называемые биоортогонально сконструированными вирусоподобными рекомбинантными биосомами , демонстрируют сильные и быстрые способности связывания с рецепторами ЛПНП на поверхности клеток, что позволяет им эффективно проникать в клетки и доставлять гены в определенные целевые области, такие как опухолевые и артритные ткани . [54]
Агенты на основе РНК-интерференции , такие как зилебесиран , содержат siRNA , которая связывается с мРНК клеток-мишеней, изменяя экспрессию генов. [55]
Многие заболевания сложны и не могут быть эффективно вылечены с помощью простых стратегий таргетирования кодирующей последовательности. CRISPR/Cas9 — это одна из технологий, которая нацелена на двухцепочечные разрывы в геноме человека, модифицируя гены и предоставляя быстрый способ лечения генетических расстройств. Генная терапия с использованием метода редактирования генома CRISPR/Cas известна как генная терапия на основе CRISPR/Cas. Клетки млекопитающих могут быть генетически модифицированы с помощью простого, доступного и чрезвычайно специфичного метода CRISPR/Cas. Он может помочь с обменами одиночными основаниями, гомологично-направленной репарацией и негомологичным соединением концов. Основное применение — целевые нокауты генов, включающие нарушение кодирующих последовательностей для подавления вредоносных белков. С момента разработки метода редактирования генов CRISPR-Cas9 между 2010 и 2012 годами ученые смогли изменять гены, делая определенные разрывы в их ДНК. Эта технология имеет множество применений, включая редактирование генома и молекулярную диагностику.
Генная инженерия претерпела революцию благодаря технологии CRISPR/Cas, которая обеспечивает гибкую структуру для построения моделей заболеваний у более крупных животных. Этот прорыв создал новые возможности для оценки возможных терапевтических стратегий и понимания генетических основ различных заболеваний. Но для того, чтобы полностью реализовать потенциал генной терапии на основе CRISPR/Cas, необходимо устранить ряд препятствий. Повышение точности и эффективности редактирования систем CRISPR/Cas является одной из основных проблем. Хотя эта технология делает возможным точное редактирование генов, снижение нецелевых последствий по-прежнему остается серьезной проблемой. Непреднамеренные генетические изменения, возникающие в результате нецелевых модификаций, могут иметь непредвиденные эффекты или трудности. Используя улучшенные конструкции направляющей РНК, обновленные белки Cas и передовые инструменты биоинформатики, исследователи активно пытаются улучшить специфичность и снизить нецелевые эффекты процедур CRISPR/Cas. Более того, эффективная и специфическая доставка компонентов CRISPR в целевые ткани представляет собой еще одно препятствие. Системы доставки должны быть разработаны или оптимизированы для обеспечения того, чтобы механизм CRISPR достигал целевых клеток или органов эффективно и безопасно. Это включает в себя изучение различных методов доставки, таких как вирусные векторы, наночастицы или липидные носители для точной транспортировки компонентов CRISPR к целевым тканям, при этом минимизируя потенциальную токсичность или иммунные реакции.
Несмотря на недавний прогресс, необходимы дальнейшие исследования для разработки безопасных и эффективных методов CRISPR-терапии. Технология CRISPR/Cas9 сегодня активно не используется, однако продолжаются клинические испытания ее использования для лечения различных расстройств, включая серповидноклеточную анемию, рак шейки матки, связанный с вирусом папилломы человека (ВПЧ), респираторную инфекцию COVID-19, почечно-клеточную карциному и множественную миелому. [56]
Генная терапия стала перспективной областью медицинской науки , направленной на лечение различных генетических заболеваний путем модификации человеческих генов . Процесс включает введение генетического материала в клетки пациента с основной целью восстановления или исправления неисправных генов, которые способствуют наследственным заболеваниям . Эта инновационная медицинская процедура достигла значительных успехов и растущего числа клинических испытаний с момента своего создания.
В период с 1989 по декабрь 2018 года было проведено более 2900 клинических испытаний генной терапии, более половины из которых достигли стадии I фазы. За эти годы было разработано и предоставлено общественности несколько препаратов на основе генной терапии, что стало важным этапом в лечении генетических заболеваний . Примерами служат Золгенсма и Патисиран, которые продемонстрировали эффективность в лечении определенных генетических заболеваний.
Большинство подходов генной терапии используют вирусные векторы, такие как аденоассоциированные вирусы (AAV), аденовирусы (AV) и лентивирусы (LV), для облегчения вставки или замены трансгенов in vivo или ex vivo. Эти векторы служат в качестве средств доставки для введения терапевтического генетического материала в клетки пациента.
Заметным достижением 2023 года стало создание наночастиц , предназначенных для функционирования аналогично вирусным векторам. Эти биоортогонально спроектированные вирусоподобные рекомбинантные биосомы представляют собой новый подход к доставке генов. Они демонстрируют надежные и быстрые возможности связывания с рецепторами липопротеинов низкой плотности (ЛПНП) на поверхности клеток, что повышает их эффективность при проникновении в клетки. Эта возможность обеспечивает целевую доставку генов в определенные области, такие как опухолевые и артритные ткани. Это достижение имеет потенциал для повышения точности и эффективности генной терапии, минимизации нецелевых эффектов и улучшения общих терапевтических результатов.
В дополнение к подходам на основе вирусного вектора и наночастиц, РНК-интерференция (РНКi) стала еще одной стратегией в генной терапии. Такие агенты, как зилебесиран, используют малые интерферирующие РНК (siRNA), которые связываются с матричной РНК ( мРНК ) целевых клеток, эффективно изменяя экспрессию генов. Этот подход на основе РНК-интерференции обеспечивает целенаправленный и специфический метод регулирования активности генов, открывая дополнительные возможности для лечения генетических нарушений .
Непрерывное развитие методов генной терапии , а также разработка инновационных систем доставки и терапевтических агентов подчеркивают постоянную приверженность научного и медицинского сообщества развитию этой области и предоставлению эффективных методов лечения широкого спектра генетических заболеваний. [57]
Спортсмены могут использовать технологии генной терапии для улучшения своих результатов. [58] Генный допинг не известен, но множественная генная терапия может иметь такие эффекты. Кайзер и др. утверждают, что генный допинг может уравнять игровое поле , если все спортсмены получат равный доступ. Критики утверждают, что любое терапевтическое вмешательство в нетерапевтических/улучшенных целях ставит под угрозу этические основы медицины и спорта. [59] Поэтому эта технология, которая является подразделом генной инженерии, обычно называемым генным допингом в спорте, была запрещена из-за ее потенциальных рисков. [60] Основная цель генного допинга — помочь людям с заболеваниями. Однако спортсмены, осознающие связанные с ним риски для здоровья, прибегают к использованию этого метода в целях улучшения спортивных результатов. Запрет на неизбирательное использование генного допинга в спорте вступил в силу с 2003 года в соответствии с решением, принятым Всемирным антидопинговым агентством (WADA). [61] Исследование, проведенное в 2011 году, подчеркнуло важность решения проблем, связанных с генным допингом, и подчеркнуло важность быстрого понимания того, как генный допинг в спорте и лечебной физкультуре может повлиять на медицинские услуги, путем разъяснения его потенциала для улучшения спортивных результатов. Статья разъясняет, по данным Всемирного антидопингового агентства (WADA), как генный допинг представляет угрозу справедливости спорта. Кроме того, в статье рассматриваются проблемы со здоровьем, которые могут возникнуть в результате использования генного допинга исключительно в целях улучшения спортивных результатов. [62] Неправильное использование генного допинга для улучшения спортивных результатов представляет собой неэтичную практику и влечет за собой значительные риски для здоровья, включая, помимо прочего, рак, вирусные инфекции, инфаркт миокарда, повреждения скелета и аутоиммунные осложнения. Кроме того, генный допинг может привести к различным проблемам со здоровьем, таким как чрезмерное развитие мышц, приводящее к таким состояниям, как гипертоническая кардиомиопатия, и сделать кости и сухожилия более восприимчивыми к травмам [63] Несколько генов, таких как EPO, IGF1, VEGFA, GH, HIFs, PPARD, PCK1 и миостатины, являются известными вариантами для генного допинга. В частности, при генном допинге спортсмены используют такие вещества, как антитела к миостатину или блокаторы миостатина. Эти вещества способствуют увеличению массы спортсменов, содействию усиленному развитию мышц и повышению силы. Однако основные гены, используемые для генного допинга у людей, могут привести к осложнениям, таким как чрезмерный рост мышц, что может отрицательно повлиять на сердечно-сосудистую систему и увеличить вероятность травм. [64]Однако из-за недостаточной осведомленности об этих рисках многие спортсмены прибегают к использованию генного допинга в целях, расходящихся с его истинным предназначением. В сфере здоровья спортсменов, спортивной этики и этики честной игры ученые разработали различные технологии для обнаружения генного допинга. Хотя в первые годы используемая технология не была надежной, были проведены более обширные исследования для более совершенных методов выявления случаев генного допинга, которые оказались более успешными. Вначале ученые прибегали к таким методам, как ПЦР в ее различных формах. Это не увенчалось успехом из-за того, что такие технологии полагаются на экзон-экзонные соединения в ДНК. Это приводит к отсутствию точности в его обнаружении, поскольку результаты можно легко подделать, используя вводящие в заблуждение праймеры, и генный допинг останется незамеченным. [65] С появлением новых технологий более поздние исследования использовали секвенирование следующего поколения (NGS) в качестве метода обнаружения. С помощью биоинформатики эта технология превзошла предыдущие методы секвенирования в своем глубоком анализе состава ДНК. Секвенирование следующего поколения (NGS) фокусируется на использовании сложного метода анализа последовательности образца и сравнении его с уже существующей референтной последовательностью из базы данных генов. Таким образом, фальсификация праймера невозможна, поскольку обнаружение происходит на геномном уровне. Используя биоинформационные инструменты визуализации, данные можно легко считывать, а последовательности, которые не совпадают с референтной последовательностью, можно выделить. [66] [67] Совсем недавно одним из высокоэффективных методов анализа генного допинга, проведенных в 2023 году с использованием передовых технологий, является HiGDA (высокоэффективный анализ генного допинга), который использует технологию CRISPR/deadCas9. [68]
Этические проблемы, касающиеся генного допинга, существовали задолго до его открытия. Хотя генный допинг является относительно новым явлением, концепция генетического улучшения любого рода всегда была предметом этических проблем. Даже при использовании в терапевтических целях генная терапия несет в себе множество рисков из-за своей непредсказуемости и других причин. Факторы, не связанные со здоровьем, также поднимали этические вопросы. Они в основном касаются наследственного фактора этих методов лечения, когда редактирование генов в некоторых случаях может передаваться следующему поколению с более высокими показателями непредсказуемости и рисками в результатах. [69] По этой причине нетерапевтическое применение генной терапии можно рассматривать как более рискованный подход к немедицинской проблеме. [70]
В исследовании, от истории до наших дней, люди всегда были в соревновании. В то время как в прошлом воины соревновались, чтобы быть сильнее в войнах, сегодня есть соревнование, чтобы быть успешным в каждой области, и понятно, что эта психология является явлением, которое всегда существовало в истории человечества до сегодняшнего дня. Известно, что хотя у спортсмена есть генетический потенциал, он не может стать чемпионом, если он не соблюдает необходимые тренировки и образ жизни. Однако по мере роста конкуренции требуется как больше физической подготовки, так и больше умственной работоспособности. Так же, как воины в истории использовали некоторые травяные лекарства, чтобы выглядеть сильнее и агрессивнее, является фактом, что сегодня спортсмены прибегают к допинговым методам, чтобы повысить свои результаты. Однако эта ситуация противоречит спортивной этике, поскольку она не соответствует морали и пониманию игры. [71]
Одним из негативных последствий является риск рака, а позитивным эффектом является принятие мер предосторожности против определенных патологических состояний. Изменение генов может привести к непреднамеренным и непредсказуемым изменениям в организме, потенциально вызывая непредвиденные проблемы со здоровьем. Дальнейшие последствия генного допинга в спорте — это постоянная борьба с препаратами, не одобренными Всемирным антидопинговым агентством, и несправедливость по отношению к спортсменам, которые принимают препараты и не принимают их. Долгосрочные последствия генного допинга для здоровья могут быть не полностью поняты, и спортсмены могут столкнуться с проблемами со здоровьем в более позднем возрасте. [72]
Другие гипотетические методы генной терапии могли бы включать изменения внешнего вида, метаболизма, умственных способностей, таких как память и интеллект, а также благополучия ( например, путем повышения устойчивости к депрессии или облегчения хронической боли ). [73] [74]
Особое внимание уделено изучению проблем в понимании эффектов генных изменений на фенотипы, особенно в пределах естественного генетического разнообразия. Особое внимание уделяется потенциалу системной биологии и достижениям в технологиях генотипирования / фенотипирования для изучения сложных признаков. Несмотря на прогресс, признаются постоянные трудности в прогнозировании влияния генных изменений на фенотипические изменения, что подчеркивает постоянную потребность в исследованиях в этой области. [75]
Некоторые врожденные нарушения (например, затрагивающие опорно-двигательный аппарат ) могут влиять на внешность, а в некоторых случаях также вызывать физический дискомфорт. Модификация генов, вызывающих эти врожденные заболевания (у тех, у кого диагностированы мутации гена, известного как вызывающий эти заболевания), может предотвратить это.
- Фенотипические эффекты редактирования CRISPR-Cas9 у мышей, нацеленных на ген Tyr:
В комплексном исследовании CRISPR - Cas9 по редактированию генов, ген Tyr у мышей был выбран в качестве мишени, чтобы спровоцировать генетические изменения. Анализ не обнаружил никаких нецелевых эффектов у 42 субъектов, наблюдая изменения исключительно в предполагаемом локусе Tyr. Хотя конкретные данные не обсуждались явно, эти изменения могут потенциально влиять на неопределенные аспекты, такие как цвет шерсти, подчеркивая более широкий потенциал редактирования генов в индуцировании различных изменений фенотипа. [76]
Изменения в гене миостатина [77] также могут влиять на внешний вид.
Значительные количественные генетические открытия были сделаны в 1970-х и 1980-х годах, выйдя за рамки оценки наследуемости. Однако такие вопросы, как «Колоколообразная кривая» , снова всплыли, и к 1990-м годам ученые признали важность генетики для поведенческих черт, таких как интеллект . Конференция Американской психологической ассоциации , посвященная столетию, в 1992 году выбрала поведенческую генетику в качестве темы для прошлого, настоящего и будущего психологии . Молекулярная генетика синтезировалась, что привело к революции ДНК и поведенческой геномике , поскольку количественные генетические открытия замедлились. Индивидуальные поведенческие различия теперь можно предсказать на ранней стадии благодаря революции ДНК в поведенческих науках . Первый закон поведенческой генетики был установлен в 1978 году после того, как обзор тридцати исследований близнецов показал, что средняя оценка наследуемости для интеллекта составляла 46%. [78] Поведение также может быть изменено генетическим вмешательством. [79] Некоторые люди могут быть агрессивными, эгоистичными и неспособными хорошо функционировать в обществе. Мутации в GLI3 и других генах паттернирования связаны с этиологией HH, согласно генетическим исследованиям. Примерно у 50% -80% детей с HH наблюдается острый гнев и насилие, а у большинства пациентов наблюдаются проблемы экстернализации. Эпилепсии может предшествовать поведенческая нестабильность и интеллектуальная недееспособность. [80] В настоящее время ведутся исследования генов, которые являются или могут быть (частично) ответственны за эгоизм (например, ген безжалостности ), агрессию (например, ген воина ), альтруизм (например, OXTR , CD38 , COMT , DRD4 , DRD5 , IGF2 , GABRB2 [81] ).
С момента изобретения технологии рекомбинантной ДНК возлагались большие надежды на технологию редактирования генов для модификации генов и регулирования нашей биологии . Однако эти ожидания в основном не оправдались. Оценка целесообразного использования вмешательств зародышевой линии в репродуктивной медицине не должна основываться на опасениях по поводу улучшения или евгеники, несмотря на тот факт, что исследования редактирования генов значительно продвинулись в сторону клинического применения. [82]
Муковисцидоз (МВ) — наследственное заболевание , вызванное мутациями в гене трансмембранного регулятора проводимости (МВТ) при МВ . Хотя 90% пациентов с МВ можно вылечить, современные методы лечения не являются излечивающими и не устраняют весь спектр мутаций МВТ. Поэтому для лечения всех пациентов с МВ раз и навсегда необходима комплексная долгосрочная терапия . Технологии редактирования генов CRISPR/Cas разрабатываются как жизнеспособная платформа для генетического лечения. [83] Однако трудности с доставкой достаточного количества гена МВТ и поддержанием экспрессии в легких препятствуют эффективности генной терапии. Недавние технические прорывы, включая вирусный и невирусный векторный транспорт, альтернативные технологии нуклеиновых кислот и новые технологии, такие как редактирование генов мРНК и CRISPR , использовали наше понимание биологии МВ и эпителия дыхательных путей. [84]
Перенос генов человека обещал долгосрочное лекарство от наследственных заболеваний, таких как кистозный фиброз (КФ), с момента его зарождения и использования. Появление сложных технологий, которые позволяют вносить изменения на определенных участках с помощью программируемых нуклеаз, значительно оживило область генной терапии . [85] Ведутся некоторые исследования по гипотетическому лечению психиатрических расстройств с помощью генной терапии. Предполагается, что с помощью методов переноса генов можно (в экспериментальных условиях с использованием животных моделей) изменять экспрессию генов ЦНС и, таким образом, внутреннюю генерацию молекул, участвующих в нейронной пластичности и нейронной регенерации, и, таким образом, в конечном итоге изменять поведение. [86]
В последние годы стало возможным изменять потребление этанола в животных моделях. В частности, это было сделано путем воздействия на экспрессию гена альдегиддегидрогеназы (ALDH2), что привело к значительному изменению поведения, связанного с употреблением алкоголя. [87] Снижение p11, белка, связывающего рецептор серотонина, в прилежащем ядре привело к поведению, похожему на депрессию, у грызунов, в то время как восстановление экспрессии гена p11 в этой анатомической области изменило это поведение. [73]
Недавно было также показано, что перенос гена CBP (белок связывания CREB (c-AMP response element binding protein)) улучшает когнитивные нарушения в животной модели деменции Альцгеймера посредством увеличения экспрессии BDNF (нейротрофического фактора мозга). [88] Те же авторы также смогли показать в этом исследовании, что накопление амилоида-β (Aβ) препятствует активности CREB, который физиологически участвует в формировании памяти.
В другом исследовании было показано, что отложение Aβ и образование бляшек можно уменьшить путем устойчивой экспрессии гена неприлизина (эндопептидазы), что также привело к улучшениям на поведенческом (то есть когнитивном) уровне. [89]
Аналогичным образом, внутримозговой перенос гена ECE (эндотелин-превращающего фермента) с помощью вирусного вектора, стереотаксически введенного в правую переднюю кору и гиппокамп, также показал снижение отложений Aβ в трансгенной мышиной модели деменции Альцгеймера. [90]
Также ведутся исследования по геноэкономике , протонауке , которая основана на идее, что финансовое поведение человека можно проследить по его ДНК и что гены связаны с экономическим поведением . По состоянию на 2015 год [обновлять]результаты были неубедительными. Были выявлены некоторые незначительные корреляции. [91] [92]
Некоторые исследования показывают, что наши гены могут влиять на некоторые из наших поведений. Например, некоторые гены могут следовать за нашим состоянием застоя, в то время как другие могут быть ответственны за наши вредные привычки. Приведем пример, ген MAOA (монооксидаза А), особенность этого гена влияет на высвобождение гормонов, таких как серотонин, адреналин и дофамин, и подавляет их. Он мешает нам реагировать в некоторых ситуациях и останавливаться и принимать быстрые решения в других ситуациях, что может заставить нас принимать неправильные решения в возможных плохих ситуациях. В результате некоторых исследований у людей, несущих этот ген, можно наблюдать такие состояния настроения, как агрессия, чувство сострадания и раздражительность. Кроме того, в результате исследований, проведенных на людях, несущих ген MAOA, этот ген может передаваться генетически от родителей, а мутации также могут развиваться из-за более поздних эпигенетических причин. Если говорить об эпигенетических причинах, дети семей, растущих в плохих условиях, начинают реализовывать все, что видят у своих родителей. По этой причине в будущем у таких детей начинают проявляться плохие привычки или поведение, такие как раздражительность и агрессия. [93]
В 2022 году Академия военных наук Народно-освободительной армии сообщила о примечательном эксперименте, в ходе которого военные ученые вставили ген тихоходки в эмбриональные стволовые клетки человека . Целью этого эксперимента было изучение потенциального повышения устойчивости солдат к острому лучевому синдрому , тем самым увеличивая их способность выживать при ядерных осадках. Эта разработка отражает пересечение генной инженерии и военных исследований с акцентом на биоулучшение для военнослужащих. [94]
Технологии CRISPR/Cas9 привлекли внимание своими потенциальными применениями в военных контекстах. Различные проекты находятся в стадии реализации, в том числе те, которые направлены на защиту солдат от конкретных проблем. Например, исследователи изучают использование CRISPR/Cas9 для обеспечения защиты от обморожения , снижения уровня стресса, облегчения лишения сна и повышения силы и выносливости. Агентство перспективных исследовательских проектов Министерства обороны ( DARPA ) активно участвует в исследовании и разработке этих технологий. Один из их проектов направлен на создание человеческих клеток для работы в качестве фабрик питательных веществ, потенциально оптимизируя производительность и устойчивость солдат в сложных условиях. [95]
Кроме того, военные исследователи проводят испытания на животных для изучения профилактического лечения для долгосрочной защиты от химического оружия массового поражения. Это включает использование непатогенных векторов AAV8 для доставки потенциального каталитического биоуничтожителя, PON1-IF11, в кровоток мышей . Эти инициативы подчеркивают более широкое исследование генетических и молекулярных вмешательств для повышения военных возможностей и защиты персонала от различных угроз. [96]
В сфере биоулучшения были высказаны опасения по поводу использования пищевых добавок и других биомедицинских улучшений военнослужащими. Значительная часть американских сил специального назначения, как сообщается, использует пищевые добавки для повышения производительности, но масштабы использования других методов биоулучшения, таких как стероиды, гормон роста человека и эритропоэтин, остаются неясными. Отсутствие завершенных испытаний безопасности и эффективности для этих биоулучшений поднимает этические и нормативные вопросы. Эта обеспокоенность не нова, поскольку проблемы, связанные с использованием не по назначению таких продуктов, как пиридостигмина бромид и вакцина ботулинического анатоксина во время войны в Персидском заливе , а также Программа иммунизации вакциной от сибирской язвы Министерства обороны в 1998 году, вызвали дискуссии о необходимости тщательного одобрения FDA для конкретных военных приложений. [97]
Пересечение генной инженерии , технологий CRISPR/Cas9 и военных исследований вводит сложные этические соображения относительно потенциального увеличения человеческих возможностей в военных целях. Установление баланса между научными достижениями, этическими стандартами и нормативным надзором остается критически важным, поскольку эти технологии продолжают развиваться. [98]
Джордж Чёрч составил список потенциальных генетических модификаций, основанный на научных исследованиях, для потенциально полезных черт, таких как меньшая потребность во сне , изменения, связанные с познанием, которые защищают от болезни Альцгеймера, устойчивость к болезням, более высокая мышечная масса и улучшенные способности к обучению , а также некоторые связанные с этим исследования и потенциальные негативные эффекты. [99] [100]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )