Генная инженерия , также называемая генетической модификацией или генетической манипуляцией , — это модификация и манипуляция генами организма с использованием технологий . Это набор технологий, используемых для изменения генетического состава клеток, включая перенос генов в пределах и за пределы границ вида для получения улучшенных или новых организмов .
Новая ДНК получается либо путем выделения и копирования генетического материала, представляющего интерес, с использованием методов рекомбинантной ДНК , либо путем искусственного синтеза ДНК. Обычно создается конструкция , которая используется для вставки этой ДНК в организм хозяина. Первая рекомбинантная молекула ДНК была создана Полом Бергом в 1972 году путем объединения ДНК вируса обезьян SV40 с вирусом лямбда .
Помимо вставки генов , этот процесс может быть использован для удаления или « выбивания » генов. Новая ДНК может быть вставлена случайным образом или нацелена на определенную часть генома . [ 1]
Организм, созданный с помощью генной инженерии, считается генетически модифицированным (ГМ), а полученная сущность является генетически модифицированным организмом (ГМО). Первым ГМО была бактерия , созданная Гербертом Бойером и Стэнли Коэном в 1973 году. Рудольф Йениш создал первое ГМ-животное, вживив чужеродную ДНК мыши в 1974 году. Первая компания, сосредоточившаяся на генной инженерии, Genentech , была основана в 1976 году и начала производство человеческих белков. Генетически модифицированный человеческий инсулин был произведен в 1978 году, а инсулин-продуцирующие бактерии были коммерциализированы в 1982 году. Генетически модифицированные продукты питания продаются с 1994 года с выпуском томата Flavr Savr . Flavr Savr был разработан для более длительного срока хранения, но большинство современных ГМ-культур модифицированы для повышения устойчивости к насекомым и гербицидам. GloFish , первый ГМО, разработанный в качестве домашнего животного, поступил в продажу в США в декабре 2003 года. В 2016 году в продажу поступил лосось, модифицированный гормоном роста.
Генная инженерия применяется во многих областях, включая исследования, медицину, промышленную биотехнологию и сельское хозяйство. В исследованиях ГМО используются для изучения функции и экспрессии генов посредством экспериментов по потере функции, приобретению функции, отслеживанию и экспрессии. Выключая гены, ответственные за определенные состояния, можно создавать организмы животных-моделей человеческих заболеваний. Помимо производства гормонов, вакцин и других лекарств, генная инженерия имеет потенциал для лечения генетических заболеваний с помощью генной терапии . Клетки яичников китайского хомячка (CHO) используются в промышленной генной инженерии. Кроме того, вакцины мРНК производятся с помощью генной инженерии для лечения вирусов, таких как COVID-19 . Те же методы, которые используются для производства лекарств, могут также иметь промышленное применение, например, производство ферментов для стирального порошка, сыров и других продуктов.
Рост коммерциализации генетически модифицированных культур принес экономическую выгоду фермерам во многих странах, но также стал источником большинства споров вокруг этой технологии. Это присутствовало с самого начала ее использования; первые полевые испытания были уничтожены активистами, выступающими против ГМО. Хотя существует научный консенсус , что в настоящее время доступные продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, критики считают безопасность ГМ-продуктов основной проблемой. Поток генов , воздействие на нецелевые организмы, контроль за поставками продовольствия и права интеллектуальной собственности также были подняты в качестве потенциальных проблем. Эти опасения привели к разработке нормативно-правовой базы, которая началась в 1975 году. Это привело к международному договору, Картахенскому протоколу по биобезопасности , который был принят в 2000 году. Отдельные страны разработали свои собственные системы регулирования в отношении ГМО, при этом наиболее заметные различия наблюдаются между Соединенными Штатами и Европой .
Генная инженерия : процесс внедрения новой генетической информации в существующие клетки с целью модификации конкретного организма с целью изменения его характеристик.
Примечание : Адаптировано из [2] [3]
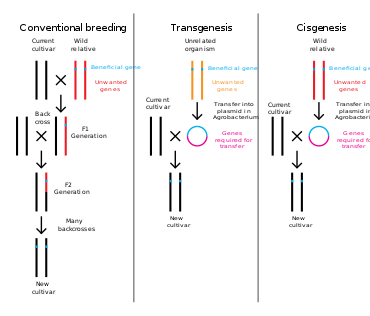
Генная инженерия — это процесс, который изменяет генетическую структуру организма путем удаления или введения ДНК или модификации существующего генетического материала in situ. В отличие от традиционной селекции животных и растений , которая включает в себя проведение множественных скрещиваний и последующий отбор организма с желаемым фенотипом , генная инженерия берет ген непосредственно из одного организма и доставляет его в другой. Это намного быстрее, может использоваться для вставки любых генов из любого организма (даже из разных доменов ) и предотвращает добавление других нежелательных генов. [4]
Генная инженерия потенциально может исправить серьезные генетические нарушения у людей, заменив дефектный ген на функционирующий. [5] Это важный инструмент в исследовании, который позволяет изучать функцию определенных генов. [6] Лекарства, вакцины и другие продукты были получены из организмов, созданных для их производства. [7] Были выведены культуры , которые способствуют продовольственной безопасности за счет повышения урожайности, пищевой ценности и устойчивости к экологическим стрессам. [8]
ДНК может быть введена непосредственно в организм хозяина или в клетку, которая затем сливается или гибридизуется с хозяином. [9] Это основано на методах рекомбинантных нуклеиновых кислот для формирования новых комбинаций наследуемого генетического материала с последующим включением этого материала либо косвенно через векторную систему, либо напрямую через микроинъекцию , макроинъекцию или микроинкапсуляцию .
Генная инженерия обычно не включает в себя традиционную селекцию, экстракорпоральное оплодотворение , индукцию полиплоидии , мутагенез и методы слияния клеток, которые не используют рекомбинантные нуклеиновые кислоты или генетически модифицированный организм в этом процессе. [9] Однако некоторые широкие определения генной инженерии включают селективную селекцию . [10] Клонирование и исследования стволовых клеток , хотя и не считаются генной инженерией, [11] тесно связаны, и генная инженерия может использоваться в них. [12] Синтетическая биология является новой дисциплиной, которая выводит генную инженерию на шаг вперед, вводя искусственно синтезированный материал в организм. [13]
Растения, животные или микроорганизмы, которые были изменены с помощью генной инженерии, называются генетически модифицированными организмами или ГМО. [14] Если генетический материал другого вида добавляется к хозяину, полученный организм называется трансгенным . Если используется генетический материал того же вида или вида, который может естественным образом размножаться с хозяином, полученный организм называется цисгенным . [15] Если генная инженерия используется для удаления генетического материала из целевого организма, полученный организм называется нокаутированным организмом. [16] В Европе генетическая модификация является синонимом генной инженерии, в то время как в Соединенных Штатах Америки и Канаде генетическая модификация может также использоваться для обозначения более традиционных методов разведения. [17] [18] [19]
Люди изменяли геномы видов на протяжении тысяч лет посредством селективного разведения или искусственного отбора [20] : 1 [21] : 1 в отличие от естественного отбора . Совсем недавно мутационная селекция использовала воздействие химикатов или радиации для получения высокой частоты случайных мутаций в целях селективного разведения. Генная инженерия как прямое манипулирование ДНК людьми вне селекции и мутаций существует только с 1970-х годов. Термин «генетическая инженерия» был придуман русским генетиком Николаем Тимофеевым-Ресовским в его статье 1934 года «Экспериментальное производство мутаций», опубликованной в британском журнале Biological Reviews. [22] Джек Уильямсон использовал этот термин в своем научно-фантастическом романе «Остров Дракона», опубликованном в 1951 году [23] — за год до того, как роль ДНК в наследственности была подтверждена Альфредом Херши и Мартой Чейз , [24] и за два года до того, как Джеймс Уотсон и Фрэнсис Крик показали, что молекула ДНК имеет структуру двойной спирали, — хотя общая концепция прямой генетической манипуляции была исследована в зачаточной форме в научно-фантастическом рассказе Стэнли Г. Вайнбаума 1936 года «Остров Протея» . [25] [26]

В 1972 году Пол Берг создал первые рекомбинантные молекулы ДНК, объединив ДНК вируса обезьян SV40 с ДНК вируса лямбда . [27] В 1973 году Герберт Бойер и Стэнли Коэн создали первый трансгенный организм , вставив гены устойчивости к антибиотикам в плазмиду бактерии Escherichia coli . [28] [29] Год спустя Рудольф Йениш создал трансгенную мышь, введя чужеродную ДНК в ее эмбрион, что сделало ее первым в мире трансгенным животным . [30] Эти достижения привели к обеспокоенности в научном сообществе потенциальными рисками генной инженерии, которые впервые подробно обсуждались на конференции в Асиломаре в 1975 году. Одной из главных рекомендаций этой встречи было установление государственного надзора за исследованиями рекомбинантной ДНК до тех пор, пока технология не будет признана безопасной. [31] [32]
В 1976 году Герберт Бойер и Роберт Свенсон основали Genentech, первую компанию по генной инженерии, а год спустя компания произвела человеческий белок ( соматостатин ) в E. coli . Genentech объявила о производстве генетически модифицированного человеческого инсулина в 1978 году. [33] В 1980 году Верховный суд США в деле Даймонд против Чакрабарти постановил, что генетически измененная жизнь может быть запатентована. [34] Инсулин , произведенный бактериями, был одобрен для выпуска Управлением по контролю за продуктами и лекарствами (FDA) в 1982 году. [35]
В 1983 году биотехнологическая компания Advanced Genetic Sciences (AGS) подала заявку на получение разрешения правительства США на проведение полевых испытаний штамма Pseudomonas syringae, не содержащего льда, для защиты урожая от заморозков, но экологические группы и протестующие отложили полевые испытания на четыре года из-за юридических проблем. [36] В 1987 году штамм P. syringae, не содержащий льда, стал первым генетически модифицированным организмом (ГМО), выпущенным в окружающую среду [37] , когда им были опрысканы клубничное и картофельное поля в Калифорнии. [38] Оба испытательных поля подверглись нападению со стороны групп активистов накануне проведения испытаний: «Первое в мире испытательное место привлекло первого в мире уничтожителя полей». [37]
Первые полевые испытания генетически модифицированных растений прошли во Франции и США в 1986 году, растения табака были модифицированы так, чтобы быть устойчивыми к гербицидам . [39] Китайская Народная Республика была первой страной, которая коммерциализировала трансгенные растения, представив устойчивый к вирусам табак в 1992 году. [40] В 1994 году Calgene получила одобрение на коммерческий выпуск первого генетически модифицированного продукта питания , Flavr Savr , томата, модифицированного для более длительного срока хранения. [41] В 1994 году Европейский Союз одобрил табак, модифицированный так, чтобы быть устойчивым к гербициду бромоксинилу , что сделало его первой генетически модифицированной культурой, коммерциализированной в Европе. [42] В 1995 году картофель Bt был признан безопасным Агентством по охране окружающей среды , после того как был одобрен FDA, что сделало его первой культурой, производящей пестициды, одобренной в США. [43] В 2009 году 11 трансгенных культур выращивались в коммерческих целях в 25 странах, крупнейшими из которых по площади выращивания были США, Бразилия, Аргентина, Индия, Канада, Китай, Парагвай и Южная Африка. [44]
В 2010 году ученые из Института Дж. Крейга Вентера создали первый синтетический геном и вставили его в пустую бактериальную клетку. Полученная бактерия, названная Mycoplasma laboratorium , могла реплицироваться и производить белки. [45] [46] Четыре года спустя это было сделано на шаг дальше, когда была разработана бактерия, которая реплицировала плазмиду, содержащую уникальную пару оснований , создавая первый организм, спроектированный для использования расширенного генетического алфавита. [47] [48] В 2012 году Дженнифер Дудна и Эммануэль Шарпантье объединились для разработки системы CRISPR/Cas9 , [49] [50] метода, который можно использовать для легкого и специфического изменения генома практически любого организма. [51]

Создание ГМО — многоэтапный процесс. Генные инженеры должны сначала выбрать, какой ген они хотят вставить в организм. Это обусловлено целью конечного организма и основано на более ранних исследованиях. Генетические скрининги могут быть проведены для определения потенциальных генов, а затем дополнительные тесты могут быть использованы для выявления лучших кандидатов. Развитие микрочипов , транскриптомики и секвенирования генома значительно упростило поиск подходящих генов. [52] Удача также играет свою роль: ген Roundup Ready был обнаружен после того, как ученые заметили, что бактерия процветает в присутствии гербицида. [53]
Следующий шаг — выделение гена-кандидата. Клетка , содержащая ген, открывается, и ДНК очищается. [54] Ген разделяется с помощью ферментов рестрикции для разрезания ДНК на фрагменты [55] или полимеразной цепной реакции (ПЦР) для амплификации сегмента гена. [56] Затем эти сегменты могут быть извлечены с помощью гель-электрофореза . Если выбранный ген или геном донорского организма хорошо изучен, он может быть уже доступен из генетической библиотеки . Если последовательность ДНК известна, но нет доступных копий гена, его также можно искусственно синтезировать . [57] После выделения ген лигируется в плазмиду , которая затем вставляется в бактерию. Плазмида реплицируется при делении бактерий, обеспечивая неограниченное количество доступных копий гена. [58] Плазмида RK2 примечательна своей способностью реплицироваться в самых разных одноклеточных организмах , что делает ее подходящей в качестве инструмента генной инженерии. [59]
Перед тем, как ген будет вставлен в целевой организм, его необходимо объединить с другими генетическими элементами. К ним относятся промотор и терминаторная область, которые инициируют и заканчивают транскрипцию . Добавляется селективный маркерный ген, который в большинстве случаев придает устойчивость к антибиотикам , поэтому исследователи могут легко определить, какие клетки были успешно трансформированы. Ген также может быть модифицирован на этом этапе для лучшей экспрессии или эффективности. Эти манипуляции проводятся с использованием методов рекомбинантной ДНК , таких как рестрикционные переваривания , лигирования и молекулярное клонирование. [60]

Существует ряд методов, используемых для вставки генетического материала в геном хозяина. Некоторые бактерии могут естественным образом поглощать чужеродную ДНК . Эта способность может быть вызвана у других бактерий посредством стресса (например, термического или электрического шока), который увеличивает проницаемость клеточной мембраны для ДНК; поглощенная ДНК может либо интегрироваться с геномом, либо существовать как внехромосомная ДНК . ДНК обычно вводится в клетки животных с помощью микроинъекции , когда ее можно ввести через ядерную оболочку клетки непосредственно в ядро , или с помощью вирусных векторов . [61]
Геномы растений могут быть сконструированы физическими методами или с использованием Agrobacterium для доставки последовательностей, размещенных в бинарных векторах T-ДНК . В растениях ДНК часто вставляется с использованием трансформации, опосредованной Agrobacterium , [62] используя преимущество последовательности T-ДНК Agrobacterium , которая позволяет естественным образом вставлять генетический материал в растительные клетки. [63] Другие методы включают биолистику , когда частицы золота или вольфрама покрываются ДНК, а затем выстреливаются в молодые растительные клетки, [64] и электропорацию , которая включает использование электрического удара, чтобы сделать клеточную мембрану проницаемой для плазмидной ДНК.
Поскольку только одна клетка трансформируется генетическим материалом, организм должен быть регенерирован из этой единственной клетки. У растений это достигается с помощью использования культуры тканей . [65] [66] У животных необходимо обеспечить присутствие вставленной ДНК в эмбриональных стволовых клетках . [67] Бактерии состоят из одной клетки и размножаются клонально, поэтому регенерация не требуется. Селективные маркеры используются для легкой дифференциации трансформированных и нетрансформированных клеток. Эти маркеры обычно присутствуют в трансгенном организме, хотя был разработан ряд стратегий, которые могут удалить селективный маркер из зрелого трансгенного растения. [68]

Дальнейшее тестирование с использованием ПЦР, гибридизации по Саузерну и секвенирования ДНК проводится для подтверждения того, что организм содержит новый ген. [69] Эти тесты также могут подтвердить хромосомное расположение и количество копий вставленного гена. Наличие гена не гарантирует, что он будет экспрессироваться на соответствующих уровнях в целевой ткани, поэтому также используются методы, которые ищут и измеряют продукты гена (РНК и белок). К ним относятся гибридизация по Северу , количественная ОТ-ПЦР , вестерн-блот , иммунофлуоресценция , ИФА и фенотипический анализ. [70]
Новый генетический материал может быть вставлен случайным образом в геном хозяина или направлен в определенное место. Методика нацеливания генов использует гомологичную рекомбинацию для внесения желаемых изменений в определенный эндогенный ген. Это, как правило, происходит с относительно низкой частотой у растений и животных и, как правило, требует использования селективных маркеров . Частота нацеливания генов может быть значительно увеличена с помощью редактирования генома . Редактирование генома использует искусственно созданные нуклеазы , которые создают определенные двухцепочечные разрывы в желаемых местах генома и используют эндогенные механизмы клетки для восстановления индуцированного разрыва естественными процессами гомологичной рекомбинации и негомологичного соединения концов . Существует четыре семейства сконструированных нуклеаз: мегануклеазы , [71] [72] нуклеазы с цинковыми пальцами , [73] [74] эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), [75] [76] и система Cas9-guideRNA (адаптированная из CRISPR ). [77] [78] TALEN и CRISPR являются двумя наиболее часто используемыми, и каждая из них имеет свои преимущества. [79] TALEN обладают большей целевой специфичностью, в то время как CRISPR проще в разработке и более эффективен. [79] Помимо улучшения нацеливания генов, сконструированные нуклеазы могут использоваться для введения мутаций в эндогенные гены, которые приводят к нокауту гена . [80] [81]
Генная инженерия применяется в медицине, исследованиях, промышленности и сельском хозяйстве и может использоваться на широком спектре растений, животных и микроорганизмов. Бактерии , первые организмы, которые были генетически модифицированы, могут иметь вставленную плазмидную ДНК, содержащую новые гены, которые кодируют лекарства или ферменты, которые обрабатывают пищу и другие субстраты . [82] [83] Растения были модифицированы для защиты от насекомых, устойчивости к гербицидам , устойчивости к вирусам, улучшенного питания, толерантности к давлению окружающей среды и производства съедобных вакцин . [84] Большинство коммерциализированных ГМО являются устойчивыми к насекомым или гербицидам сельскохозяйственными культурами. [85] Генетически модифицированные животные использовались для исследований, модельных животных и производства сельскохозяйственных или фармацевтических продуктов. Генетически модифицированные животные включают животных с выбитыми генами , повышенной восприимчивостью к болезням , гормонами для дополнительного роста и способностью экспрессировать белки в своем молоке. [86]
Генная инженерия имеет множество применений в медицине, включая производство лекарств, создание модельных животных , которые имитируют человеческие условия, и генную терапию . Одним из самых ранних применений генной инженерии было массовое производство человеческого инсулина в бактериях. [33] Это применение теперь применяется к человеческим гормонам роста , фолликулостимулирующим гормонам (для лечения бесплодия), человеческому альбумину , моноклональным антителам , антигемофильным факторам , вакцинам и многим другим препаратам. [87] [88] Гибридомы мышей , клетки, слитые вместе для создания моноклональных антител , были адаптированы с помощью генной инженерии для создания человеческих моноклональных антител. [89] Генетически модифицированные вирусы разрабатываются, которые все еще могут обеспечивать иммунитет, но лишены инфекционных последовательностей . [90]
Генная инженерия также используется для создания животных моделей человеческих заболеваний. Генетически модифицированные мыши являются наиболее распространенной генетически модифицированной животной моделью. [91] Их использовали для изучения и моделирования рака ( онкомышь ), ожирения, болезней сердца, диабета, артрита, злоупотребления психоактивными веществами, тревожности, старения и болезни Паркинсона. [92] Потенциальные лекарства можно тестировать на этих мышиных моделях.
Генная терапия — это генная инженерия людей , как правило, путем замены дефектных генов эффективными. Клинические исследования с использованием соматической генной терапии проводились при нескольких заболеваниях, включая Х-сцепленный ТКИД , [93] хронический лимфоцитарный лейкоз (ХЛЛ), [94] [95] и болезнь Паркинсона . [96] В 2012 году Alipogene tiparvovec стал первым препаратом генной терапии, одобренным для клинического использования. [97] [98] В 2015 году вирус был использован для вставки здорового гена в клетки кожи мальчика, страдающего редким кожным заболеванием, буллезным эпидермолизом , с целью выращивания, а затем пересадки здоровой кожи на 80 процентов тела мальчика, пораженного болезнью. [99]
Генная терапия зародышевой линии приведет к тому, что любые изменения будут наследуемыми, что вызвало обеспокоенность в научном сообществе. [100] [101] В 2015 году CRISPR использовался для редактирования ДНК нежизнеспособных человеческих эмбрионов , [102] [103] ведущие ученые крупнейших мировых академий призвали к мораторию на наследуемое редактирование генома человека. [104] Существуют также опасения, что эта технология может быть использована не только для лечения, но и для улучшения, модификации или изменения внешнего вида, адаптивности, интеллекта, характера или поведения человека. [105] Различие между излечением и улучшением также может быть трудно установить. [106] В ноябре 2018 года Хэ Цзянькуй объявил, что он отредактировал геномы двух человеческих эмбрионов, чтобы попытаться отключить ген CCR5 , который кодирует рецептор, который ВИЧ использует для проникновения в клетки. Работа была широко осуждена как неэтичная, опасная и преждевременная. [107] В настоящее время модификация зародышевой линии запрещена в 40 странах. Ученые, которые проводят такого рода исследования, часто позволяют эмбрионам расти в течение нескольких дней, не позволяя им развиться в ребенка. [108]
Исследователи изменяют геном свиней, чтобы вызвать рост человеческих органов, с целью повышения успешности трансплантации органов от свиньи человеку . [109] Ученые создают «генные драйвы», изменяя геномы комаров, чтобы сделать их невосприимчивыми к малярии, а затем пытаются распространить генетически измененных комаров по всей популяции комаров в надежде искоренить эту болезнь. [110]
Генная инженерия является важным инструментом для ученых-естественников , а создание трансгенных организмов является одним из важнейших инструментов для анализа функции генов. [111] Гены и другая генетическая информация из широкого спектра организмов может быть вставлена в бактерии для хранения и модификации, создавая в процессе генетически модифицированные бактерии . Бактерии дешевы, просты в выращивании, клонируются , быстро размножаются, относительно легко трансформируются и могут храниться при температуре -80 °C практически бесконечно. После того, как ген выделен, его можно хранить внутри бактерий, обеспечивая неограниченный запас для исследований. [112]
Организмы генетически модифицированы для обнаружения функций определенных генов. Это может быть влияние на фенотип организма, где ген экспрессируется или с какими другими генами он взаимодействует. Эти эксперименты обычно включают потерю функции, приобретение функции, отслеживание и экспрессию.
Организмы могут трансформировать свои клетки с помощью гена, кодирующего полезный белок, такой как фермент, так что они будут сверхэкспрессировать желаемый белок. Массовые количества белка затем могут быть произведены путем выращивания трансформированного организма в биореакторном оборудовании с использованием промышленной ферментации , а затем очистки белка. [116] Некоторые гены не работают хорошо в бактериях, поэтому дрожжи, клетки насекомых или клетки млекопитающих также могут быть использованы. [117] Эти методы используются для производства лекарств, таких как инсулин , гормон роста человека и вакцины , добавки, такие как триптофан , помощь в производстве продуктов питания ( химозин в сыроделии) и топлива. [118] Другие приложения с генетически модифицированными бактериями могут включать в себя выполнение ими задач за пределами их естественного цикла, таких как производство биотоплива , [119] очистка нефтяных разливов, углерода и других токсичных отходов [120] и обнаружение мышьяка в питьевой воде. [121] Некоторые генетически модифицированные микробы также могут использоваться в биодобыче и биоремедиации из-за их способности извлекать тяжелые металлы из окружающей среды и включать их в соединения, которые легче восстанавливать. [122]
В материаловедении генетически модифицированный вирус использовался в исследовательской лаборатории в качестве основы для сборки более экологически безопасной литий-ионной батареи . [123] [124] Бактерии также были сконструированы для работы в качестве сенсоров путем экспрессии флуоресцентного белка при определенных условиях окружающей среды. [125]

Одним из самых известных и спорных применений генной инженерии является создание и использование генетически модифицированных культур или генетически модифицированного скота для производства генетически модифицированных продуктов питания . Культуры были разработаны для увеличения производства, повышения устойчивости к абиотическим стрессам , изменения состава пищи или для производства новых продуктов. [127]
Первые культуры, которые будут выпущены в продажу в больших масштабах, обеспечивали защиту от насекомых-вредителей или устойчивость к гербицидам . Также были разработаны или находятся в стадии разработки культуры, устойчивые к грибкам и вирусам. [128] [129] Это упрощает борьбу с насекомыми и сорняками в культурах и может косвенно повысить урожайность. [130] [131] Также разрабатываются ГМ-культуры, которые напрямую повышают урожайность за счет ускорения роста или делают растения более выносливыми (за счет улучшения устойчивости к соли, холоду или засухе). [132] В 2016 году лосось был генетически модифицирован с помощью гормонов роста, чтобы достичь нормального размера взрослой особи гораздо быстрее. [133]
Были разработаны ГМО, которые изменяют качество продукции, увеличивая пищевую ценность или обеспечивая более промышленно полезные качества или количества. [132] Картофель сорта Амфлора производит более промышленно полезную смесь крахмалов. Соевые бобы и канола были генетически модифицированы для производства более полезных масел. [134] [135] Первым коммерческим ГМ-продуктом был томат , который имел замедленное созревание, что увеличивало его срок годности . [136]
Растения и животные были сконструированы для производства материалов, которые они обычно не производят. Фарминг использует сельскохозяйственные культуры и животных в качестве биореакторов для производства вакцин, промежуточных лекарственных препаратов или самих лекарств; полезный продукт очищается от урожая и затем используется в стандартном процессе фармацевтического производства. [137] Коровы и козы были сконструированы для экспрессии лекарств и других белков в их молоке, и в 2009 году FDA одобрило лекарство, произведенное из козьего молока. [138] [139]
Генная инженерия имеет потенциальные применения в охране природы и управлении природными территориями. Перенос генов через вирусные векторы был предложен в качестве средства контроля инвазивных видов, а также вакцинации находящихся под угрозой исчезновения животных от болезней. [140] Трансгенные деревья были предложены в качестве способа придания устойчивости к патогенам в диких популяциях. [141] С ростом рисков неадаптации организмов в результате изменения климата и других пертурбаций, облегченная адаптация посредством генной настройки может стать одним из решений для снижения рисков вымирания. [142] Применение генной инженерии в охране природы до сих пор в основном является теоретическим и еще не реализовано на практике.
Генная инженерия также используется для создания микробного искусства . [143] Некоторые бактерии были генетически модифицированы для создания черно-белых фотографий. [144] Такие новинки, как гвоздики цвета лаванды , [145] синие розы , [146] и светящиеся рыбы , [147] [148] также были созданы с помощью генной инженерии.
Регулирование генной инженерии касается подходов, используемых правительствами для оценки и управления рисками, связанными с разработкой и выпуском ГМО. Разработка нормативной базы началась в 1975 году в Асиломаре , Калифорния. [149] На встрече в Асиломаре был рекомендован набор добровольных руководящих принципов, касающихся использования рекомбинантной технологии. [31] По мере совершенствования технологии США создали комитет в Управлении по науке и технологиям , [150] который поручил регулирующее одобрение ГМ-продуктов Министерству сельского хозяйства США, FDA и Агентству по охране окружающей среды. [151] Картахенский протокол по биобезопасности , международный договор, регулирующий передачу, обработку и использование ГМО, [152] был принят 29 января 2000 года. [153] Сто пятьдесят семь стран являются членами Протокола, и многие используют его в качестве отправной точки для своих собственных правил. [154]
Правовой и нормативный статус ГМО-продуктов различается в зависимости от страны: некоторые страны запрещают или ограничивают их, а другие разрешают их с сильно различающейся степенью регулирования. [155] [156] [157] [158] Некоторые страны разрешают импорт ГМО-продуктов с разрешения, но либо не разрешают их выращивание (Россия, Норвегия, Израиль), либо имеют положения о выращивании, даже если ГМО-продукты еще не производятся (Япония, Южная Корея). Большинство стран, которые не разрешают выращивание ГМО, разрешают исследования. [159] Некоторые из наиболее заметных различий наблюдаются между США и Европой. Политика США фокусируется на продукте (а не на процессе), рассматривает только проверяемые научные риски и использует концепцию существенной эквивалентности . [160] Европейский союз , напротив, имеет, возможно, самые строгие правила в отношении ГМО в мире. [161] Все ГМО, наряду с облученными продуктами , считаются «новыми продуктами» и подлежат обширной индивидуальной научной оценке продуктов питания Европейским агентством по безопасности продуктов питания . Критерии для получения разрешения делятся на четыре основные категории: «безопасность», «свобода выбора», «маркировка» и «прослеживаемость». [162] Уровень регулирования в других странах, которые выращивают ГМО, находится между Европой и Соединенными Штатами.
Одним из ключевых вопросов, касающихся регуляторов, является вопрос о том, следует ли маркировать ГМО-продукты. Европейская комиссия заявляет, что обязательная маркировка и прослеживаемость необходимы для обеспечения осознанного выбора, избежания потенциальной ложной рекламы [173] и облегчения отзыва продуктов в случае обнаружения неблагоприятных последствий для здоровья или окружающей среды. [174] Американская медицинская ассоциация [175] и Американская ассоциация содействия развитию науки [176] утверждают, что при отсутствии научных доказательств вреда даже добровольная маркировка вводит в заблуждение и ложно встревожит потребителей. Маркировка ГМО-продуктов на рынке требуется в 64 странах. [177] Маркировка может быть обязательной до порогового уровня содержания ГМО (который варьируется в зависимости от страны) или добровольной. В Канаде и США маркировка ГМО-продуктов является добровольной, [178] в то время как в Европе все продукты питания (включая обработанные ) или корма , содержащие более 0,9% одобренных ГМО, должны быть маркированы. [161]
Критики возражали против использования генной инженерии по нескольким причинам, включая этические, экологические и экономические проблемы. Многие из этих проблем касаются ГМ-культур и того, являются ли продукты, произведенные из них, безопасными и какое влияние их выращивание окажет на окружающую среду. Эти противоречия привели к судебным разбирательствам, международным торговым спорам и протестам, а также к ограничительному регулированию коммерческой продукции в некоторых странах. [179]
Обвинения в том, что ученые « играют в Бога », и другие религиозные проблемы приписывались этой технологии с самого начала. [180] Другие поднятые этические вопросы включают патентование жизни , [181] использование прав интеллектуальной собственности , [182] уровень маркировки на продуктах, [183] [184] контроль за поставками продовольствия [185] и объективность процесса регулирования. [186] Хотя были высказаны сомнения, [187] экономически большинство исследований показали, что выращивание ГМ-культур выгодно для фермеров. [188] [189] [190]
Поток генов между ГМ-культурами и совместимыми растениями, наряду с возросшим использованием селективных гербицидов , может увеличить риск развития « суперсорняков ». [191] Другие экологические проблемы включают потенциальное воздействие на нецелевые организмы, включая почвенные микробы , [192] и увеличение вторичных и устойчивых насекомых-вредителей. [193] [194] Многие из экологических последствий, связанных с ГМ-культурами, могут потребовать многих лет для понимания и также очевидны в традиционных методах ведения сельского хозяйства. [192] [195] С коммерциализацией генетически модифицированной рыбы возникают опасения относительно того, какие экологические последствия будут, если она сбежит. [196]
Существует три основных опасения по поводу безопасности генетически модифицированных продуктов питания: могут ли они вызвать аллергическую реакцию ; могут ли гены перейти из продуктов питания в клетки человека; и могут ли гены, не одобренные для потребления человеком, передаваться другим культурам. [197] Существует научный консенсус [198] [199] [200] [201] о том, что в настоящее время доступные продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, [202] [203] [204] [205] [206], но что каждый ГМ-продукт должен быть протестирован в каждом конкретном случае перед введением. [207] [208] [209] Тем не менее, представители общественности менее склонны, чем ученые, считать ГМ-продукты безопасными. [210] [211] [212] [213]
Генная инженерия присутствует во многих научно-фантастических рассказах. [214] Роман Фрэнка Герберта «Белая чума» описывает преднамеренное использование генной инженерии для создания патогена , который специально убивает женщин. [214] Другое творение Герберта, серия романов «Дюна» , использует генную инженерию для создания могущественных тлейлаксуанцев . [215] Немногие фильмы информировали зрителей о генной инженерии, за исключением «Мальчиков из Бразилии» 1978 года и « Парка Юрского периода» 1993 года , оба из которых используют урок, демонстрацию и отрывок из научного фильма. [216] [217] Методы генной инженерии слабо представлены в кино; Майкл Кларк, пишущий для Wellcome Trust , называет изображение генной инженерии и биотехнологии «серьёзно искажённым» [217] в таких фильмах, как «Шестой день» . По мнению Кларка, биотехнологии обычно «придаются фантастическим, но визуально притягивающим взгляд формам», в то время как наука либо отодвигается на второй план, либо выдумывается, чтобы понравиться молодой аудитории. [217]
Генная инженерия: Манипулирование генетическим запасом организма путем введения или устранения определенных генов с помощью современных методов молекулярной биологии. Широкое определение генной инженерии также включает селективное разведение и другие средства искусственного отбора
{{cite journal}}: CS1 maint: DOI inactive as of September 2024 (link){{cite web}}: CS1 maint: bot: original URL status unknown (link){{cite journal}}: |author1=имеет общее название ( помощь )Маркировка должна включать объективную информацию о том, что пищевой продукт или корм состоит из ГМО, содержит их или произведен из них. Четкая маркировка, независимо от возможности обнаружения ДНК или белка, возникших в результате генетической модификации в конечном продукте, отвечает требованиям, выраженным в многочисленных опросах подавляющим большинством потребителей, облегчает осознанный выбор и исключает потенциальное введение потребителей в заблуждение относительно методов изготовления или производства.
(3) Требования прослеживаемости для ГМО должны способствовать как изъятию продуктов, в отношении которых установлены непредвиденные неблагоприятные последствия для здоровья человека, здоровья животных или окружающей среды, включая экосистемы, так и направленности мониторинга на изучение потенциальных последствий, в частности, для окружающей среды. Прослеживаемость также должна способствовать внедрению мер по управлению рисками в соответствии с принципом предосторожности. (4) Требования прослеживаемости для пищевых продуктов и кормов, произведенных из ГМО, должны быть установлены для содействия точной маркировке таких продуктов.
Мы рассмотрели научную литературу по безопасности генетически модифицированных культур за последние 10 лет, которая отражает научный консенсус, сформировавшийся с тех пор, как генетически модифицированные растения стали широко культивироваться во всем мире, и можем заключить, что проведенные до сих пор научные исследования не обнаружили никакой значительной опасности, напрямую связанной с использованием генетически модифицированных культур. Литература о биоразнообразии и потреблении генетически модифицированных продуктов питания/кормов иногда приводила к оживленным дебатам относительно пригодности экспериментальных проектов, выбора статистических методов или общедоступности данных. Подобные дебаты, даже если они носят позитивный характер и являются частью естественного процесса рассмотрения научным сообществом, часто искажаются средствами массовой информации и используются в политических целях и ненадлежащим образом в кампаниях против ГМО-культур.
в настоящее время трансгенные культуры и продукты питания, полученные из них, были признаны безопасными для употребления в пищу, а методы, используемые для проверки их безопасности, были признаны надлежащими. Эти выводы представляют собой консенсус научных доказательств, изученных ICSU (2003), и они согласуются с мнением Всемирной организации здравоохранения (ВОЗ, 2002). Эти продукты питания были оценены на предмет повышенных рисков для здоровья человека несколькими национальными регулирующими органами (в частности, Аргентиной, Бразилией, Канадой, Китаем, Соединенным Королевством и Соединенными Штатами) с использованием их национальных процедур безопасности пищевых продуктов (ICSU). На сегодняшний день никаких проверяемых неблагоприятных токсических или вредных для питания эффектов в результате потребления продуктов питания, полученных из генетически модифицированных культур, не было обнаружено нигде в мире (Группа по обзору науки ГМ). Многие миллионы людей употребляли в пищу продукты, полученные из ГМ-растений, в основном кукурузы, сои и рапса, без каких-либо наблюдаемых побочных эффектов (ICSU).
Существует широкий научный консенсус в отношении того, что генетически модифицированные культуры, которые в настоящее время представлены на рынке, безопасны для употребления в пищу. После 14 лет выращивания и совокупной засадки 2 миллиардов акров никаких неблагоприятных последствий для здоровья или окружающей среды в результате коммерциализации генетически модифицированных культур не возникло (Совет по сельскому хозяйству и природным ресурсам, Комитет по воздействию на окружающую среду, связанному с коммерциализацией трансгенных растений, Национальный исследовательский совет и Отдел по исследованиям Земли и жизни 2002 г.). И Национальный исследовательский совет США, и Объединенный исследовательский центр (научно-техническая исследовательская лаборатория Европейского союза и неотъемлемая часть Европейской комиссии) пришли к выводу, что существует всеобъемлющий объем знаний, который адекватно решает проблему безопасности пищевых продуктов, полученных с помощью генной инженерии (Комитет по выявлению и оценке непреднамеренных эффектов генетически модифицированных пищевых продуктов на здоровье человека и Национальный исследовательский совет 2004; Объединенный исследовательский центр Европейской комиссии 2008). Эти и другие недавние отчеты приходят к выводу, что процессы генной инженерии и традиционной селекции не отличаются с точки зрения непреднамеренных последствий для здоровья человека и окружающей среды (Генеральный директорат Европейской комиссии по исследованиям и инновациям 2010).
Несмотря на это, количество исследований, специально посвященных оценке безопасности ГМ-растений, по-прежнему ограничено. Однако важно отметить, что впервые было отмечено определенное равновесие в количестве исследовательских групп, предполагающих на основе своих исследований, что ряд разновидностей ГМ-продуктов (в основном кукуруза и соя) столь же безопасны и питательны, как и соответствующие обычные не-ГМ-растения, и тех, которые по-прежнему вызывают серьезные опасения. Более того, стоит отметить, что большинство исследований, демонстрирующих, что ГМ-продукты столь же питательны и безопасны, как и те, что получены традиционным путем селекции, были проведены биотехнологическими компаниями или их партнерами, которые также отвечают за коммерциализацию этих ГМ-растений. В любом случае, это представляет собой заметный прогресс по сравнению с отсутствием исследований, опубликованных в последние годы в научных журналах этими компаниями.Krimsky S (2015). "Иллюзорный консенсус в оценке здоровья ГМО" (PDF) . Наука, технологии и человеческие ценности . 40 (6): 883–914. doi :10.1177/0162243915598381. S2CID 40855100. Архивировано из оригинала (PDF) 7 февраля 2016 г. . Получено 30 октября 2016 г.
Я начал эту статью с свидетельств уважаемых ученых о том, что буквально нет никаких научных споров о влиянии ГМО на здоровье. Мое исследование научной литературы рассказывает другую историю.И контраст: Панчин А.Ю., Тужиков А.И. (март 2017 г.). «Опубликованные исследования ГМО не находят доказательств вреда при корректировке на множественные сравнения». Critical Reviews in Biotechnology . 37 (2): 213–217. doi :10.3109/07388551.2015.1130684. PMID 26767435. S2CID 11786594.
Здесь мы показываем, что ряд статей, некоторые из которых оказали сильное и негативное влияние на общественное мнение о ГМ-культурах и даже спровоцировали политические действия, такие как эмбарго на ГМО, имеют общие недостатки в статистической оценке данных. Приняв во внимание эти недостатки, мы приходим к выводу, что данные, представленные в этих статьях, не содержат никаких существенных доказательств вреда ГМО. Представленные статьи, предполагающие возможный вред ГМО, получили большое общественное внимание. Однако, несмотря на их заявления, они фактически ослабляют доказательства вреда и отсутствия существенной эквивалентности изучаемых ГМО. Мы подчеркиваем, что с более чем 1783 опубликованными статьями о ГМО за последние 10 лет ожидается, что некоторые из них должны были сообщить о нежелательных различиях между ГМО и обычными культурами, даже если в реальности таких различий не существует.и Yang YT, Chen B (апрель 2016 г.). «Управление ГМО в США: наука, право и общественное здравоохранение». Журнал «Наука о продовольствии и сельском хозяйстве » . 96 (6): 1851–5. Bibcode : 2016JSFA...96.1851Y. doi : 10.1002/jsfa.7523. PMID 26536836.
Поэтому неудивительно, что попытки потребовать маркировки и запретить ГМО стали растущей политической проблемой в США
(со ссылкой на Domingo и Bordonaba, 2011)
. В целом, широкий научный консенсус гласит, что продаваемые в настоящее время ГМО-продукты не представляют большего риска, чем обычные продукты... Основные национальные и международные научные и медицинские ассоциации заявили, что на сегодняшний день в рецензируемой литературе не было зарегистрировано или подтверждено никаких неблагоприятных последствий для здоровья человека, связанных с ГМО-продуктами. Несмотря на различные опасения, сегодня Американская ассоциация содействия развитию науки, Всемирная организация здравоохранения и многие независимые международные научные организации сходятся во мнении, что ГМО так же безопасны, как и другие продукты питания. По сравнению с традиционными методами селекции, генная инженерия гораздо более точна и, в большинстве случаев, менее склонна создавать неожиданные результаты.
Например, ЕС инвестировал более 300 миллионов евро в исследования биобезопасности ГМО. В его недавнем отчете говорится: "Главный вывод, который следует сделать из усилий более 130 исследовательских проектов, охватывающих период более 25 лет исследований и вовлекающих более 500 независимых исследовательских групп, заключается в том, что биотехнологии, и в частности ГМО, сами по себе не более рискованны, чем, например, традиционные технологии селекции растений". Всемирная организация здравоохранения, Американская медицинская ассоциация, Национальная академия наук США, Британское королевское общество и все другие уважаемые организации, изучившие доказательства, пришли к одному и тому же выводу: употребление продуктов, содержащих ингредиенты, полученные из ГМ-культур, не более рискованно, чем употребление тех же продуктов, содержащих ингредиенты из сельскохозяйственных культур, модифицированных с помощью традиционных методов улучшения растений.Pinholster G (25 октября 2012 г.). «Совет директоров AAAS: юридическое требование маркировать продукты питания с ГМО-маркировкой может «вводить в заблуждение и ложно тревожить потребителей»». Американская ассоциация содействия развитию науки . Получено 8 февраля 2016 г.
отчете, выпущенном научным советом Американской медицинской ассоциации (AMA), говорится, что не было обнаружено долгосрочных последствий для здоровья от использования трансгенных культур и генетически модифицированных продуктов питания, и что эти продукты питания в значительной степени эквивалентны своим обычным аналогам.
(из онлайн-резюме, подготовленного
ISAAA
)
" "Земли и продукты питания, произведенные с использованием методов рекомбинантной ДНК, доступны менее 10 лет, и на сегодняшний день не было обнаружено долгосрочных последствий. Эти продукты питания в значительной степени эквивалентны своим обычным аналогам.
"Отчет 2 Совета по науке и общественному здравоохранению (A-12): Маркировка биоинженерных продуктов питания" (PDF) . Американская медицинская ассоциация. 2012. Архивировано из оригинала 7 сентября 2012 г. . Получено 19 марта 2016 г.
Биоинженерные продукты питания потребляются уже около 20 лет, и за это время в рецензируемой литературе не было зарегистрировано и/или не было подтверждено никаких явных последствий для здоровья человека.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)научных организаций в США опубликовали исследования или заявления относительно безопасности ГМО, указывающие на то, что нет никаких доказательств того, что ГМО представляют уникальные риски для безопасности по сравнению с продуктами, выращенными традиционным способом. К ним относятся Национальный исследовательский совет, Американская ассоциация содействия развитию науки и Американская медицинская ассоциация. Группы в США, выступающие против ГМО, включают некоторые экологические организации, организации органического земледелия и потребительские организации. Значительное число ученых-юристов критиковали подход США к регулированию ГМО.
Overall finding on purported adverse effects on human health of foods derived from GE crops: On the basis of detailed examination of comparisons of currently commercialized GE with non-GE foods in compositional analysis, acute and chronic animal toxicity tests, long-term data on health of livestock fed GE foods, and human epidemiological data, the committee found no differences that implicate a higher risk to human health from GE foods than from their non-GE counterparts.
Different GM organisms include different genes inserted in different ways. This means that individual GM foods and their safety should be assessed on a case-by-case basis and that it is not possible to make general statements on the safety of all GM foods. GM foods currently available on the international market have passed safety assessments and are not likely to present risks for human health. In addition, no effects on human health have been shown as a result of the consumption of such foods by the general population in the countries where they have been approved. Continuous application of safety assessments based on the Codex Alimentarius principles and, where appropriate, adequate post market monitoring, should form the basis for ensuring the safety of GM foods.
These principles dictate a case-by-case premarket assessment that includes an evaluation of both direct and unintended effects.
In our view, the potential for GM foods to cause harmful health effects is very small and many of the concerns expressed apply with equal vigour to conventionally derived foods. However, safety concerns cannot, as yet, be dismissed completely on the basis of information currently available. When seeking to optimise the balance between benefits and risks, it is prudent to err on the side of caution and, above all, learn from accumulating knowledge and experience. Any new technology such as genetic modification must be examined for possible benefits and risks to human health and the environment. As with all novel foods, safety assessments in relation to GM foods must be made on a case-by-case basis. Members of the GM jury project were briefed on various aspects of genetic modification by a diverse group of acknowledged experts in the relevant subjects. The GM jury reached the conclusion that the sale of GM foods currently available should be halted and the moratorium on commercial growth of GM crops should be continued. These conclusions were based on the precautionary principle and lack of evidence of any benefit. The Jury expressed concern over the impact of GM crops on farming, the environment, food safety and other potential health effects. The Royal Society review (2002) concluded that the risks to human health associated with the use of specific viral DNA sequences in GM plants are negligible, and while calling for caution in the introduction of potential allergens into food crops, stressed the absence of evidence that commercially available GM foods cause clinical allergic manifestations. The BMA shares the view that there is no robust evidence to prove that GM foods are unsafe but we endorse the call for further research and surveillance to provide convincing evidence of safety and benefit.
The largest differences between the public and the AAAS scientists are found in beliefs about the safety of eating genetically modified (GM) foods. Nearly nine-in-ten (88%) scientists say it is generally safe to eat GM foods compared with 37% of the general public, a difference of 51 percentage points.