
Молекулярное клонирование — это набор экспериментальных методов в молекулярной биологии , которые используются для сборки рекомбинантных молекул ДНК и управления их репликацией в организме-хозяине . [1] Использование слова « клонирование» относится к тому факту, что метод включает репликацию одной молекулы для создания популяции клеток с идентичными молекулами ДНК. При молекулярном клонировании обычно используются последовательности ДНК двух разных организмов: вида, который является источником клонируемой ДНК, и вида, который будет служить живым хозяином для репликации рекомбинантной ДНК. Методы молекулярного клонирования занимают центральное место во многих современных областях современной биологии и медицины. [2]
В обычном эксперименте по молекулярному клонированию ДНК, подлежащая клонированию, получается из интересующего организма, затем обрабатывается ферментами в пробирке для создания более мелких фрагментов ДНК. Впоследствии эти фрагменты объединяют с векторной ДНК для создания молекул рекомбинантной ДНК. Затем рекомбинантную ДНК вводят в организм хозяина (обычно это легко выращиваемый доброкачественный лабораторный штамм бактерий E. coli ). Это создаст популяцию организмов, в которой молекулы рекомбинантной ДНК будут реплицироваться вместе с ДНК хозяина. Поскольку они содержат фрагменты чужеродной ДНК, это трансгенные или генетически модифицированные микроорганизмы ( ГМО ). [3] Этот процесс использует тот факт, что одну бактериальную клетку можно заставить поглощать и реплицировать одну молекулу рекомбинантной ДНК. Эту единственную клетку затем можно экспоненциально размножать, создавая большое количество бактерий, каждая из которых содержит копии исходной рекомбинантной молекулы. Таким образом, как полученную бактериальную популяцию, так и рекомбинантную молекулу ДНК обычно называют «клонами». Строго говоря, рекомбинантная ДНК относится к молекулам ДНК, а молекулярное клонирование — к экспериментальным методам, используемым для их сборки. Возникла идея, что в плазмиду можно вставить различные последовательности ДНК и что эти чужеродные последовательности будут перенесены в бактерии и переварены как часть плазмиды. То есть эти плазмиды могли бы служить векторами клонирования для переноса генов. [4]
Практически любую последовательность ДНК можно клонировать и амплифицировать, но есть некоторые факторы, которые могут ограничить успех этого процесса. Примерами последовательностей ДНК, которые трудно клонировать, являются инвертированные повторы, точки начала репликации, центромеры и теломеры. Существует также меньшая вероятность успеха при вставке последовательностей ДНК большого размера. Вставки размером более 10 т.п.н. имеют очень ограниченный успех, но бактериофаги, такие как бактериофаг λ, можно модифицировать для успешной вставки последовательности размером до 40 т.п.н. [5]
До 1970-х годов понимание генетики и молекулярной биологии было серьезно затруднено из-за невозможности изолировать и изучать отдельные гены сложных организмов. Ситуация резко изменилась с появлением методов молекулярного клонирования. Микробиологи, стремясь понять молекулярные механизмы, посредством которых бактерии ограничивают рост бактериофагов, выделили эндонуклеазы рестрикции — ферменты, которые могли расщеплять молекулы ДНК только при обнаружении определенных последовательностей ДНК. [6] Они показали, что рестриктазы расщепляют молекулы ДНК длиной в хромосому в определенных местах и что определенные участки более крупной молекулы можно очистить путем фракционирования по размеру. Используя второй фермент, ДНК-лигазу , фрагменты, генерируемые ферментами рестрикции, могут быть объединены в новые комбинации, называемые рекомбинантной ДНК . Путем рекомбинации интересующих сегментов ДНК с векторной ДНК, такой как бактериофаг или плазмиды, которые естественным образом реплицируются внутри бактерий, в бактериальных культурах можно получить большие количества очищенных молекул рекомбинантной ДНК. Первые рекомбинантные молекулы ДНК были созданы и изучены в 1972 году. [7] [8]
Молекулярное клонирование использует тот факт, что химическая структура ДНК принципиально одинакова у всех живых организмов. Следовательно, если любой сегмент ДНК любого организма вставить в сегмент ДНК, содержащий молекулярные последовательности, необходимые для репликации ДНК , и полученную рекомбинантную ДНК ввести в организм, из которого были получены последовательности репликации, то чужеродная ДНК будет реплицироваться. наряду с ДНК клетки-хозяина в трансгенном организме.
Молекулярное клонирование похоже на ПЦР в том, что оно позволяет копировать последовательность ДНК. Фундаментальное различие между этими двумя методами заключается в том, что молекулярное клонирование предполагает репликацию ДНК в живом микроорганизме, тогда как ПЦР реплицирует ДНК в растворе in vitro , свободном от живых клеток.
Прежде чем проводить настоящие эксперименты по клонированию в лаборатории, большинство экспериментов по клонированию планируются на компьютере с использованием специального программного обеспечения. Хотя детальное планирование клонирования можно выполнить в любом текстовом редакторе вместе с онлайн-утилитами, например, для разработки праймера для ПЦР, для этой цели существует специальное программное обеспечение. Программное обеспечение для этой цели включает, например, ApE [1] (с открытым исходным кодом), DNAStrider [2] (с открытым исходным кодом), Serial Cloner [3] (бесплатно), Collagene [4] (с открытым исходным кодом) и SnapGene (коммерческий). Эти программы позволяют моделировать реакции ПЦР , рестрикционные дайджесты , лигирования и т. д., то есть все этапы, описанные ниже.
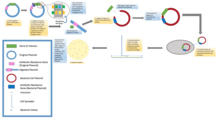
В стандартных экспериментах по молекулярному клонированию клонирование любого фрагмента ДНК по существу включает семь этапов: (1) Выбор организма-хозяина и вектора клонирования, (2) Подготовка векторной ДНК, (3) Подготовка ДНК для клонирования, (4) Создание рекомбинантной ДНК, (5) Введение рекомбинантной ДНК в организм хозяина, (6) Отбор организмов, содержащих рекомбинантную ДНК, (7) Скрининг клонов с желаемыми вставками ДНК и биологическими свойствами.
Примечательно, что растущая мощность и точность платформ синтеза ДНК позволяют создавать все более сложные конструкции в области молекулярной инженерии. Эти проекты могут включать в себя очень длинные цепи новой последовательности ДНК и/или одновременно тестировать целые библиотеки, а не отдельные последовательности. Эти сдвиги приводят к усложнению, требующему перехода от представления на основе плоских нуклеотидов к более высокому уровню абстракции. Примерами таких инструментов являются GenoCAD , Teselagen [5] (бесплатно для академических кругов) или GeneticConstructor [6] (бесплатно для академических кругов).

Хотя используется очень большое количество организмов-хозяев и векторов молекулярного клонирования, подавляющее большинство экспериментов по молекулярному клонированию начинаются с лабораторного штамма бактерии E. coli ( Escherichia coli ) и плазмидного вектора клонирования . E. coli и плазмидные векторы широко используются, поскольку они технически сложны, универсальны, широко доступны и обеспечивают быстрый рост рекомбинантных организмов с минимальным оборудованием. [3] Если ДНК, подлежащая клонированию, исключительно велика (от сотен тысяч до миллионов пар оснований), то часто выбирают бактериальную искусственную хромосому [10] или вектор дрожжевой искусственной хромосомы .
Специализированные приложения могут потребовать использования специализированных систем хост-векторов. Например, если экспериментаторы желают собрать конкретный белок из рекомбинантного организма, тогда выбирается вектор экспрессии , который содержит соответствующие сигналы для транскрипции и трансляции в желаемом организме-хозяине. Альтернативно, если желательна репликация ДНК у разных видов (например, перенос ДНК от бактерий к растениям), то может быть выбран вектор с множеством хозяев (также называемый челночным вектором ). Однако на практике специализированные эксперименты по молекулярному клонированию обычно начинаются с клонирования в бактериальную плазмиду с последующим субклонированием в специализированный вектор.
Какая бы комбинация хозяина и вектора ни использовалась, вектор почти всегда содержит четыре сегмента ДНК, которые критически важны для его функции и экспериментальной полезности: [3]

Вектор клонирования обрабатывается эндонуклеазой рестрикции для расщепления ДНК в том месте, куда будет вставлена чужеродная ДНК. Фермент рестрикции выбирается так, чтобы создать конфигурацию сайта расщепления, совместимую с концами чужеродной ДНК (см. Конец ДНК ). Обычно это делается путем расщепления векторной ДНК и чужеродной ДНК с помощью одного и того же фермента рестрикции или эндонуклеазы рестрикции, например EcoRI , и этот фермент рестрикции был выделен из E.coli. [11] Большинство современных векторов содержат множество удобных сайтов расщепления, которые уникальны внутри молекулы вектора (так что вектор можно расщепить только в одном сайте) и расположены внутри гена (часто бета-галактозидазы ), инактивация которого может быть осуществлена. используется для различения рекомбинантных и нерекомбинантных организмов на более позднем этапе процесса. Чтобы улучшить соотношение рекомбинантных и нерекомбинантных организмов, расщепленный вектор можно обработать ферментом ( щелочной фосфатазой ), который дефосфорилирует концы вектора. Векторные молекулы с дефосфорилированными концами не способны реплицироваться, и репликация может быть восстановлена только в том случае, если чужеродная ДНК интегрирована в сайт расщепления. [12]

Для клонирования геномной ДНК клонируемую ДНК извлекают из интересующего организма. Можно использовать практически любой источник ткани (даже ткани вымерших животных ) [13] , при условии, что ДНК не подверглась значительной деградации. Затем ДНК очищают с помощью простых методов удаления примесных белков (экстракция фенолом), РНК (рибонуклеаза) и более мелких молекул (осаждение и/или хроматография). Методы полимеразной цепной реакции (ПЦР) часто используются для амплификации определенных последовательностей ДНК или РНК ( ОТ-ПЦР ) перед молекулярным клонированием.
ДНК для экспериментов по клонированию также может быть получена из РНК с использованием обратной транскриптазы ( клонирование комплементарной ДНК или кДНК) или в форме синтетической ДНК ( синтез искусственного гена ). Клонирование кДНК обычно используется для получения клонов, репрезентативных для популяции мРНК интересующих клеток, тогда как синтетическая ДНК используется для получения любой точной последовательности, определенной разработчиком. Такая спроектированная последовательность может потребоваться при перемещении генов по генетическим кодам (например, из митохондрий в ядро) [14] или просто для увеличения экспрессии посредством оптимизации кодонов . [15]
Очищенную ДНК затем обрабатывают ферментом рестрикции для получения фрагментов, концы которых могут быть связаны с концами вектора. При необходимости можно добавить короткие двухцепочечные сегменты ДНК ( линкеры ), содержащие нужные сайты рестрикции, для создания концевых структур, совместимых с вектором. [3] [12]
Создание рекомбинантной ДНК во многих отношениях является простейшим этапом процесса молекулярного клонирования. ДНК, полученная из вектора и чужеродного источника, просто смешивается в соответствующих концентрациях и подвергается воздействию фермента ( ДНК-лигазы ), который ковалентно связывает концы вместе. Эту реакцию соединения часто называют лигированием . Полученная смесь ДНК, содержащая случайно соединенные концы, готова для введения в организм хозяина.
ДНК-лигаза распознает и действует только на концах линейных молекул ДНК, что обычно приводит к образованию сложной смеси молекул ДНК со случайно соединенными концами. Желаемые продукты (векторная ДНК, ковалентно связанная с чужеродной ДНК) будут присутствовать, но обычно также присутствуют и другие последовательности (например, чужеродная ДНК, связанная сама с собой, векторная ДНК, связанная сама с собой, и комбинации вектора и чужеродной ДНК более высокого порядка). Эта сложная смесь сортируется на последующих этапах процесса клонирования, после того как смесь ДНК вводится в клетки. [3] [12]
Смесь ДНК, ранее обработанная in vitro, возвращается в живую клетку, называемую организмом-хозяином. Методы, используемые для введения ДНК в клетки, разнообразны, и название этого этапа процесса молекулярного клонирования часто зависит от выбранного экспериментального метода (например, трансформация , трансдукция , трансфекция , электропорация ). [3] [12]
Когда микроорганизмы способны поглощать и реплицировать ДНК из своей локальной среды, этот процесс называется трансформацией , а клетки, находящиеся в физиологическом состоянии, позволяющем поглощать ДНК, считаются компетентными . [16] В культуре клеток млекопитающих аналогичный процесс введения ДНК в клетки обычно называют трансфекцией . Как трансформация, так и трансфекция обычно требуют подготовки клеток с помощью специального режима роста и процесса химической обработки, который будет варьироваться в зависимости от конкретного вида и типа используемых клеток.
При электропорации используются электрические импульсы высокого напряжения для перемещения ДНК через клеточную мембрану (и клеточную стенку, если она имеется). [17] Напротив, трансдукция включает упаковку ДНК в вирусные частицы и использование этих вирусоподобных частиц для введения инкапсулированной ДНК в клетку посредством процесса, напоминающего вирусную инфекцию. Хотя электропорация и трансдукция являются узкоспециализированными методами, они могут быть наиболее эффективными методами перемещения ДНК в клетки.
Какой бы метод ни использовался, введение рекомбинантной ДНК в выбранный организм-хозяин обычно представляет собой процесс с низкой эффективностью; то есть только небольшая часть клеток фактически поглощает ДНК. Ученые-экспериментаторы решают эту проблему посредством искусственного генетического отбора, при котором клетки, не впитавшие ДНК, избирательно уничтожаются, и выжить способны только те клетки, которые могут активно реплицировать ДНК, содержащую селектируемый маркерный ген, кодируемый вектором. [3] [12]
Когда бактериальные клетки используются в качестве организмов-хозяев, селективным маркером обычно является ген, который придает устойчивость к антибиотику , который в противном случае убивал бы клетки, обычно к ампициллину . Клетки, содержащие плазмиду, выживут при воздействии антибиотика, а те, которые не смогли принять последовательности плазмиды, погибнут. При использовании клеток млекопитающих (например, клеток человека или мыши) применяется аналогичная стратегия, за исключением того, что маркерный ген (в данном случае обычно кодируемый как часть кассеты kanMX ) придает устойчивость к антибиотику генетицину .
Современные бактериальные векторы для клонирования (например, pUC19 и более поздние производные, включая векторы pGEM) используют сине-белую систему скрининга, чтобы отличить колонии (клоны) трансгенных клеток от тех, которые содержат родительский вектор (т.е. векторную ДНК без вставленной рекомбинантной последовательности). В этих векторах чужеродная ДНК вставлена в последовательность, которая кодирует существенную часть бета-галактозидазы , фермента, активность которого приводит к образованию колонии синего цвета на культуральной среде, используемой для этой работы. Вставка чужеродной ДНК в последовательность, кодирующую бета-галактозидазу, отключает функцию фермента, так что колонии, содержащие трансформированную ДНК, остаются бесцветными (белыми). Поэтому экспериментаторам легко идентифицировать и проводить дальнейшие исследования трансгенных клонов бактерий, игнорируя при этом те, которые не содержат рекомбинантной ДНК.
Общую популяцию отдельных клонов, полученных в эксперименте по молекулярному клонированию, часто называют библиотекой ДНК . Библиотеки могут быть очень сложными (как при клонировании полной геномной ДНК из организма) или относительно простыми (как при перемещении ранее клонированного фрагмента ДНК в другую плазмиду), но почти всегда необходимо изучить несколько различных клонов, чтобы быть уверенным. что желаемая конструкция ДНК получена. Этого можно достичь с помощью очень широкого спектра экспериментальных методов, включая использование гибридизации нуклеиновых кислот , зондов антител , полимеразной цепной реакции , анализа рестрикционных фрагментов и/или секвенирования ДНК . [3] [12]
Молекулярное клонирование предоставляет ученым практически неограниченное количество любых отдельных сегментов ДНК, полученных из любого генома. Этот материал может быть использован для широкого круга целей, в том числе как в фундаментальной, так и в прикладной биологической науке. Здесь кратко изложены некоторые из наиболее важных приложений.
Молекулярное клонирование привело непосредственно к выяснению полной последовательности ДНК геномов очень большого числа видов и к исследованию генетического разнообразия внутри отдельных видов. клонированные фрагменты генома и сборка перекрывающихся последовательностей.
На уровне отдельных генов молекулярные клоны используются для создания зондов , которые используются для изучения того, как экспрессируются гены и как эта экспрессия связана с другими процессами в биологии, включая метаболическую среду, внеклеточные сигналы, развитие, обучение, старение и гибель клеток. Клонированные гены также могут предоставить инструменты для изучения биологической функции и важности отдельных генов, позволяя исследователям инактивировать гены или производить более тонкие мутации с помощью регионального мутагенеза или сайт-направленного мутагенеза . Гены, клонированные в векторы экспрессии для функционального клонирования, предоставляют средства скрининга генов на основе функции экспрессируемого белка.
Получение молекулярного клона гена может привести к развитию организмов, продуцирующих белковый продукт клонированных генов, называемый рекомбинантным белком. На практике зачастую сложнее создать организм, который продуцирует активную форму рекомбинантного белка в желаемых количествах, чем клонировать ген. Это связано с тем, что молекулярные сигналы экспрессии генов сложны и изменчивы, а также потому, что сворачивание, стабильность и транспорт белка могут быть очень сложными.
Многие полезные белки в настоящее время доступны в виде рекомбинантных продуктов . К ним относятся: (1) полезные с медицинской точки зрения белки, введение которых может исправить дефектный или плохо экспрессирующийся ген (например, рекомбинантный фактор VIII , фактор свертывания крови, дефицитный при некоторых формах гемофилии , [18] и рекомбинантный инсулин , используемый для лечения некоторых форм гемофилии. диабета [19] ), (2) белки, которые можно вводить для оказания помощи в опасной для жизни ситуации (например, тканевой активатор плазминогена , используемый для лечения инсультов [20] ), ( 3) рекомбинантные субъединичные вакцины, в которых очищенный белок могут использоваться для иммунизации пациентов против инфекционных заболеваний, не подвергая их воздействию самого инфекционного агента (например, вакцина против гепатита В [21] ), и (4) рекомбинантные белки в качестве стандартного материала для диагностических лабораторных тестов.
После того как они охарактеризованы и обработаны для получения сигналов для соответствующей экспрессии, клонированные гены могут быть вставлены в организмы, создавая трансгенные организмы, также называемые генетически модифицированными организмами (ГМО). Хотя большинство ГМО создаются для целей фундаментальных биологических исследований (см., например, трансгенные мыши ), ряд ГМО был разработан для коммерческого использования, начиная от животных и растений, производящих фармацевтические препараты или другие соединения ( фарминг ), и заканчивая устойчивыми к гербицидам культурами. растения и флуоресцентные тропические рыбы ( GloFish ) для домашних развлечений. [1]
Генная терапия предполагает доставку функционального гена в клетки, лишенные этой функции, с целью коррекции генетического нарушения или приобретенного заболевания. Генную терапию можно разделить на две категории. Первый — это изменение половых клеток, то есть сперматозоидов или яйцеклеток, что приводит к необратимым генетическим изменениям для всего организма и последующих поколений. Многие считают, что эта «генная терапия зародышевой линии» неэтична для людей. [22] Второй тип генной терапии, «генная терапия соматических клеток», аналогичен трансплантации органов. В этом случае на одну или несколько специфических тканей воздействуют путем прямого лечения или путем удаления ткани, добавления терапевтического гена или генов в лаборатории и возврата обработанных клеток пациенту. Клинические испытания генной терапии соматических клеток начались в конце 1990-х годов, в основном для лечения рака и заболеваний крови, печени и легких. [23]
Несмотря на широкую огласку и обещания, история генной терапии человека характеризовалась относительно ограниченным успехом. [23] Эффект от введения гена в клетки часто способствует лишь частичному и/или временному облегчению симптомов заболевания, подлежащего лечению. Некоторые пациенты, проходившие испытания генной терапии, пострадали от неблагоприятных последствий самого лечения, включая смерть. В некоторых случаях побочные эффекты возникают в результате нарушения основных генов в геноме пациента путем инсерционной инактивации. В других случаях вирусные векторы, используемые для генной терапии, были заражены инфекционным вирусом. Тем не менее, генная терапия по-прежнему считается перспективной областью медицины будущего и областью, в которой наблюдается значительный уровень исследований и разработок.