В химии гипохлорит , или хлороксид, представляет собой анион с химической формулой ClO- . Он соединяется с рядом катионов , образуя соли гипохлорита. Общие примеры включают гипохлорит натрия (бытовой отбеливатель ) и гипохлорит кальция (компонент отбеливающего порошка, «хлора» для бассейнов). [1] Расстояние Cl-O в ClO − составляет 1,69 Å. [2]
Название также может относиться к эфирам хлорноватистой кислоты, а именно к органическим соединениям с группой ClO–, ковалентно связанной с остальной частью молекулы. Основным примером является трет-бутилгипохлорит , который является полезным хлорирующим агентом. [3]
С большинством солей гипохлорита обращаются в виде водных растворов . Их основное применение — отбеливание, дезинфекция и очистка воды . Они также используются в химии для реакций хлорирования и окисления .
Подкисление гипохлоритов приводит к образованию хлорноватистой кислоты , которая существует в равновесии с хлором. Пониженный pH (т.е. в сторону кислоты) приводит к смещению следующей реакции вправо, в результате чего выделяется газообразный хлор, который может быть опасен:
Гипохлориты, как правило, нестабильны, и многие соединения существуют только в растворе. Гипохлорит лития LiOCl, гипохлорит кальция Ca(OCl) 2 и гипохлорит бария Ba(ClO) 2 выделены в виде чистых безводных соединений. Все являются твердыми телами. Еще несколько можно получить в виде водных растворов . В общем, чем больше разбавление, тем выше их стабильность. Невозможно определить тенденции для солей щелочноземельных металлов , так как многие из них не могут образовываться. О гипохлорите бериллия ничего не слышно. Чистый гипохлорит магния получить невозможно; однако известен твердый Mg(OH)OCl. [4] Гипохлорит кальция производится в промышленных масштабах и обладает хорошей стабильностью. Гипохлорит стронция Sr(OCl) 2 недостаточно хорошо охарактеризован, и его стабильность еще не определена. [ нужна цитата ]
При нагревании гипохлорит разлагается на смесь хлорида , кислорода и хлоратов :
Эта реакция является экзотермической и в случае концентрированных гипохлоритов, таких как LiOCl и Ca(OCl) 2 , может привести к опасному тепловому выходу из-под контроля и потенциальному взрыву. [5]
Гипохлориты щелочных металлов теряют устойчивость по группе . Безводный гипохлорит лития стабилен при комнатной температуре; однако гипохлорит натрия взрывоопасен в виде безводного твердого вещества. [6] Пентагидрат (NaOCl·(H 2 O) 5 ) нестабилен при температуре выше 0 °C; [7] , хотя более разбавленные растворы, используемые в качестве бытового отбеливателя, более стабильны. Гипохлорит калия (KOCl) известен только в растворе. [4]
Гипохлориты лантаноидов также нестабильны; однако сообщалось, что они более стабильны в безводных формах, чем в присутствии воды. [8] Гипохлорит использовался для окисления церия от степени окисления от +3 до +4 . [9]
Сама по себе хлорноватистая кислота не стабильна, поскольку она разлагается с образованием хлора . Его разложение также приводит к образованию некоторой формы кислорода.
Гипохлориты реагируют с аммиаком, сначала образуя монохлорамин ( NH
2Cl ), затем дихлорамин ( NHCl
2) и, наконец, трихлорид азота ( NCl
3). [1]
Гипохлоритные соли, образующиеся в результате реакции хлора с гидроксидами щелочных и щелочноземельных металлов . Реакцию проводят при температуре, близкой к комнатной, чтобы подавить образование хлоратов . Этот процесс широко используется для промышленного производства гипохлорита натрия (NaClO) и гипохлорита кальция (Ca(ClO) 2 ).
Большие количества гипохлорита натрия также производятся электрохимически посредством несепарированного хлорщелочного процесса . В этом процессе рассол подвергается электролизу с образованием Cl .
2который диссоциирует в воде с образованием гипохлорита. Эту реакцию необходимо проводить в некислых условиях, чтобы предотвратить выделение хлора:
Некоторые гипохлориты могут быть также получены реакцией солевого обмена между гипохлоритом кальция и сульфатами различных металлов . Эта реакция осуществляется в воде и основана на образовании нерастворимого сульфата кальция , который выпадает в осадок из раствора, приводя реакцию к завершению.
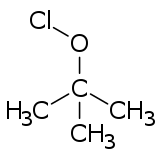
Эфиры гипохлорита обычно образуются из соответствующих спиртов путем обработки любым из ряда реагентов (например , хлором , хлорноватистой кислотой , монооксидом дихлора и различными подкисленными солями гипохлорита). [3]
Хлоропероксидазы – ферменты , катализирующие хлорирование органических соединений. Этот фермент объединяет неорганические субстраты хлорид и перекись водорода с образованием эквивалента Cl + , который заменяет протон в углеводородном субстрате:
Источником «Cl + » является хлорноватистая кислота (HOCl). [11] Многие хлорорганические соединения биосинтезируются таким способом.
В ответ на инфекцию иммунная система человека вырабатывает незначительное количество гипохлорита в специальных лейкоцитах , называемых нейтрофильными гранулоцитами . [12] Эти гранулоциты поглощают вирусы и бактерии во внутриклеточной вакуоли, называемой фагосомой , где они перевариваются.
Часть механизма пищеварения включает в себя дыхательный взрыв , опосредованный ферментами , который производит реактивные кислородсодержащие соединения, включая супероксид (который вырабатывается НАДФН-оксидазой ). Супероксид распадается на кислород и перекись водорода , которая используется в реакции, катализируемой миелопероксидазой , для превращения хлорида в гипохлорит. [13] [14] [15]
Также было обнаружено, что низкие концентрации гипохлорита взаимодействуют с белками теплового шока микробов , стимулируя их роль внутриклеточного шаперона и заставляя бактерии образовывать комки (так же, как вареное яйцо), которые в конечном итоге погибают. [16] В том же исследовании было обнаружено, что низкие (микромолярные) уровни гипохлорита побуждают E. coli и холерный вибрион активировать защитный механизм, хотя последствия этого неясны. [16]
В некоторых случаях базовая кислотность гипохлорита нарушает липидную мембрану бактерии — реакция, похожая на лопание воздушного шарика. [ нужна цитата ]
Гипохлориты, особенно натрия («жидкая хлорка», «Жавельская вода») и кальция («хлорка») широко используются в промышленности и быту для отбеливания одежды, осветления цвета волос и удаления пятен . Это были первые коммерческие отбеливающие средства, разработанные вскоре после того, как это свойство было обнаружено в 1785 году французским химиком Клодом Бертолле .
Гипохлориты также широко используются в качестве дезинфицирующих и дезодорирующих средств широкого спектра действия . Это применение началось вскоре после того, как французский химик Лабаррак обнаружил эти свойства, примерно в 1820 году (еще до того, как Пастер сформулировал свою микробную теорию болезней).
Гипохлорит является сильнейшим окислителем оксианионов хлора. В этом можно убедиться, сравнив стандартные потенциалы полуэлементов в серии; данные также показывают, что оксианионы хлора являются более сильными окислителями в кислых условиях. [17]
Гипохлорит является достаточно сильным окислителем для превращения Mn(III) в Mn(V) во время реакции эпоксидирования Якобсена и для превращения Ce3+
в Се4+
. [9]
Именно эта окислительная способность делает их эффективными отбеливающими и дезинфицирующими средствами.
В органической химии гипохлориты могут быть использованы для окисления первичных спиртов до карбоновых кислот . [18]
Соли гипохлорита также могут служить хлорирующими агентами . Например, они преобразуют фенолы в хлорфенолы. Гипохлорит кальция превращает пиперидин в N -хлорпиперидин .
Хлор может быть ядром оксианионов со степенью окисления -1, +1, +3, +5 или +7. (Элемент также может принимать степень окисления +4, что наблюдается в нейтральном соединении диоксида хлора ClO 2 ).
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )