ДНК с i-мотивом (сокращение от ДНК с интеркалированным мотивом) представляет собой богатые цитозином четырехцепочечные квадруплексные структуры ДНК, похожие на G-квадруплексные структуры , которые образуются в богатых гуанином областях ДНК.
Эта структура была впервые обнаружена в 1993 году Морисом Героном в Политехнической школе в Палезо, Франция. Она была обнаружена, когда два антипараллельных двухцепочечных комплекса ДНК с парами оснований цитозин-протонированный цитозин (C·C*) стали ассоциироваться друг с другом. Это образовало сложный 4-цепочечный комплекс ДНК. [1] Первоначально эта структура была обнаружена только in vitro , обычно при слегка кислом pH, но недавно была обнаружена в ядрах человеческих клеток. [2] Был создан новый фрагмент антитела, и было обнаружено, что он имеет высокоспецифическое сродство связывания с комплексами I-мотивов, но не связывается с другими структурами ДНК, что делает его оптимальным для идентификации структур i-мотивов в клетках. [3]
В своем пресс-релизе в апреле 2018 года доктор Махди Зераати и коллеги упомянули, что эти комплексы постоянно формируются и распадаются из-за их постоянно меняющихся температур, что может играть роль в их функции в регуляции экспрессии генов и воспроизводстве клеток . Хотя точная функция этих структур неизвестна, временная природа этих молекул дает представление о биологической функции этих молекул. Обнаруженные в основном в фазе G1 клеточного цикла и в промоторных областях, комплексы i-мотивов могут потенциально влиять на то, какие последовательности генов считываются, и могут играть роль в определении того, какие гены включаются или выключаются. [4] Другие эксперименты продолжаются для определения роли ДНК i-мотива в нанотехнологиях с использованием i-мотивов в качестве биосенсоров и наномашин, [5] и даже было замечено, что они играют роль в продвижении терапии рака.
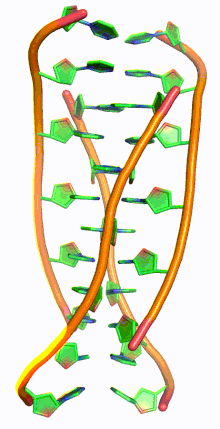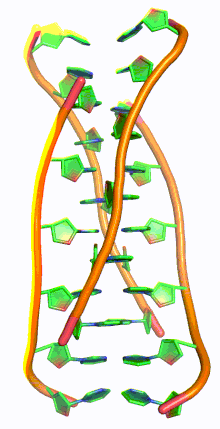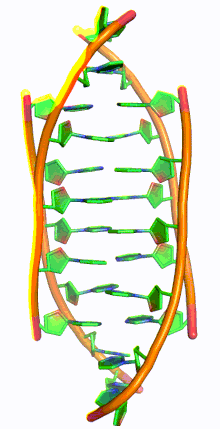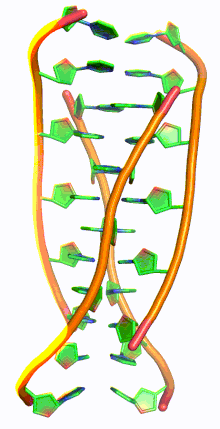
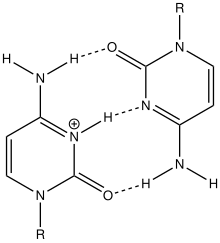
Подобно G-квадруплексным структурам ДНК с интеркалированными остатками гуанина, i-мотивы состоят из антипараллельных участков нитей олигодезоксинуклеотидов, которые содержат в основном остатки цитозина. Взаимодействия между этими молекулами происходят посредством гемипротонирования остатков цитозина и не- Уотсон-Криковского спаривания оснований , более конкретно спаривания оснований Хугстина . Существуют две основные интеркалированные топологии, по которым можно классифицировать i-мотивы: 3'-E, когда самая внешняя пара оснований C:C+ находится на 3'-конце, и 5'-E, где самая внешняя пара оснований C:C+ находится на 5'-конце. При сравнении двух топологий топология 3'-E более стабильна из-за увеличенных контактов сахар-сахар. [9] Это происходит из-за разницы во вкладе энергии Ван-дер-Ваальса между двумя топологиями. Взаимодействие контактов сахар-сахар вдоль узких канавок обеспечивает оптимальное скручивание остова, что в конечном итоге способствует образованию стековых оснований и стабильности молекулы. [10] Однако общая стабильность структур i-мотивов зависит от количества остатков цитозина, которые взаимодействуют друг с другом. Это означает, что чем больше остатков цитозина взаимодействуют посредством водородных связей, тем более стабильной будет молекула. [11] Другие факторы, влияющие на стабильность молекул, включают температуру, концентрацию соли и pH окружающей среды. [12]
В то время как многие комплексы i-мотивов наиболее стабильны при слегка кислом pH (между 4,2 и 5,2), [11] было обнаружено, что некоторые i-мотивы образуются при нейтральном pH, когда свободный протон используется нуклеиновыми кислотами в процессе сворачивания. Эти конкретные комплексы i-мотивов обнаруживаются при определенных условиях, включая низкую температуру (4 °C), молекулярную тесноту, отрицательную суперспиральность и введение катионов серебра (I). Поддержание отрицательной суперспиральности имеет решающее значение для стабилизации i-мотивов при нейтральном pH. [13]
Было также обнаружено, что структуры i-мотивов формируются в биологических условиях. Эти структуры были обнаружены во многих различных местах клетки, включая ядра, [2] цитоплазму, а также в теломерах и промоторных участках. [14] Его также можно обнаружить в клеточных процессах, таких как фаза G1 клеточного цикла.
Как структура нуклеиновой кислоты, стабильность ДНК с i-мотивом зависит от природы последовательности, температуры и ионной силы. Структурная стабильность ДНК с i-мотивом в основном зависит от того факта, что существует минимальное перекрытие между шестичленными ароматическими пиримидиновыми основаниями из-за интеркаляционной геометрии последовательных пар оснований. Экзоциклические карбонилы и аминогруппы, уложенные в антипараллельное образование, необходимы для стабильности пар оснований C:C+ из-за отсутствия компенсации электростатического отталкивания между их заряженными аминогруппами. [15] Другие факторы, включая взаимодействия сахарного и фосфатного остова, длину C-тракта, взаимодействие кэппинга и соединительных петель, ионные взаимодействия, молекулярная скученность и суперспиральность, влияют на стабильность ДНК с i-мотивом. [16]
Пары оснований C:C+ вносят наибольший вклад в стабильность i-мотива из-за трех водородных связей. Эта стабильность демонстрируется энергией спаривания оснований (BPE) i-мотива, составляющей 169,7 кДж/моль, что относительно высоко по сравнению с нейтральным C·C и каноническим G·C Уотсона-Крика, которые имеют BPE 68,0 кДж/моль и 96,6 кДж/моль соответственно. [17] Самая стабильная центральная водородная связь в паре оснований C:C+ (N3··H··N3) была обозначена как имеющая двухъямный потенциал из-за способности протона колебаться между двумя ячейками азотистого основания [18] со скоростью переноса протона, которая, как было установлено, составляет 8 × 10 4 с -1 . [19]
Результаты двух исследований группы Уоллера и Мира и др. подчеркнули важность электростатических взаимодействий, способствующих стабильности пары оснований C:C+. [20] Группа Уоллера хотела определить влияние 2-дезоксирибогуанилмочевины (GuaUre-dR), химиотерапевтического агента, на формирование ДНК i-мотивов в человеческих теломерах. Группа Уоллера обнаружила, что добавление GuaUre-dR привело к снижению pH по сравнению с i-мотивами без него. [21] Мир и др. показали, что добавление псевдоизо-дезоксицитидина (psC) увеличило стабильность димерных структур i-мотивов «голова к голове» и «голова к хвосту», когда нейтрально заряженный psC:C был обнаружен в конце стопки C:C. [22] Оба исследования в конечном итоге обнаружили, что наличие положительных зарядов в ядре этих структур в наибольшей степени способствовало стабильности пары оснований C:C+. [20]
Изменения условий окружающей среды C:C+ были изучены Уоткинсом и др. для наблюдения изменений общей стабильности. [23] Химические модификации пары оснований C:C+, в которых галогенированные аналоги (5-фтор, 5-бром и 5-йод) заняли место цитозина, увеличили стабильность ДНК i-мотива в кислых средах. [24] Это исследование инициировало изучение метилирования цитозина и его влияния на pH. Метилирование цитозина в положении 5 увеличило pH середины перехода и T m i-мотивов. С другой стороны, гидроксиметилирование приводит к снижению pH середины перехода и T m . [25]
Малая бороздка ДНК i-мотива состоит из фосфатного остова, в котором две отрицательно заряженные стороны отталкиваются друг от друга, требуя баланса для стабилизации общей структуры. [20] Водородные связи и взаимодействия Ван-дер-Ваальса между сахарами малой бороздки из последовательности d(CCCC) тетрамерной ДНК i-мотива стабилизируют узкие бороздки структуры i-мотива. Стабильность топологий 3'E и 5'E из последовательности d(CCCC) наблюдалась с помощью молекулярно-динамического моделирования для определения эффекта отталкивания между фосфатными остовами. [15] Стабильность, наблюдаемая в моделировании, вытекает из поддерживающих сахарных взаимодействий, настолько, что стабильность любого i-мотива зависит от баланса между сахарными взаимодействиями и активностью соединительной петли. Это связано с низкой свободной энергией водородной связи (CHO) в структуре i-мотива, составляющей 2,6 кДж/моль. [19]
Модификации фосфатного остова были замечены в исследованиях, в которых изучалась альтернатива фосфатному остову. Олигодезоксицитидинфосфоротиоаты могут образовывать внутримолекулярные и межмолекулярные i-мотивы. [26] Мергни и Лакруа определили, что добавление объемной метильной группы оказывает дестабилизирующее воздействие на формирование i-мотива, когда они сравнили фосфоротиоат, естественные фосфодиэфирные, метилфосфонатные и пептидные связи и определили, что только фосфодиэфирные и фосфоротиоатные олигодезоксинуклеотиды способны образовывать стабильные i-мотивы. [27]
Исследования образования i-мотивов при физиологическом pH , а не кислом pH , включают моделирование молекулярного краудинга, суперспирализации и катионных условий. Благодаря использованию полиэтиленгликолей с высокой молекулярной массой были вызваны условия перегруженной молекулярной и ядерной среды. [28] Увеличение pKa цитозина N3 [23] показало, что эти условия благоприятствуют квадруплексу и i-мотиву по сравнению с двойной [29] и одноцепочечной ДНК, когда образование i-мотивов и протонирование были вызваны Bacolla при нейтральном pH. [30] Отрицательная суперспиральность способствует образованию i-мотивов в физиологических условиях. [31] Образование как G-квадруплекса, так и i-мотивов происходило при нейтральном pH, когда последовательности, формирующие G-квадруплекс и i-мотив промотора онкогена c-MYC, были помещены в суперспиральную плазмиду, что вызвало суперспиральность обеих структур. Условия смягчения суперспиральности были вдохновлены тем фактом, что i-мотив дестабилизирует двухцепочечные структуры. [28] [31] Этот результат отражает процесс транскрипции, в котором суперспиральная ДНК раскручивается в одноцепочечные структуры, что вызывает отрицательную суперспиральность. [32] На стабильность ДНК с i-мотивом можно влиять путем увеличения ионной концентрации. [33] Было показано, что добавление Na увеличивает дестабилизацию структуры i-мотива из протоонкогена c-jun при pH 4,8. Снижение стабильности i-мотива соответствовало увеличению ионной концентрации в исследовании ДНК i-мотива из n-MYC. [34] Однако не было выявлено существенных различий в стабильности при добавлении 5 мМ катионов Mg+, Ca+, Zn+, Li+ или K+ в присутствии 100 мМ NaCl при pH 6,4. [27]
Необходимы дальнейшие исследования для определения абсолютного эффекта на стабильность i-мотивов при модификации оснований, но исследования показали, что существует потенциал для модификации оснований, соответствующей стабильности i-мотивов. [35] Два примера включают замену цитозина на 5-метилцитозин [35] и замену тимина на 5-пропинилурацил, [23] оба увеличивают стабильность структуры i-мотивов. Модификация оснований может быть полезна для определения зависимых от pH/температуры схем сворачивания i-мотивов. [28]
Интеркалированный мотив (i-мотив) ДНК формируется в ядрах клеток посредством стопки интеркалирующих полупротонированных C-нейтральных пар оснований C, которые оптимизированы при слегка отрицательном pH. In vitro i-мотивы были охарактеризованы с указанием на то, что ДНК получена из теломер . Используя различные биофизические методы, i-мотив ДНК был охарактеризован как полученный из центромер и промоторных областей протоонкогенов. Анализ биофизических результатов показывает, что общая стабильность структур зависит от количества цитозинов в ядре i-мотива, а также длины и состава петель при формировании как внутримолекулярных, так и межмолекулярных структур. [36]
Хотя в значительной степени установлено, что последовательности с высоким содержанием C могут образовывать структуры i-мотивов in vitro , все еще ведутся серьезные дебаты относительно существования in vivo четырехцепочечной структуры ДНК с i-мотивом в геноме человека. Было подтверждено, что мотивная ДНК in vivo может образовываться при физиологическом pH в определенных условиях молекулярной скученности и отрицательной суперспиральности, индуцированной во время транскрипции. [36] Недавние исследования показали, что образование ДНК с i-мотивом определенными геномными последовательностями может происходить при нейтральном pH. Многочисленные исследования продемонстрировали, что ДНК с i-мотивом влияет на репликацию и транскрипцию при обработке ДНК после ее образования. [37]
ДНК с I-мотивом формируется из любой комплементарной цепи последовательности, образующей G-квадруплекс . G-квадруплексы имеют спиральную форму и встречаются в нуклеиновых кислотах, богатых гуанином. Эти вторичные структуры обладают тетрадами гуанина, образованными в один из трех типов цепей: одну, две или четыре. Имея предварительные знания о том, что последовательности, образующие G-квадруплекс, восприимчивы к образованию ДНК с i-мотивом, группа Уоллера использовала алгоритм Quadparser для определения количества последовательностей, образующих i-мотив, в геноме человека. [21] Запрос состоял из четырех C-трактов из пяти цитозинов, различающихся числом нуклеотидов, которое может варьироваться от 1 до 19. В геноме человека 5125 последовательностей имеют потенциальные возможности формирования i-мотива, при этом 12,4% (637) от общего числа полученных последовательностей обнаружены в промоторных областях генов. На основе кодов онтологии, соответствующих промоторным областям, формирование i-мотивов сконцентрировано на последовательно-специфическом связывании ДНК, транскрипции по шаблону ДНК, развитии скелетной системы и положительной регуляции транскрипции РНК-полимеразой II. [38]
Первое исследование по определению связывания лиганда с ДНК i-мотива было проведено Херли и коллегами в 2000 году. Они исследовали взаимодействие между тетра-(N-метил-4-пиридил)порфирином (TMPyP4) и тетрамолекулярной ДНК i-мотива, выделенной из человеческой теломерной последовательности. В исследовании использовался анализ сдвига электрофоретической подвижности (EMSA), в частности, не изменяя температуру плавления ДНК. Этот лиганд взаимодействует с G4 в последовательности i-мотива, чтобы дерегулировать экспрессию c-myc и ингибировать теломеразу. [39] [40] Две молекулы TMPyP4 координируются с ДНК i-мотива как сверху, так и снизу ее структуры, как было определено экспериментами ЯМР . [41]
Эти ядра характеризуют производные фенантролина из-за их связывающей G4 и ингибирующей теломеразу активности. [42] Эта активность приводит к общему увеличению T m i-мотива. Производные фенантролина связываются с парой оснований C:C, что приводит к снижению константы связывания ниже, чем у обычного G-квадруплекса. [43] Производные акридина также являются лигандами G4 , и с помощью анализов плавления с резонансным переносом энергии флуоресценции (FRET) было определено , что диэтилентриамин (BisA) увеличивает температуру плавления как i-мотива, так и G4, в то время как мономерный акридин (MonoA) не оказывал такого эффекта. [44]
Вдохновленные теломестатином , природным мощным ингибитором теломеразы, были синтезированы макроциклические полиоксазолы. Макроциклические полиоксазольные соединения обладают тем же режимом связывания, что и теломестатин при взаимодействии с G4 в образовании пи-пи-стопки. [43] Более мелкие макроциклы, пента- (L2H2-5OTD) и тетраоксазолы (L2H2-4OTD) были разработаны с аминогруппами R для наблюдения за стабильностью и расположением участков связывания на i-мотиве. Уменьшение размера лигандов уменьшило его стабилизирующий эффект на последовательности, образующие G4. Молекулы L2H2-4OTD кооперативно связываются с петлями 1 и 2 на теломерах последовательности ДНК i-мотива, что вызывает деформации на парах оснований C3-C15, C2-C14 и C8-C20, сохраняя при этом структуру i-мотива. [45]
Митоксантрон стабилизирует i-мотив и G4 и способствует их формированию в нейтральных условиях с предпочтением связывания с i-мотивом по сравнению с двухцепочечной ДНК. Тилорон и тобрамицин являются лигандами связывания i-мотивов, обнаруженными с помощью анализа смещения интенсивности флуоресценции тиазолового оранжевого (FID). [46]
SWCNT стабилизируют i-мотив ДНК, притягивая молекулы воды из структуры. GQD интеркалируют с ДНК, способствуя формированию i-мотив ДНК путем концевой укладки областей петли. Этот процесс позволяет GQD стабилизировать i-мотивы, минимизируя доступ растворителя. [47]
Существует несколько лигандов для i-мотива, которые используются для биологических функций. К ним относятся IMC-48, IMC-76, нитидин , NSC309874, производное акридона и PBP1. IMC-48 стабилизирует структуру bcl-2 i-мотива, повышая экспрессию гена bcl-2. IMC-76 стабилизирует структуру шпильки bcl-2, понижая экспрессию гена bcl-2. Нитидин дестабилизирует шпильку на гибридной структуре i-мотив/шпилька и не имеет значительных взаимодействий с комплементарным G4. Нитидин понижает экспрессию гена k-ras, проявляя селективность по отношению к структуре k-ras. [43] NSC309874 стабилизирует структуру i-мотива PDGFR-b без значительного взаимодействия с комплементарным G4 для понижения экспрессии гена PDGFR-b. Производное акридона стабилизирует структуру i-мотива c-myc без значительного взаимодействия с G4, чтобы подавить экспрессию гена c-myc. PBP1 стабилизирует структуру i-мотива bcl-2 и способствует ее формированию в нейтральных pH для повышения экспрессии гена bcl-2. [43]
Лиганды для i-мотива, используемые в качестве флуоресцентных зондов, включают тиазоловый оранжевый, 2,2'-диэтил-9-метилселенакарбоцианин бромид (DMSB), кристаллический фиолетовый , берберин нейтральный красный, тиофлавин T и производное диимида перилентетракарбоновой кислоты (PTCDI), первоначально рассматриваемые как зонды G4. [43]
Большие участки ДНК, богатой G/C, существуют в регуляторных областях генов и в терминальных областях хромосом и теломер. Эти расширения областей, богатых C, присутствуют у самых разных организмов и предполагают, что i-мотивы могут существовать in vivo . Постулируется, что i-мотивы играют роль в регуляции и экспрессии генов , ингибировании теломеразы , а также репликации и репарации ДНК. Хотя существуют ограниченные примеры образования i-мотивов в живых клетках, существуют условия, которые могут быть вызваны для создания i-мотивов. Сочетание примеров структур i-мотивов в клетках с этими экспериментами дает возможности для дальнейшего исследования.
Промоторные области некоторых генов богаты C. Он обнаружен более чем в 40% всех генов человека, особенно в онкогенах , областях развития скелетной системы и областях процессов ДНК, что усиливает предположение о том, что i-мотивы функционируют как регуляторы транскрипции генов. [48] [49] [50] Было замечено, что промоторная область гена фактора транскрипции у шелкопрядов, называемого BmPOUM2, образует структуры i-мотивов. Ген BmPOUM2 регулирует другой ген, который влияет на формирование кутикулы крылового диска во время метаморфоза, и, как было замечено, положительно регулируется образованием i-мотивов. [12] Это пример важной биологической функции в организме, на которую влияет структура i-мотива. Было также замечено, что человеческая теломерная ДНК (hTelo) образует структуры i-мотивов, также in vivo. Это было подтверждено флуоресцентной маркировкой с помощью iMab. [51] Эти i-мотивы hTelos были обнаружены в регуляторных областях человеческого генома во время поздней фазы G1 , что указывает на то, что i-мотивы участвуют в регуляции генов, важных для развития человеческого генома. Несмотря на то, что необходимо провести больше исследований для подтверждения этих результатов и предоставления конкретного понимания того, какие гены регулируются, это исследование было важным для начала обсуждения ролей i-мотивов и возможных применений у людей.
Аналогичная роль, которую могут играть i-мотивы, заключается в содействии связыванию факторов транскрипции во время транскрипции генов . Одним из способов, которым это может происходить, является временное раскручивание ДНК в структуры i-мотивов и g-квадруплексов в промоторных областях (например, BCL2 ), что позволяет транскрипцию отдельных цепей ДНК.
Образование g-квадруплексов и i-мотивов на концах хромосом может привести к ингибированию теломеразы. Образование структур i-мотивов на концах хромосом ингибирует связывание теломеразы, что препятствует удлинению теломер . Эти образования приводят к распаковке теломер, что обнажает теломеры и запускает реакцию повреждения ДНК, прекращая быстрый рост опухоли. [52] Поскольку структуры i-мотивов не являются специфически стабильными, открытие лиганда, который избирательно связывается с i-мотивами и стабилизирует их, было важно для ингибирования теломеразы. Было обнаружено, что после связывания с CSWNT i-мотивы мешают функциям теломеразы in vitro и in vivo в раковых клетках, что было оценено с помощью анализа TRAP. [53]
Связывание лигандов может усиливать и изменять функции i-мотива. Первым известным селективным лигандом для связывания с ДНК i-мотива являются модифицированные карбоксилом однослойные углеродные нанотрубки (CSWNT). Эти лиганды связываются с 5'-концевой большой бороздкой ДНК, чтобы индуцировать i-мотивы. Связывание CSWNT с i-мотивами значительно увеличивает термическую стабильность как при кислом, так и при биологическом pH. Таким образом, CSWNT поддерживает образование ДНК i-мотива через спаривание оснований Уотсона-Крика при pH 8,0. [54] Кроме того, многие белки и лиганды, фундаментальные для экспрессии генов, распознают олигонуклеотиды, богатые C, такие как белок связывания поли-C (PCBP) и гетерогенный ядерный рибонуклеопротеин K ( HNRPK ).
В присутствии богатых C одноцепочечных олигонуклеотидов PCBPs обладают способностью играть различные роли, такие как стабилизация мРНК и трансляционная репрессия или усиление в зависимости от богатого C одноцепочечного олигонуклеотида, на который направлено воздействие. [55] Подобно PCBPs, фактор транскрипции гетерогенный ядерный рибонуклеопротеин K (HNPRK) обладает способностью избирательно модулировать промоторные области белков, таких как KRAS и VGEF, в присутствии богатых C последовательностей, таких как i-мотивы. [56] [57] Богатые C последовательности, такие как i-мотивы, существуют по всему геному человека, выступая в качестве мишеней для различных белков, которые могут регулировать экспрессию генов различными способами и в различных местах.
Также были получены доказательства того, что i-мотивы могут мешать восстановлению и репликации ДНК. Был проведен эксперимент, в котором последовательности, которые способствовали образованию i-мотива в цепи ДНК, которая реплицировалась ДНК-полимеразой . В центре внимания этого эксперимента была визуализация i-мотивов у шелкопрядов, и было отмечено, что ДНК-полимераза была остановлена, что подразумевало, что i-мотивы могут препятствовать репликации и репарации ДНК. [58] Эффект остановки последовательностей i-мотива был выше, чем у шпильковой ДНК, хотя она термодинамически похожа. Это связано с топологией ДНК i-мотива. i-мотив уникален по сравнению с другими ДНК, потому что он интеркалирован, что препятствует раскручиванию. Это то, что останавливает ДНК-полимеразу. Это также может быть связано со стерическими препятствиями , которые не позволяют ДНК-полимеразе связываться. [16]
Образование G-квадруплексов может привести к тому, что его комплементарная цепь ДНК станет богатой C, что может сформировать i-мотив, но это не всегда так. Это очевидно, поскольку большая часть образования i-мотивов происходит в фазе G1, тогда как образование G-квадруплекса в основном отмечается в фазе S.
Применение i-мотивов сосредоточено вокруг биомедицинских тем, включая биосенсорику , системы доставки лекарств и молекулярные переключатели. Многие из современных применений ДНК с i-мотивами обусловлены ее чувствительностью к pH. Разработка систем, чувствительных к pH, включая связывание лигандов, представляет большой интерес для медицины, особенно в лечении и обнаружении рака.
Конформационное изменение от B ДНК к i-мотиву в кислых условиях делает его полезным в качестве колориметрического датчика для определения уровня глюкозы. Система обнаружения глюкозы, Poly(24C)-MB, была создана для обнаружения падения уровня pH в организмах, которое происходит при окислении глюкозы. Краситель системы Poly(24C)-MB, метиленовый синий (MB), не может связываться, когда индуцируются i-мотивы, что приводит к изменению цвета, которое легко увидеть. Эта система проста, экономически эффективна и точна благодаря конформации i-мотива. [59]
Системы сопряженных золотых наночастиц/i-мотивов были разработаны в качестве системы доставки лекарств, индуцируемой pH. Исследование, проведенное с использованием конъюгированных ДНК золотых наночастиц (DNA-GNP), создало молекулу доставки с участками одноцепочечной ДНК, богатой C, которые образуют i-мотивы в раковых клетках из-за их кислых эндосом . Когда молекула ДНК-GNP попадает в нормальную клетку, никаких изменений не происходит, но когда ДНК-GNP попадает в раковую клетку, она индуцирует конформацию i-мотива, которая запускает высвобождение в клетку доксорубицина (DOX), эффективного противоракового препарата против лейкемии и лимфомы Ходжкина . [60] Этот метод не только действует как эффективная система доставки лекарств, но также может быть модифицирован для обнаружения раковых клеток путем включения красителя или флуоресценции, во многом как колориметрический датчик.
Из-за образования i-мотива в кислых условиях и раковых клеток, имеющих кислые эндосомы, были исследованы терапия рака и тераностические приложения. В исследовании Такахаши и др. было обнаружено, что с помощью модифицированных карбоксилом однослойных углеродных нанотрубок (C-SWNT) активность теломеразы может быть подавлена, что потенциально может привести к апоптозу раковых клеток. Это связано с использованием фисетина, растительного флаванола, изменяющего конформацию структур i-мотива в шпилечные структуры, что является многообещающим результатом в исследовании различных методов лечения рака. [50] Связывание фисетина с i-мотива в промоторной области фактора роста эндотелия сосудов (VEGS), который является сигнальным белком для ангиогенеза , вызвало конформационное изменение в шпилечную структуру, что подавило его функционирование. Было высказано предположение, что фисетину следует связываться с петлей i-мотива, и при связывании он флуоресцирует. Флуоресцентная природа этой связи может быть использована в качестве диагностики для этого образования i-мотивов и образования i-мотивов, содержащих остатки гуанина. В целом, исследование предоставило новую информацию о том, как i-мотивы могут быть использованы в качестве метода лечения и обнаружения рака. [61]
Исследование в Боннском университете объяснило, как i-мотивы могут быть использованы в качестве молекулярных переключателей. В ходе исследования было синтезировано кольцо ДНК с определенными областями ДНК, богатой C. При pH 5 эти области сжимались, образуя i-мотивы, сжимая кольцо подобно тому, как закрывается мусорный мешок. При pH 8 области i-мотивов сжимались обратно в свои линейные формы, расслабляя кольцо. Кольца ДНК, которые могут сжиматься и ослабляться в зависимости от pH, могут использоваться для построения более сложных структур взаимосвязанной ДНК, таких как катенаны и ротаксаны. [62] В этом исследовании подчеркивалось, что манипуляция структурой i-мотива может открыть новые возможности в наномеханике . Другое исследование показало, что CSWNT могут вызывать образование i-мотива в человеческой теломерной ДНК и модифицировать ее, присоединяя окислительно-восстановительную активную метиленовую синюю группу к 3'-концу и электрод к 5'-концу. В конформации i-мотива эта модифицированная цепь ДНК производит значительное увеличение фарадеевского тока , который реагирует только на CSWNT, что позволяет исследователям обнаружить определенный тип углеродной нанотрубки с пределом прямого обнаружения 0,2 ppm.