Эукариотическая трансляция — это биологический процесс, посредством которого информационная РНК транслируется в белки у эукариот . Он состоит из четырех фаз: инициация, удлинение, терминация и повторная запись.

Инициация трансляции — это процесс, посредством которого рибосома и связанные с ней факторы связываются с мРНК и собираются в стартовом кодоне. Этот процесс определяется как кэп-зависимый, при котором рибосома изначально связывается с 5'-кэпом, а затем перемещается к стоп-кодону, или как кэп-независимый, при котором рибосома изначально не связывается с 5'-кэпом.
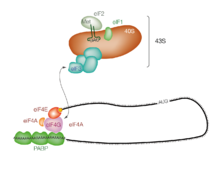
Инициация трансляции обычно включает взаимодействие определенных ключевых белков, факторов инициации , со специальным тегом, связанным с 5'-концом молекулы мРНК, 5' кэпом , а также с 5' UTR . Эти белки связывают малую (40S) рибосомальную субъединицу и удерживают мРНК на месте. [1]
eIF3 связан с 40S рибосомной субъединицей и играет роль в предотвращении преждевременного связывания большой (60S) рибосомной субъединицы. eIF3 также взаимодействует с комплексом eIF4F , который состоит из трех других факторов инициации: eIF4A , eIF4E и eIF4G . eIF4G — это белок-строительный каркас, который напрямую связывается как с eIF3, так и с двумя другими компонентами. eIF4E — это белок, связывающий кэп. Связывание кэпа eIF4E часто считается этапом, ограничивающим скорость кэп-зависимой инициации, а концентрация eIF4E является регуляторным звеном трансляционного контроля. Некоторые вирусы расщепляют часть eIF4G, которая связывает eIF4E, тем самым предотвращая кэп-зависимую трансляцию, чтобы захватить аппарат хозяина в пользу вирусных (кэп-независимых) сообщений. eIF4A — это АТФ-зависимая РНК-хеликаза, которая помогает рибосоме, разрешая определенные вторичные структуры, образованные вдоль транскрипта мРНК. [2] Поли (А)-связывающий белок (PABP) также ассоциируется с комплексом eIF4F через eIF4G и связывает поли-А-хвост большинства эукариотических молекул мРНК. Этот белок участвует в кольцевании мРНК во время трансляции. [3]
Этот комплекс преинициации 43S (43S PIC) в сопровождении белковых факторов движется по цепи мРНК к ее 3'-концу в процессе, известном как «сканирование», чтобы достичь стартового кодона (обычно AUG). У эукариот и архей аминокислота , кодируемая стартовым кодоном, — метионин . Заряженная метионином инициирующая тРНК (Met-тРНК i Met ) переносится в P-сайт малой рибосомальной субъединицы эукариотическим фактором инициации 2 (eIF2) . Он гидролизует ГТФ и подает сигнал для диссоциации нескольких факторов из малой рибосомальной субъединицы, что в конечном итоге приводит к ассоциации большой субъединицы (или субъединицы 60S ). Затем полная рибосома ( 80S ) начинает удлинение трансляции.
Регуляция синтеза белка частично зависит от фосфорилирования eIF2 (через α-субъединицу), которая является частью тройного комплекса eIF2-GTP-Met-tRNA i Met (eIF2-TC). Когда фосфорилируется большое количество eIF2, синтез белка подавляется. Это происходит при аминокислотном голодании или после вирусной инфекции. Однако небольшая часть этого фактора инициации естественным образом фосфорилируется. Другим регулятором является 4EBP , который связывается с фактором инициации eIF4E и ингибирует его взаимодействие с eIF4G , тем самым предотвращая зависимую от кэпа инициацию. Чтобы противостоять эффектам 4EBP, факторы роста фосфорилируют 4EBP, снижая его сродство к eIF4E и разрешая синтез белка. [ необходима цитата ]
В то время как синтез белка глобально регулируется путем модуляции экспрессии ключевых факторов инициации, а также количества рибосом, отдельные мРНК могут иметь разные скорости трансляции из-за наличия элементов регуляторной последовательности. Было показано, что это важно в различных условиях, включая мейоз дрожжей и реакцию этилена у растений. Кроме того, недавние исследования дрожжей и людей показывают, что эволюционное расхождение в цис-регуляторных последовательностях может влиять на регуляцию трансляции. [4] Кроме того, РНК- хеликазы , такие как DHX29 и Ded1/DDX3, могут участвовать в процессе инициации трансляции, особенно для мРНК со структурированными 5'UTR. [5]
Наиболее изученный пример инициации кэп-независимой трансляции у эукариот использует внутренний сайт входа рибосомы (IRES). В отличие от кэп-зависимой трансляции, кэп-независимая трансляция не требует 5'-кэпа для инициации сканирования от 5'-конца мРНК до стартового кодона. Рибосома может локализоваться в стартовом сайте путем прямого связывания, факторов инициации и/или ITAF (транс-действующих факторов IRES), минуя необходимость сканирования всего 5'-UTR . Этот метод трансляции важен в условиях, требующих трансляции определенных мРНК во время клеточного стресса, когда общая трансляция снижена. Примерами являются факторы, реагирующие на апоптоз и стресс-индуцированные ответы. [6]
Удлинение зависит от эукариотических факторов удлинения . В конце этапа инициации мРНК располагается таким образом, что следующий кодон может быть транслирован во время этапа удлинения синтеза белка. Инициирующая тРНК занимает сайт P в рибосоме , а сайт A готов принять аминоацил-тРНК. Во время удлинения цепи каждая дополнительная аминокислота добавляется к зарождающейся полипептидной цепи в трехшаговом микроцикле. Шаги в этом микроцикле: (1) позиционирование правильной аминоацил-тРНК в сайте A рибосомы, которая переносится в этот сайт с помощью eEF1, (2) формирование пептидной связи и (3) сдвиг мРНК на один кодон относительно рибосомы с помощью eEF2. В отличие от бактерий, у которых инициация трансляции происходит сразу после синтеза 5'-конца мРНК, у эукариот такая тесная связь между транскрипцией и трансляцией невозможна, поскольку транскрипция и трансляция осуществляются в отдельных отсеках клетки (ядре и цитоплазме ) . Эукариотические предшественники мРНК должны быть обработаны в ядре (например, кэпирование, полиаденилирование , сплайсинг) в рибосомах, прежде чем они будут экспортированы в цитоплазму для трансляции. На трансляцию также может влиять рибосомная пауза , которая может вызвать эндонуклеолитическую атаку тРНК, процесс, называемый распадом мРНК без перехода. Рибосомная пауза также способствует котрансляционному сворачиванию зарождающегося полипептида на рибосоме и задерживает трансляцию белка, пока он кодирует тРНК. Это может вызвать сдвиг рамки считывания рибосом. [7]
Прекращение удлинения зависит от эукариотических факторов высвобождения . Процесс похож на бактериальное прекращение , но в отличие от бактериального прекращения, существует универсальный фактор высвобождения , eRF1, который распознает все три стоп-кодона. После прекращения рибосома разбирается и высвобождается готовый полипептид. eRF3 — это рибосомозависимая ГТФаза, которая помогает eRF1 высвобождать готовый полипептид. Человеческий геном кодирует несколько генов, стоп-кодон мРНК которых на удивление текуч: в этих генах прекращение трансляции неэффективно из-за особых оснований РНК в непосредственной близости от стоп-кодона. Текучая терминация в этих генах приводит к трансляционному прочтению до 10% стоп-кодонов этих генов. Некоторые из этих генов кодируют функциональные домены белка в своем расширении считывания, так что могут возникать новые изоформы белка . Этот процесс был назван «функциональным трансляционным прочтением». [8]
Трансляция является одним из основных потребителей энергии в клетках, поэтому она строго регулируется. Развились многочисленные механизмы, которые контролируют и регулируют трансляцию как у эукариот, так и у прокариот . Регулирование трансляции может влиять на глобальную скорость синтеза белка, которая тесно связана с метаболическим и пролиферативным состоянием клетки. Чтобы глубже изучить этот сложный процесс, ученые обычно используют метод, известный как профилирование рибосом. [9] Этот метод позволяет исследователям сделать снимок транслатома, показывающий, какие части мРНК транслируются в белки рибосомами в данный момент времени. Профилирование рибосом дает ценную информацию о динамике трансляции, раскрывая сложное взаимодействие между последовательностью генов, структурой мРНК и регуляцией трансляции. Расширяя эту концепцию, более недавней разработкой является профилирование рибосом отдельных клеток, метод, который позволяет нам изучать процесс трансляции с разрешением отдельных клеток. [10] Профилирование рибосом отдельных клеток может пролить свет на гетерогенную природу клеток, что приведет к более тонкому пониманию того, как регуляция трансляции может влиять на поведение клеток, метаболическое состояние и реакцию на различные стимулы или условия.
В некоторых клетках некоторые аминокислоты могут быть истощены и, таким образом, повлиять на эффективность трансляции. Например, активированные Т-клетки секретируют интерферон-γ , который вызывает внутриклеточный дефицит триптофана путем повышения регуляции фермента индоламин 2,3-диоксигеназы 1 (IDO1). Удивительно, но, несмотря на истощение триптофана , внутрирамочный синтез белка продолжается через кодоны триптофана . Это достигается путем включения фенилаланина вместо триптофана. Полученные пептиды называются «заместителями» W>F. Такие заместители W>F широко распространены при определенных типах рака и связаны с повышенной экспрессией IDO1. Функционально заместители W>F могут нарушать активность белка . [11]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )