Каналы внутреннего выпрямления калия ( K ir , IRK ) являются специфическим липид-зависимым подмножеством калиевых каналов . На сегодняшний день в различных типах клеток млекопитающих, [1] растениях [2] и бактериях идентифицировано семь подсемейств . [3] Они активируются фосфатидилинозитол-4,5-бисфосфатом ( PIP 2 ). Нарушение работы каналов было связано с несколькими заболеваниями. [4] [5] Каналы IRK обладают пористым доменом, гомологичным таковому у потенциалзависимых ионных каналов , и фланкирующими трансмембранными сегментами (TMS). Они могут существовать в мембране в виде гомо- или гетероолигомеров , и каждый мономер обладает от 2 до 4 TMS. С точки зрения функции эти белки транспортируют калий (K + ) , с большей тенденцией к поглощению K + , чем к экспорту K + . [3] Процесс внутреннего выпрямления был открыт Денисом Ноблом в клетках сердечной мышцы в 1960-х годах [6] и Ричардом Адрианом и Аланом Ходжкиным в 1970 году в клетках скелетных мышц. [7]
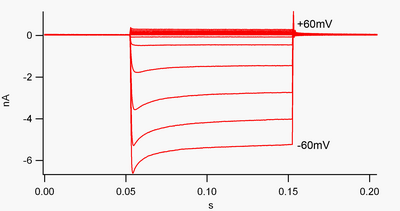
Канал, который является "внутренне-выпрямляющим", - это тот, который пропускает ток (положительный заряд) легче вовнутрь (в клетку), чем наружу (из клетки). Считается, что этот ток может играть важную роль в регуляции нейронной активности, помогая стабилизировать мембранный потенциал покоя клетки.
По соглашению, входящий ток (положительный заряд, движущийся в клетку) отображается в зажиме напряжения как отклонение вниз, в то время как исходящий ток (положительный заряд, движущийся из клетки) отображается как отклонение вверх. При мембранных потенциалах, отрицательных по отношению к потенциалу реверсии калия , выпрямляющие внутрь каналы K + поддерживают поток положительно заряженных ионов K + в клетку, подталкивая мембранный потенциал обратно к потенциалу покоя. Это можно увидеть на рисунке 1: когда мембранный потенциал зафиксирован отрицательно по отношению к потенциалу покоя канала (например, -60 мВ), течет входящий ток (т. е. положительный заряд течет в клетку). Однако, когда мембранный потенциал установлен положительным по отношению к потенциалу покоя канала (например, +60 мВ), эти каналы пропускают очень мало тока. Проще говоря, этот канал пропускает гораздо больше тока во внутреннем направлении, чем наружу, в своем рабочем диапазоне напряжений. Эти каналы не являются идеальными выпрямителями, так как они могут пропускать некоторый исходящий ток в диапазоне напряжений примерно до 30 мВ выше потенциала покоя.
Эти каналы отличаются от калиевых каналов, которые обычно отвечают за реполяризацию клетки после потенциала действия , таких как отсроченный выпрямитель и калиевые каналы типа А. Эти более «типичные» калиевые каналы преимущественно переносят внешние (а не внутренние) калиевые токи при деполяризованных мембранных потенциалах и могут рассматриваться как «внешне выпрямляющие». Когда впервые было обнаружено внутреннее выпрямление, его назвали «аномальным выпрямлением», чтобы отличить его от внешних калиевых токов. [8]
Внутренние выпрямители также отличаются от тандемных поровых доменных калиевых каналов , которые в значительной степени ответственны за токи «утечки» K + . [9] Некоторые внутренние выпрямители, называемые «слабыми внутренними выпрямителями», переносят измеримые внешние токи K + при напряжениях, положительных по отношению к потенциалу реверсии K + (соответствующих, но больших, чем небольшие токи выше линии 0 нА на рисунке 1). Они, вместе с каналами «утечки», устанавливают мембранный потенциал покоя клетки. Другие внутренние выпрямляющие каналы, называемые «сильными внутренними выпрямителями», переносят очень небольшой внешний ток вообще и в основном активны при напряжениях, отрицательных по отношению к потенциалу реверсии K + , где они переносят внутренний ток (гораздо большие токи ниже линии 0 нА на рисунке 1). [10]
Феномен внутреннего выпрямления каналов K ir является результатом высокоаффинного блока эндогенными полиаминами , а именно спермином , а также ионами магния , которые закупоривают поры канала при положительных потенциалах, что приводит к уменьшению внешних токов. Этот зависящий от напряжения блок полиаминами приводит к эффективному проведению тока только во внутреннем направлении. Хотя основная идея полиаминного блока понятна, конкретные механизмы все еще остаются спорными. [11]
Для активации всех каналов K ir необходим фосфатидилинозитол 4,5-бисфосфат (PIP 2 ). [12] PIP 2 связывается с K ir 2.2 и напрямую активирует его, обладая свойствами агониста. [13] В этом отношении каналы K ir являются ионными каналами, управляемыми лигандом PIP 2 .
Каналы K ir обнаружены во многих типах клеток, включая макрофаги , сердечные и почечные клетки, лейкоциты , нейроны и эндотелиальные клетки . Опосредуя небольшой деполяризующий ток K + при отрицательных мембранных потенциалах, они помогают установить мембранный потенциал покоя, а в случае группы K ir 3 они помогают опосредовать ингибирующие нейротрансмиттерные реакции, но их роли в клеточной физиологии различаются в зависимости от типа клеток:
Зависимость от напряжения может регулироваться внешним K + , внутренним Mg 2+ , внутренним АТФ и/или G-белками . Домены P каналов IRK демонстрируют ограниченное сходство последовательностей с таковыми из семейства VIC. Внутренние выпрямители играют роль в установке клеточных мембранных потенциалов, и закрытие этих каналов при деполяризации допускает возникновение длительных потенциалов действия с фазой плато. Внутренние выпрямители не имеют внутренних спиралей, чувствительных к напряжению, обнаруженных во многих каналах семейства VIC. В некоторых случаях, например, у Kir1.1a, Kir6.1 и Kir6.2, было предложено прямое взаимодействие с членом суперсемейства ABC для придания уникальных функциональных и регуляторных свойств гетеромерному комплексу, включая чувствительность к АТФ. Эти АТФ-чувствительные каналы обнаружены во многих тканях организма. Они делают активность канала чувствительной к цитоплазматическому соотношению АТФ/АДФ (увеличение АТФ/АДФ закрывает канал). Человеческие рецепторы сульфонилмочевины SUR1 и SUR2 (spQ09428 и Q15527 соответственно) являются белками ABC, которые регулируют каналы Kir6.1 и Kir6.2 в ответ на АТФ, а CFTR (TC #3.A.1.208.4) может регулировать Kir1.1a. [16]
Определены кристаллическая структура [17] и функция [18] бактериальных членов семейства IRK-C. KirBac1.1 из Burkholderia pseudomallei состоит из 333 аминокислотных остатков (aas) с двумя N-концевыми TMS, фланкирующими P-петлю (остатки 1-150), а C-концевая половина белка гидрофильна. Он транспортирует одновалентные катионы с селективностью: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM (протонированный N -метил- D -глюкамин ). Активность ингибируется Ba 2+ , Ca 2+ и низким pH. [18]
Существует семь подсемейств каналов K ir , обозначаемых как K ir 1 – K ir 7. [1] Каждое подсемейство имеет несколько членов (например, K ir 2.1, K ir 2.2, K ir 2.3 и т. д.), которые имеют почти идентичные аминокислотные последовательности среди известных видов млекопитающих.
Каналы K ir образуются из гомотетрамерных мембранных белков. Каждая из четырех идентичных белковых субъединиц состоит из двух трансмембранных альфа-спиралей (M1 и M2). Гетеротетрамеры могут образовываться между членами одного и того же подсемейства (т. е. K ir 2.1 и K ir 2.3), когда каналы сверхэкспрессируются.