
В химии ладдеран — это органическая молекула , содержащая два или более конденсированных циклобутановых колец. Название происходит от сходства ряда сросшихся циклобутановых колец с лестницей . Для синтеза ладдерановых соединений различной длины было разработано множество синтетических подходов . [1] Механизмы часто включают [2 + 2] фотоциклоприсоединения , полезную реакцию для создания напряженных 4-членных колец. Встречающиеся в природе ладдераны были идентифицированы как основные компоненты мембраны анаммоксосом анаммокс- бактерий типа Planctomycetota . [2]
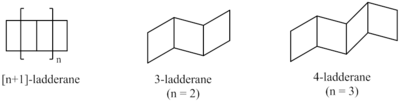
Синтетические подходы позволили получить лестницы различной длины. Разработана система классификации для описания ладдерейнов на основе количества последовательных колец. [3] Длина лестницы определяется числом в скобках, которое предшествует слову «лестница». Это равно количеству связей, общих для двух циклобутанов ( n ) плюс 1.
Ладдеран из 3 и более звеньев может соединяться в круг, образуя полосу, которую также можно рассматривать как два соединенных между собой параллельных циклоалкановых кольца. Их называют призманами .

У ладдеранов есть два типа стереохимических отношений. [3] Описывается относительное расположение атомов водорода при слиянии двух циклобутановых колец. Эти атомы водорода могут находиться как в цис-, так и в транс- конфигурации. Транс-ладдераны не были синтезированы из-за деформации кольца в этих соединениях.
Второе стереохимическое соотношение описывает ориентацию трех последовательных циклобутановых колец и, следовательно, применимо только к ладдеранам с n ≥ 2. Два внешних кольца могут находиться на одной стороне (син-) или на противоположной стороне (анти-) центральное кольцо.
Для лабораторного синтеза ладдерановых соединений использовались различные синтетические методы. Тремя основными подходами являются (1) димеризация предшественников полиенов , (2) поэтапное присоединение одного или двух колец за раз, (3) и олигомеризация. [3] Ниже приведены несколько примеров синтеза ладдерана.
Димеризация двух циклобутадиенов может привести к образованию как син-, так и антиладдерановых продуктов в зависимости от условий реакции. [4] Первый этап образования син-продукта включает получение 1,3-циклобутадиена путем обработки цис-3,4-дихлорциклобутена амальгамой натрия . Реагент проходит через металлированное промежуточное соединение перед образованием 1,3-циклобутадиена, который затем может димеризоваться с образованием синдиена. Гидрирование двойных связей приводит к образованию насыщенного син-[3]-ладдерана.
Для получения антипродукта цис-3,4-дихлорциклобутен обрабатывают амальгамой лития . [5] Производное лития подвергается реакции сочетания CC с образованием открытой димерной структуры. Это промежуточное соединение реагирует с образованием антидиена, который можно гидрировать с образованием конечного продукта анти-[3]-ладдерана.

Другой синтетический подход, разработанный Мартином и его коллегами, позволил синтезировать [4]-ладдераны. [4] Начальная стадия включает образование [2]-ладдерана в результате добавления двух эквивалентов малеинового ангидрида с ацетиленом . Остальные два кольца образуются в результате сжатия кольца Рамберга-Беклунда .

Мехта и его коллеги синтезировали лесдераны с длиной до 13 циклобутановых колец. [6] Этот процесс включает в себя генерацию дикарбометоксициклобутадиена in situ из его комплекса Fe(CO) 3 при низких температурах с добавлением нитрата аммония церия(IV) (CAN) . При генерации бутадиена быстро образуется смесь [ n ]-ладдеранов длиной до n = 13 с общим выходом 55%. Все ладдераны, синтезированные этим методом, имеют одну цис,син,цис-структуру. Это может быть результатом начальной димеризации двух циклобутадиенов, которая предпочтительно образует син-продукт, показанный ниже. Дальнейшая димеризация дает только антипродукт из-за стерических факторов.

В этих реакциях ладдераны образуются в результате множественных [2 + 2] фотоциклоприсоединения между двойными связями двух полиенов. [7] Осложнением, возникающим в результате этого подхода, является реакция предшественников через альтернативные, более благоприятные пути фотовозбуждения . Эти побочные реакции предотвращаются добавлением химического спейсера, который удерживает два полиена параллельно друг другу, позволяя происходить только [2 + 2] циклоприсоединения.
Обычным спейсером, используемым в этих реакциях, является [2.2]парациклофановая система. Он достаточно жесткий и может удерживать полиеновые хвосты достаточно близко для того, чтобы происходили циклоприсоединения.

МакГилливрей и его коллеги продемонстрировали, что супрамолекулярный подход к ковалентному синтезу в организованной среде твердого состояния, не содержащей растворителей, может обеспечить решение проблемы организации двух полиенов для внутримолекулярной реакции с образованием ладдерана. В частности, применив подход к контролю реакционной способности твердых тел с помощью молекул, которые служат линейными матрицами, они продемонстрировали полезность сокристаллизации резорцина (1,3-бензолдиола) или его производного с полностью транс -бис(4 -пиридил)поли- м -ен (4-пир-поли-м - ен) образует четырехкомпонентную молекулярную сборку 2(резорцин)·2(4-пир-поли-м - ен), в которой каждый резорцин предварительно организует , через два взаимодействия водородных связей O—H···N, два поли- м -ена для фотоприсоединения [2+2]. Два полиена расположены на матрицах так, что связи C=C олефинов лежат параллельно и разделены на расстояние <4,2 Å, положение, подходящее для фотореакции. УФ-облучение твердого тела дает целевой [ n ]ладдеран, при этом связи C=C реагируют с образованием конденсированного циклобутанового каркаса. Широкополосное УФ-облучение двух таких четырехкомпонентных супрамолекулярных ансамблей с водородными связями дает соответствующие ладдераны стереоспецифично и с количественным выходом в граммах. [8]

Ladderanes были впервые идентифицированы в редкой группе анаэробных аммонийокисляющих ( анаммокс ) бактерий, принадлежащих к типу Planctomycetota . Эти бактерии изолируют катаболические анаммокс-реакции во внутриклеточных компартментах, называемых анаммоксосомами. [2] Процесс анаммокса включает окисление аммония до газообразного азота с использованием нитрита в качестве конечного акцептора электронов . Промежуточными продуктами этого процесса являются два высокотоксичных соединения: гидразин (N 2 H 4 ) и гидроксиламин (NH 2 OH). Процесс окисления включает создание протонного градиента на внутрицитоплазматической поверхности анаммоксосомы. Диссипация протонного градиента связана с фосфорилированием АДФ посредством мембраносвязанных АТФаз . [9]
Анаммоксосомы обогащены ладдерановыми липидами, показанными справа. [10] Анализ мембран анаммоксосом бактерий Brocadia anammoxydans и Kuenenia stuttgartiensis показал, что ладдераны составляют более 50% мембранных липидов. Высокое содержание ладдерановых липидов в анаммоксосоме приводит к образованию исключительно плотной мембраны с пониженной проницаемостью. [11] Снижение проницаемости может уменьшить пассивную диффузию протонов через мембрану, которая рассеивает электрохимический градиент. Это будет особенно вредно для анаммокс-бактерий из-за относительно медленного метаболизма анаммокса. Также было высказано предположение, что снижение проницаемости связано с изоляцией высокотоксичных и мутагенных промежуточных продуктов, гидразина и гидроксиламина, которые могут легко диффундировать через биомембраны. Потеря этих ключевых промежуточных продуктов повредит ключевые клеточные компоненты, такие как ДНК , а также снизит катаболическую эффективность клетки.
Встречающийся в природе [5]-ладдерановый липид, названный пентациклоанаммоксовой кислотой, был синтезирован Кори и его коллегами. [12] Первый этап этой реакции включает бромирование с последующей циклизацией циклооктатетраена с образованием циклогексадиена. Этот циклогексадиен улавливается дибензилазодикарбоксилатом. Модификации функциональных групп производятся для получения циклобутана, который получается посредством фотоциклоприсоединения [2+2] с циклопентеноном с образованием второго циклобутанового кольца. Защита карбонильной группы с последующей реакцией экструзии N 2 дает еще два конденсированных циклобутановых кольца. Конечный циклобутан образуется в результате перегруппировки Вольфа , а алкильная цепь устанавливается путем олефинирования по Виттигу .
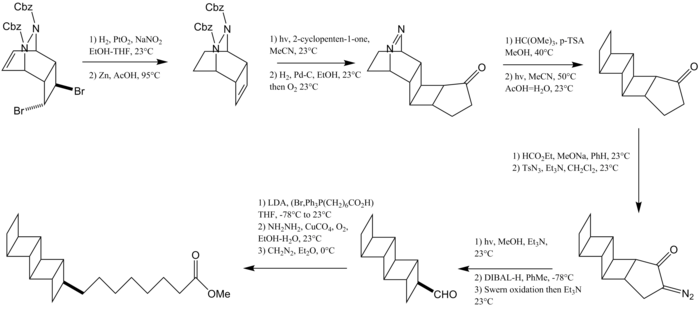
В 2016 году Бернс и его коллеги из Стэнфордского университета сообщили об энантиоселективном синтезе как [3]-, так и [5]-ладдерановых липидных хвостов и их включении в полный липид фосфатидилхолина . [13] Оба пути используют небольшой [2]-ладдереновый строительный блок бицикло[2.2.0]гексен, полученный реакцией Рамберга-Беклунда . Путь к получению жирной кислоты, содержащей [5]-ладдеран, включает димеризацию этого промежуточного соединения с образованием полностью анти- [5]-ладдеранового углеводорода. Хлорирование C–H марганцево -порфириновым катализатором и последующее отщепление приводит к образованию ненасыщенности с образованием [5]-ладдерена. Гидроборирование и реакция Цвайфеля устанавливают линейную алкильную группу.

Путь к [3]-ладдерановому жирному спирту начинается с фотоциклоприсоединения [2+2] между бромированным бензохиноном и бицикло[2.2.0]гексеном. Удаление H–Br и добавление цинкорганического соединения приводит к образованию алкилового спирта. Реакция деоксигенирования, опосредованная гидразином , с последующим гидрированием с использованием катализатора Крэбтри приводит к восстановлению до циклогексанового кольца.
