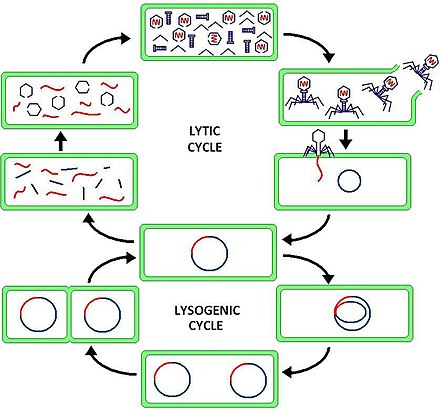

Лизогения , или лизогенный цикл , является одним из двух циклов размножения вируса ( вторым является литический цикл ). Лизогения характеризуется интеграцией нуклеиновой кислоты бактериофага в геном бактерии- хозяина или образованием кольцевого репликона в цитоплазме бактерии . В этом состоянии бактерия продолжает нормально жить и размножаться, в то время как бактериофаг находится в состоянии покоя в клетке-хозяине. Генетический материал бактериофага, называемый профагом , может передаваться дочерним клеткам при каждом последующем делении клетки, а более поздние события (такие как УФ-излучение или присутствие определенных химических веществ) могут высвободить его, вызывая пролиферацию новых фагов через литический процесс. цикл. [1]
Лизогенные циклы могут возникать и у эукариот , хотя метод включения ДНК до конца не изучен. Например, вирусы ВИЧ могут либо заражать человека литически, либо находиться в спящем состоянии (лизогенном) как часть генома инфицированных клеток, сохраняя способность вернуться к лизису в более позднее время. [2] Оставшаяся часть статьи посвящена лизогении у бактериальных хозяев.
Разница между лизогенным и литическим циклами заключается в том, что в лизогенных циклах распространение вирусной ДНК происходит посредством обычного прокариотического размножения, тогда как литический цикл является более непосредственным, поскольку приводит к очень быстрому созданию множества копий вируса и клетка разрушается. Одним из ключевых различий между литическим циклом и лизогенным циклом является то, что последний не лизирует клетку-хозяина сразу. [3] Фаги, которые реплицируются только посредством литического цикла, известны как вирулентные фаги, тогда как фаги, которые реплицируются с использованием как литического, так и лизогенного циклов, известны как умеренные фаги. [1]
В лизогенном цикле ДНК фага сначала интегрируется в бактериальную хромосому, образуя профаг. Когда бактерия размножается, профаг также копируется и присутствует в каждой из дочерних клеток. Дочерние клетки могут продолжать реплицироваться в присутствии профага, или профаг может выйти из бактериальной хромосомы, чтобы инициировать литический цикл. [1] В лизогенном цикле ДНК хозяина не гидролизуется, но в литическом цикле ДНК хозяина гидролизуется в литической фазе.
Бактериофаги – это вирусы, которые инфицируют и размножаются внутри бактерии. Умеренные фаги (такие как фаг лямбда ) могут размножаться, используя как литический , так и лизогенный цикл. [ нужна цитата ]
То, как фаг решает, в какой цикл вступить, зависит от множества факторов. [4] Например, если есть несколько других инфицирующих фагов (или если существует высокая множественность), вполне вероятно, что фаг будет использовать лизогенный цикл. Это может быть полезно для снижения общего соотношения фагов к хозяевам и, следовательно, для предотвращения убийства фагами своих хозяев, а также для увеличения потенциала выживания фага, что делает это формой естественного отбора. Фаг может решить покинуть хромосому и войти в литический цикл, если он подвергается воздействию агентов, повреждающих ДНК, таких как УФ-излучение и химические вещества. Другие факторы, которые могут вызвать умеренное высвобождение фага, включают температуру, pH, осмотическое давление и низкую концентрацию питательных веществ. [5] Однако фаги также могут спонтанно повторно войти в литический цикл. В 80-90% одноклеточных инфекций фаги вступают в лизогенный цикл. В остальных 10-20% фаги вступают в литический цикл. [ нужна цитата ]
Иногда можно определить, в какой цикл входит фаг, изучая морфологию бляшек в бактериальной культуре. [6] Поскольку фаги, вступающие в литический цикл, убивают бактериальные клетки хозяина, бляшки становятся прозрачными (фото А). Бляшки также могут иметь ореолообразное кольцо по краю, что указывает на то, что эти клетки не были полностью лизированы. Напротив, заражение фагами, вступающими в лизогенный цикл, приводит к образованию мутных или мутных бляшек, поскольку клетки, содержащие лизогенный фаг, не лизируются и могут продолжать расти (фото Б). Однако известно, что существуют и исключения из этого правила: неумеренные фаги по-прежнему демонстрируют мутные бляшки, а мутанты умеренных фагов могут образовывать прозрачные бляшки в результате потери способности образовывать лизоген. [ нужна цитата ]
См. сравнение прозрачных и мутных бляшек, образованных литическими и лизогенными фагами соответственно, в «Руководстве по обнаружению фагов».
Методы обнаружения фагов, высвободившихся из лизогенного цикла, включают электронную микроскопию, экстракцию ДНК или размножение на чувствительных штаммах. [5]
В ходе лизогенного цикла геном бактериофага не экспрессируется и вместо этого интегрируется в геном бактерии с образованием профага . [7] В неактивной форме профаг передается каждый раз, когда клетка-хозяин делится. Если профаги становятся активными, они могут покинуть бактериальную хромосому и войти в литический цикл, где подвергаются копированию ДНК, синтезу белка, сборке фага и лизису. [4] Поскольку генетическая информация бактериофага включена в генетическую информацию бактерий как профаг, бактериофаг пассивно реплицируется, когда бактерия делится с образованием дочерних бактериальных клеток. [7] В этом сценарии дочерние бактериальные клетки содержат профаг и известны как лизогены . Лизогены могут оставаться в лизогенном цикле в течение многих поколений, но могут переключиться на литический цикл в любое время посредством процесса, известного как индукция. [7] Во время индукции ДНК профага вырезается из бактериального генома и транскрибируется и транслируется, чтобы создать белки оболочки вируса и регулировать литический рост. [7]

Примером вируса, который использует лизогенный цикл в своих целях, является вирус простого герпеса. [9] После первого входа в литический цикл и заражения человека-хозяина он вступает в лизогенный цикл. Это позволяет ему проникать к сенсорным нейронам нервной системы и оставаться незамеченным в течение длительного периода времени. При генитальном герпесе латентный период устанавливается в пояснично-крестцовых ганглиях дорсальных корешков, нейронах спинномозговых нервов. [10] Вирус герпеса может затем выйти из этой спящей стадии и снова войти в литический цикл, вызывая симптомы заболевания. Таким образом, хотя вирусы герпеса могут вступать как в литический, так и в лизогенный циклы, латентный период позволяет вирусу выживать и уклоняться от обнаружения иммунной системой из-за низкой экспрессии вирусных генов.
Модельным организмом для изучения лизогении является фаг лямбда. Интеграция профага (также известная как гомологичная рекомбинация), поддержание лизогении, индукция и контроль удаления фагового генома при индукции подробно описаны в статье о фаге лямбда . [6]
Бактериофаги являются паразитическими, поскольку они заражают своих хозяев, используют бактериальные механизмы для репликации и, в конечном итоге, лизируют бактерии. Умеренные фаги могут приносить как преимущества, так и недостатки для своих хозяев через лизогенный цикл. Во время лизогенного цикла геном вируса включается в виде профага, а репрессор предотвращает репликацию вируса. Тем не менее, фаг умеренного климата может избежать репрессий и начать размножаться, производить вирусные частицы и лизировать бактерии. [11] Умеренное избегание репрессии фага было бы недостатком для бактерий. С другой стороны, профаг может переносить гены, которые повышают вирулентность хозяина и устойчивость к иммунной системе. Кроме того, репрессор, продуцируемый профагом, который предотвращает экспрессию профаговых генов, придает бактериям-хозяевам иммунитет от литической инфекции родственными вирусами. [11]
Другая система, arbitium , недавно была описана для бактериофагов, заражающих несколько видов Bacillus , в которой решение между лизисом и лизогенией передается между бактериями с помощью пептидного фактора. [12] [13]
При некоторых взаимодействиях между лизогенными фагами и бактериями может происходить лизогенная конверсия, которую также можно назвать фаговой конверсией. Это когда умеренный фаг вызывает изменение фенотипа инфицированных бактерий , которое не является частью обычного фагового цикла. Изменения часто могут затрагивать внешнюю мембрану клетки, делая ее непроницаемой для других фагов или даже увеличивая патогенную способность бактерий для хозяина. Таким образом, умеренные бактериофаги также играют роль в распространении факторов вирулентности , таких как экзотоксины и экзоферменты, среди бактерий. Это изменение затем остается в геноме инфицированной бактерии, копируется и передается дочерним клеткам.
Было показано, что лизогенная конверсия способствует образованию биопленок у Bacillus anthracis [14]. Штаммы B. anthracis , вылеченные от всех фагов, не способны образовывать биопленки, которые представляют собой прикрепленные к поверхности бактериальные сообщества, которые позволяют бактериям лучше получать доступ к питательным веществам и выдерживать стрессы окружающей среды. [15] Помимо образования биопленок у B. anthracis , лизогенная конверсия Bacillus subtilis , Bacillus thuringiensis и Bacillus cereus показала повышенную скорость или степень споруляции. [14] Спорообразование приводит к образованию эндоспор , которые представляют собой метаболически спящие формы бактерий, обладающие высокой устойчивостью к температуре, ионизирующей радиации, высыханию, антибиотикам и дезинфицирующим средствам. [14]
Также было показано, что невирулентные бактерии трансформируются в высоковирулентные патогены посредством лизогенной конверсии с факторами вирулентности, переносимыми лизогенным профагом. [16] Гены вирулентности, переносимые внутри профагов в виде дискретных автономных генетических элементов, известных как дебилы , дают бактериям преимущество, которое косвенно приносит пользу вирусу за счет повышения выживаемости лизогена. [14]
Примеры:
Предложены стратегии борьбы с некоторыми бактериальными инфекциями путем блокирования индукции профагов (перехода от литического цикла к лизогенному циклу) путем устранения агентов индукции in vivo . [16] Активные формы кислорода (АФК), такие как перекись водорода, являются сильными окислителями, которые могут разлагаться на свободные радикалы и вызывать повреждение ДНК бактерий, что приводит к индукции профага. [16] Одной из потенциальных стратегий борьбы с индукцией профагов является использование глутатиона , сильного антиоксиданта , который может удалять промежуточные соединения свободных радикалов. [16] Другой подход может заключаться в том, чтобы вызвать сверхэкспрессию репрессора CI, поскольку индукция профагов происходит только тогда, когда концентрация репрессора CI слишком низка. [16]