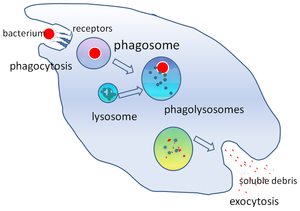
В клеточной биологии фагосома представляет собой везикулу , образующуюся вокруг частицы, поглощенной фагоцитом посредством фагоцитоза . Профессиональные фагоциты включают макрофаги , нейтрофилы и дендритные клетки (ДК). [1]
Фагосома образуется в результате слияния клеточной мембраны вокруг микроорганизма , стареющей клетки или апоптотической клетки . Фагосомы имеют мембраносвязанные белки , которые рекрутируются и сливаются с лизосомами с образованием зрелых фаголизосом . Лизосомы содержат гидролитические ферменты и активные формы кислорода (АФК), которые убивают и переваривают патогены . Фагосомы также могут образовываться в непрофессиональных фагоцитах, но они могут поглощать лишь меньший круг частиц и не содержат АФК. Полезные материалы (например, аминокислоты ) из переваренных частиц перемещаются в цитозоль , а отходы удаляются путем экзоцитоза . Формирование фагосом имеет решающее значение для гомеостаза тканей и как врожденной, так и адаптивной защиты хозяина от патогенов.
Однако некоторые бактерии могут использовать фагоцитоз в качестве стратегии инвазии. Они либо размножаются внутри фаголизосомы ( например, виды Coxiella ) [2] , либо выходят в цитоплазму до того, как фагосома сливается с лизосомой (например, виды Rickettsia ). [3] Многие микобактерии, в том числе Mycobacterium Tuberculosis [4] [5] и Mycobacterium avium paratuberculosis , [6] могут манипулировать макрофагами хозяина , чтобы предотвратить слияние лизосом с фагосомами и образование зрелых фаголизосом. Такое неполное созревание фагосомы сохраняет внутри нее благоприятную для возбудителей среду. [7]
Фагосомы достаточно велики, чтобы разлагать целые бактерии или апоптотические и стареющие клетки, диаметр которых обычно превышает 0,5 мкм. [8] Это означает, что фагосома на несколько порядков больше эндосомы , размер которой измеряется в нанометрах .
Фагосомы образуются, когда патогены или опсонины связываются с трансмембранным рецептором, которые случайным образом распределяются по поверхности клеток-фагоцитов. При связывании передача сигналов «снаружи внутрь» запускает полимеризацию актина и образование псевдоподий , которые окружают микроорганизм и сливаются с ним. Протеинкиназа C , фосфоинозитид-3-киназа и фосфолипаза C (PLC) необходимы для передачи сигналов и контроля интернализации частиц. [9] Больше рецепторов клеточной поверхности могут связываться с частицей по механизму, подобному застежке-молнии, когда патоген окружен, увеличивая авидность связывания . [10] Рецептор Fc (FcR), рецепторы комплемента (CR), рецептор маннозы и дектин-1 являются фагоцитарными рецепторами, что означает, что они могут индуцировать фагоцитоз, если они экспрессируются в нефагоцитарных клетках, таких как фибробласты . [11] Другие белки, такие как Toll-подобные рецепторы, участвуют в распознавании образов патогенов и часто рекрутируются в фагосомы, но не вызывают специфически фагоцитоз в нефагоцитарных клетках, поэтому они не считаются фагоцитирующими рецепторами.
Опсонины — это молекулярные метки, такие как антитела и комплементы , которые прикрепляются к патогенам и активируют фагоцитоз. Иммуноглобулин G (IgG) является основным типом антител, присутствующих в сыворотке . Это часть адаптивной иммунной системы , но она связана с врожденным ответом , привлекая макрофаги к фагоцитозу патогенов. Антитело связывается с микробами с помощью вариабельного домена Fab , а домен Fc связывается с рецепторами Fc (FcR), индуцируя фагоцитоз.
Интернализация, опосредованная комплементом, имеет гораздо менее значительные выпячивания мембраны, но передача сигналов обоих путей сходится, чтобы активировать Rho GTPases . [12] Они контролируют полимеризацию актина, которая необходима для слияния фагосомы с эндосомами и лизосомами.
Другие непрофессиональные фагоциты обладают некоторой степенью фагоцитарной активности, например, эпителиальные клетки щитовидной железы и мочевого пузыря, которые могут поглощать эритроциты, и эпителиальные клетки сетчатки, интернализирующие палочки сетчатки. [8] Однако непрофессиональные фагоциты не экспрессируют специфические фагоцитарные рецепторы, такие как FcR, и имеют гораздо более низкую скорость интернализации.
Некоторые инвазивные бактерии могут также индуцировать фагоцитоз в нефагоцитарных клетках, опосредуя захват хозяина. Например, шигеллы могут секретировать токсины, которые изменяют цитоскелет хозяина и проникают на базолатеральную сторону энтероцитов . [13]
Поскольку мембрана фагосомы образуется путем слияния плазматической мембраны, основной состав фосфолипидного бислоя одинаков. Эндосомы и лизосомы затем сливаются с фагосомой, образуя мембрану, особенно когда поглощаемая частица очень велика, например, паразит . [14] Они также доставляют в фагосому различные мембранные белки и модифицируют структуру органелл.
Фагосомы могут поглощать искусственные латексные шарики низкой плотности , а затем очищаться по градиенту концентрации сахарозы , что позволяет изучить структуру и состав. [15] Очищая фагосомы в разные моменты времени, можно также охарактеризовать процесс созревания. Ранние фагосомы характеризуются Rab5, которые переходят в Rab7 по мере того, как везикула созревает в поздние фагосомы.
Возникающая фагосома по своей сути не обладает бактерицидными свойствами. По мере созревания он становится более кислым от pH 6,5 до pH 4 и приобретает характерные белковые маркеры и гидролитические ферменты. Различные ферменты функционируют при различных оптимальных значениях pH, образуя определенный диапазон, поэтому каждый из них работает на узких стадиях процесса созревания. Активность фермента можно точно настроить путем изменения уровня pH, что обеспечивает большую гибкость. Фагосома движется вдоль микротрубочек цитоскелета , последовательно сливаясь с эндосомами и лизосомами в динамическом режиме «поцелуй и беги» . [16] Этот внутриклеточный транспорт зависит от размера фагосом. Органеллы большего размера (диаметром около 3 мкм) очень устойчиво транспортируются от периферии клетки к перинуклеарной области, тогда как органеллы меньшего размера (диаметром около 1 мкм) транспортируются более двунаправленно туда и обратно между центром клетки и периферией клетки. [17] Вакуолярные протонные насосы (v-АТФаза) доставляются в фагосому для подкисления отсека органелл, создавая более агрессивную среду для патогенов и способствуя деградации белков. Бактериальные белки денатурируются при низком pH и становятся более доступными для протеаз, на которые не влияет кислая среда. Ферменты позже перерабатываются из фаголизосомы перед выделением, поэтому они не тратятся впустую. Состав фосфолипидной мембраны также меняется по мере созревания фагосомы. [15]
Слияние может занять от нескольких минут до нескольких часов в зависимости от содержимого фагосомы; FcR или слияние, опосредованное рецептором маннозы, длится менее 30 минут, но фагосомам, содержащим латексные шарики, может потребоваться несколько часов, чтобы слиться с лизосомами. [8] Предполагается, что состав мембраны фагосом влияет на скорость созревания. Микобактерия туберкулеза имеет очень гидрофобную клеточную стенку , которая, как предполагается, предотвращает рециркуляцию мембраны и рекрутирование факторов слияния, поэтому фагосома не сливается с лизосомами, и бактерия избегает деградации. [18]
Молекулы меньшего размера в просвете передаются путем слияния быстрее, чем молекулы большего размера, что предполагает, что между фагосомой и другими везикулами во время «поцелуй и беги» образуется небольшой водный канал, через который возможен только ограниченный обмен. [8]
Вскоре после интернализации F-актин деполимеризуется из новообразованной фагосомы и становится доступным для эндосом для слияния и доставки белков. [8] Процесс созревания разделяется на раннюю и позднюю стадии в зависимости от характерных белков-маркеров, регулируемых малыми Rab-ГТФазами. Rab5 присутствует на ранних фагосомах и контролирует переход к поздним фагосомам, отмеченным Rab7. [19]
Rab5 рекрутирует киназу PI-3 и другие привязывающие белки, такие как Vps34, к мембране фагосомы, поэтому эндосомы могут доставлять белки в фагосому. Rab5 частично участвует в переходе к Rab7 через комплекс CORVET и комплекс HOPS у дрожжей. [19] Точный путь созревания у млекопитающих не совсем понятен, но предполагается, что HOPS может связывать Rab7 и вытеснять ингибитор диссоциации гуанозиновых нуклеотидов (GDI). [20] Rab11 участвует в рециркуляции мембран. [21]
Фагосома сливается с лизосомами, образуя фаголизосому, обладающую различными бактерицидными свойствами. Фаголизосома содержит активные формы кислорода и азота (АФК и РНС), а также гидролитические ферменты. Компартмент также является кислым из-за протонных насосов (v-АТФазы), которые транспортируют H + через мембрану, используемую для денатурации бактериальных белков.
Точные свойства фаголизосом варьируются в зависимости от типа фагоцита. Те, что находятся в дендритных клетках, обладают более слабыми бактерицидными свойствами, чем в макрофагах и нейтрофилах. Также макрофаги делятся на провоспалительные «киллеры» М1 и «ремонтники» М2. Фаголизосомы M1 могут метаболизировать аргинин в высокореактивный оксид азота , тогда как M2 используют аргинин для производства орнитина , который способствует пролиферации клеток и восстановлению тканей. [22]
Макрофаги и нейтрофилы являются профессиональными фагоцитами, отвечающими за большую часть деградации патогенов, но у них разные бактерицидные методы. Нейтрофилы имеют гранулы, которые сливаются с фагосомой. Гранулы содержат НАДФН-оксидазу и миелопероксидазу , которые производят токсичные производные кислорода и хлора для уничтожения патогенов в результате окислительного взрыва . Протеазы и антимикробные пептиды также высвобождаются в фаголизосому. У макрофагов отсутствуют гранулы, и для переваривания микробов они больше полагаются на подкисление фаголизосом, гликозидазы и протеазы. [21] Фагосомы в дендритных клетках менее кислые и обладают гораздо более слабой гидролитической активностью из-за более низкой концентрации лизосомальных протеаз и даже присутствия ингибиторов протеаз.
Формирование фагосом связано с воспалением посредством общих сигнальных молекул. Киназа PI-3 и PLC участвуют как в механизме интернализации, так и в запуске воспаления. [9] Эти два белка, наряду с Rho GTPases, являются важными компонентами врожденного иммунного ответа, индуцируя выработку цитокинов и активируя сигнальный каскад MAP-киназы . Вырабатываются провоспалительные цитокины, включая IL-1β , IL-6 , TNFα и IL-12 . [8]
Процесс жестко регулируется, и воспалительная реакция варьируется в зависимости от типа частиц внутри фагосомы. Апоптозные клетки, инфицированные патогеном, вызывают воспаление, но поврежденные клетки, которые деградируют в ходе нормального тканевого обмена, этого не делают. Реакция также различается в зависимости от фагоцитоза, опосредованного опсонином. Реакции, опосредованные FcR и рецептором маннозы, производят провоспалительные активные формы кислорода и молекулы арахидоновой кислоты , но реакции, опосредованные CR, не приводят к образованию этих продуктов. [8]
Незрелые дендритные клетки (ДК) могут фагоцитировать, но зрелые ДК не могут из-за изменений в Rho GTPases, участвующих в ремоделировании цитоскелета. [21] Фагосомы ДК менее гидролитические и кислые, чем фагосомы макрофагов и нейтрофилов, поскольку ДК в основном участвуют в презентации антигена , а не в деградации патогена. Им необходимо сохранять фрагменты белка подходящего размера для специфического распознавания бактерий, поэтому пептиды расщепляются лишь частично. [21] Пептиды бактерий передаются в главный комплекс гистосовместимости (MHC). Пептидные антигены презентируются лимфоцитам , где они связываются с рецепторами Т-клеток и активируют Т-клетки , устраняя разрыв между врожденным и адаптивным иммунитетом. [9] Это характерно для млекопитающих , птиц и челюстных рыб, поскольку у насекомых нет адаптивного иммунитета. [23]

Древние одноклеточные организмы, такие как амеба, используют фагоцитоз как способ приобретения питательных веществ, а не как иммунную стратегию. Они поглощают другие более мелкие микробы и переваривают их в фагосоме со скоростью около одной бактерии в минуту, что намного быстрее, чем профессиональные фагоциты. [24] Для почвенной амебы Dictyostelium discoideum основным источником питания являются бактерии Legionella pneumophila , вызывающие болезнь легионеров у людей. [25] Созревание фагосом у амебы очень похоже на таковое у макрофагов, поэтому они используются в качестве модельного организма для изучения этого процесса. [16]
Фагосомы разрушают стареющие клетки и апоптотические клетки для поддержания тканевого гомеостаза. Эритроциты имеют одну из самых высоких скоростей оборота в организме и фагоцитируются макрофагами в печени и селезенке . У эмбриона процесс удаления мертвых клеток недостаточно изучен, но он не осуществляется макрофагами или другими клетками, полученными из гемопоэтических стволовых клеток . [26] Только у взрослых апоптотические клетки фагоцитируются профессиональными фагоцитами. Воспаление запускается только определенными молекулярными структурами, связанными с патогеном или повреждением (PAMP или DAMP), удаление стареющих клеток не является воспалительным. [14]
Аутофагосомы отличаются от фагосом тем, что они в основном используются для избирательного разрушения поврежденных цитозольных органелл, таких как митохондрии ( митофагия ). Однако, когда клетка голодает или подвергается стрессу, аутофагосомы также могут неселективно разрушать органеллы, чтобы обеспечить клетку аминокислотами и другими питательными веществами. [27] Аутофагия не ограничивается профессиональными фагоцитами, она впервые обнаружена в гепатоцитах крысы клеточным биологом Кристианом де Дювом . [28] Аутофагосомы имеют двойную мембрану: внутренняя из поглощенной органеллы, а внешняя мембрана, как предполагается, образуется из эндоплазматического ретикулума или промежуточного компартмента ER-Гольджи (ERGIC). [29] Аутофагосома также сливается с лизосомами, разрушая ее содержимое. Когда M.tuberculosis подавляет закисление фагосом, гамма-интерферон может вызвать аутофагию и спасти процесс созревания. [30]
Многие бактерии научились уклоняться от бактерицидных свойств фагосом или даже использовать фагоцитоз в качестве стратегии инвазии.