Фазы льда — это все возможные состояния вещества для воды как твердого тела. Изменения давления и температуры приводят к появлению различных фаз, которые имеют различные свойства и молекулярную геометрию. В настоящее время наблюдаются двадцать одна фаза, включая как кристаллические, так и аморфные льды. В современной истории фазы были обнаружены посредством научных исследований с использованием различных методов, включая повышение давления, приложение силы, зародышеобразующие агенты и другие.
На Земле большая часть льда находится в гексагональной фазе Ice I h . Менее распространенные фазы могут быть найдены в атмосфере и под землей из-за более экстремальных давлений и температур. Некоторые фазы производятся людьми для использования в наномасштабах из-за их свойств. В космосе аморфный лед является наиболее распространенной формой, что подтверждается наблюдениями. Таким образом, теоретически предполагается, что это самая распространенная фаза во Вселенной. Различные другие фазы могут быть найдены естественным образом в астрономических объектах.
Большинство жидкостей под повышенным давлением замерзают при более высоких температурах, поскольку давление помогает удерживать молекулы вместе. Однако сильные водородные связи в воде делают ее другой: при некоторых давлениях выше 1 атм (0,10 МПа) вода замерзает при температуре ниже 0 °C. Подвергаясь более высокому давлению и различным температурам, лед может образовываться в девятнадцати отдельных известных кристаллических фазах. При осторожности по крайней мере пятнадцать из этих фаз (одним из известных исключений является лед X) можно восстановить при давлении окружающей среды и низкой температуре в метастабильной форме. [1] [2] Типы различаются по их кристаллической структуре, упорядочению протонов [3] и плотности. Существуют также две метастабильные фазы льда под давлением, обе полностью водородно-неупорядоченные; это Лед IV и Лед XII.


Принятая кристаллическая структура обычного льда была впервые предложена Лайнусом Полингом в 1935 году. Структура льда I h представляет собой решетку вюрцита , грубо говоря, одну из складчатых плоскостей, состоящих из мозаичных гексагональных колец с атомом кислорода на каждой вершине и краями колец, образованными водородными связями . Плоскости чередуются в узоре ABAB, причем плоскости B являются отражениями плоскостей A вдоль тех же осей, что и сами плоскости. [4] Расстояние между атомами кислорода вдоль каждой связи составляет около 275 пм и одинаково между любыми двумя связанными атомами кислорода в решетке. Угол между связями в кристаллической решетке очень близок к тетраэдрическому углу 109,5°, что также довольно близко к углу между атомами водорода в молекуле воды (в газовой фазе), который составляет 105°.
Этот тетраэдрический угол связи молекулы воды по существу объясняет необычно низкую плотность кристаллической решетки — для решетки выгодно быть организованной с тетраэдрическими углами, даже несмотря на то, что есть энергетический штраф в увеличенном объеме кристаллической решетки. В результате большие гексагональные кольца оставляют почти достаточно места для существования внутри другой молекулы воды. Это дает природному льду его редкое свойство быть менее плотным, чем его жидкая форма. Тетраэдрически-угловые водородно-связанные гексагональные кольца также являются механизмом, который заставляет жидкую воду быть самой плотной при 4 °C. Вблизи 0 °C в жидкой воде образуются крошечные гексагональные ледяные I h -подобные решетки, с большей частотой ближе к 0 °C. Этот эффект снижает плотность воды, в результате чего она становится самой плотной при 4 °C, когда структуры образуются нечасто.
В наиболее известной форме льда, льду I h , кристаллическая структура характеризуется атомами кислорода, образующими гексагональную симметрию с почти тетраэдрическими углами связи. Эта структура стабильна до −268 °C (5 K; −450 °F), о чем свидетельствуют рентгеновская дифракция [5] и измерения теплового расширения с чрезвычайно высоким разрешением. [6] Лед I h также стабилен при приложенном давлении до примерно 210 мегапаскалей (2100 атм), где он переходит в лед III или лед II. [7]
Хотя большинство форм льда являются кристаллическими, также существует несколько аморфных (или «стекловидных») форм льда. Такой лед представляет собой аморфную твердую форму воды, в молекулярной структуре которой отсутствует дальний порядок. Аморфный лед образуется либо путем быстрого охлаждения жидкой воды до температуры стеклования (около 136 К или -137 °C) за миллисекунды (поэтому молекулы не успевают сформировать кристаллическую решетку ), либо путем сжатия обычного льда при низких температурах. Наиболее распространенная на Земле форма, лед низкой плотности, обычно образуется в лабораторных условиях путем медленного накопления молекул водяного пара ( физическое осаждение из паров ) на очень гладкой поверхности металлического кристалла при температуре 120 К. В открытом космосе ожидается, что он будет образовываться аналогичным образом на различных холодных субстратах, таких как частицы пыли. [8] Напротив, гиперзакаленная стекловидная вода (HGW) образуется путем распыления мелкодисперсного тумана из капель воды в жидкость, такую как пропан, около 80 К, или путем гиперзакаления мелких микрометровых капель на держателе образца, находящемся при температуре жидкого азота 77 К, в вакууме. Для предотвращения кристаллизации капель требуются скорости охлаждения выше 10 4 К/с. При температуре жидкого азота 77 К HGW кинетически стабильна и может храниться в течение многих лет.
Аморфные льды обладают свойством подавлять дальние флуктуации плотности и, следовательно, являются почти гипероднородными . [9] Классификационный анализ показывает, что аморфные льды низкой и высокой плотности являются стеклами . [10]

Лед из теоретической суперионной воды может обладать двумя кристаллическими структурами. При давлениях свыше 50 ГПа (7 300 000 фунтов на квадратный дюйм) такой суперионный лед будет иметь объемно-центрированную кубическую структуру. Однако при давлениях свыше 100 ГПа (15 000 000 фунтов на квадратный дюйм) структура может перейти к более стабильной гранецентрированной кубической решетке. Некоторые оценки предполагают, что при чрезвычайно высоком давлении около 1,55 ТПа (225 000 000 фунтов на квадратный дюйм) лед будет приобретать металлические свойства. [12]

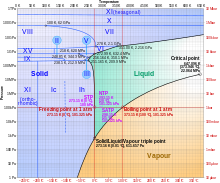
Лед, вода и водяной пар могут сосуществовать в тройной точке , которая составляет ровно 273,16 К (0,01 °C) при давлении 611,657 Па . [14] [15] Кельвин был определен как 1/273.16 разницы между этой тройной точкой и абсолютным нулем , [16] хотя это определение изменилось в мае 2019 года. [17] В отличие от большинства других твердых тел, лед трудно перегреть . В эксперименте лед при температуре −3 °C был перегрет примерно до 17 °C в течение примерно 250 пикосекунд . [18]

Скрытая теплота плавления равна5987 Дж/моль , а его скрытая теплота сублимации равна50 911 Дж/моль . Высокая скрытая теплота сублимации в основном указывает на прочность водородных связей в кристаллической решетке. Скрытая теплота плавления намного меньше, отчасти потому, что жидкая вода вблизи 0 °C также содержит значительное количество водородных связей. Напротив, структура льда II является водородно-упорядоченной, что помогает объяснить изменение энтропии на 3,22 Дж/моль, когда кристаллическая структура меняется на структуру льда I. Кроме того, лед XI, орторомбическая, водородно-упорядоченная форма льда I h , считается наиболее стабильной формой при низких температурах.
По оценкам, энтропия перехода ото льда XIV к льду XII составляет 60% от энтропии Полинга на основе измерений DSC. [19] Образование льда XIV из льда XII более предпочтительно при высоком давлении. [20]
Когда аморфный лед средней плотности сжимается, высвобождается и затем нагревается, он выделяет большое количество тепловой энергии, в отличие от других видов водяного льда, которые возвращаются в свою нормальную форму после аналогичной обработки. [21]

Атомы водорода в кристаллической решетке лежат очень близко вдоль водородных связей, и таким образом, что каждая молекула воды сохраняется. Это означает, что каждый атом кислорода в решетке имеет два водорода, смежных с ним: примерно в 101 пм вдоль 275 пм длины связи для льда Ih. Кристаллическая решетка допускает значительный беспорядок в положениях атомов водорода, замороженных в структуре, по мере ее охлаждения до абсолютного нуля. В результате кристаллическая структура содержит некоторую остаточную энтропию , присущую решетке и определяемую числом возможных конфигураций положений водорода, которые могут быть образованы, при этом все еще сохраняя требование, чтобы каждый атом кислорода имел только два водорода в непосредственной близости, и каждая водородная связь, соединяющая два атома кислорода, имела только один атом водорода. [22] Эта остаточная энтропия S 0 равна 3,4 ± 0,1 Дж моль -1 К -1 . [23]
Существуют различные способы приближения этого числа из первых принципов. Ниже приведен способ, использованный Лайнусом Полингом . [24] [25]
Предположим, что в решетке льда есть заданное число молекул воды N. Чтобы вычислить ее остаточную энтропию, нам нужно подсчитать число конфигураций, которые может принять решетка. Атомы кислорода закреплены в точках решетки, но атомы водорода расположены на ребрах решетки. Проблема состоит в том, чтобы выбрать один конец каждого ребра решетки, к которому будет присоединен водород, таким образом, чтобы каждый атом кислорода был связан с двумя атомами водорода.
Атомы кислорода можно разделить на два набора в шахматном порядке, показанном на рисунке в виде черных и белых шаров. Обратите внимание на атомы кислорода в одном наборе: их N /2 . У каждого есть четыре водородные связи, с двумя водородами близко к нему и двумя далеко. Это означает, что для этого атома кислорода существуют разрешенные конфигурации водородов (см. Биномиальный коэффициент ). Таким образом, существует 6 конфигураций N /2 , которые удовлетворяют этим N /2 атомам. Но теперь рассмотрим оставшиеся N /2 атомов кислорода: в общем случае они не будут удовлетворены (т. е. рядом с ними не будет ровно двух атомов водорода). Для каждого из них существует 2 4 = 16 возможных размещений атомов водорода вдоль их водородных связей, из которых 6 разрешены. Поэтому, наивно, мы могли бы ожидать, что общее число конфигураций будет равно
Используя формулу энтропии Больцмана , заключаем, что где k — постоянная Больцмана , а R — молярная газовая постоянная . Таким образом, молярная остаточная энтропия равна .
Тот же ответ можно найти и другим способом. Сначала сориентируйте каждую молекулу воды случайным образом в каждой из 6 возможных конфигураций, затем проверьте, что каждое ребро решетки содержит ровно один атом водорода. Предполагая, что ребра решетки независимы, тогда вероятность того, что одно ребро содержит ровно один атом водорода, равна 1/2, и поскольку всего имеется 2N ребер, мы получаем общее количество конфигураций , как и раньше.

Эта оценка «наивна», поскольку она предполагает, что шесть из 16 конфигураций водорода для атомов кислорода во втором наборе могут быть выбраны независимо, что неверно. Более сложные методы могут быть использованы для лучшего приближения точного числа возможных конфигураций и достижения результатов, более близких к измеренным значениям. Нагл (1966) использовал суммирование рядов для получения . [26]
В качестве наглядного примера уточнения рассмотрим следующий способ уточнения второго метода оценки, приведенного выше. Согласно ему, шесть молекул воды в гексагональном кольце допускают конфигурации. Однако, путем явного перечисления, на самом деле существует 730 конфигураций. Теперь в решетке каждый атом кислорода участвует в 12 гексагональных кольцах, так что всего имеется 2N колец для N атомов кислорода, или 2 кольца для каждого атома кислорода, что дает уточненный результат . [27]
Эти фазы названы в соответствии с номенклатурой Бриджмена . Большинство из них были созданы только в лабораторных условиях при различных температурах и давлениях. [28]

Свойства льда II были впервые описаны и зафиксированы Густавом Генрихом Иоганном Аполлоном Тамманном в 1900 году во время его экспериментов со льдом под высоким давлением и низкими температурами. Получив лед III, Тамманн затем попытался сконденсировать лед при температуре от −70 до −80 °C (от 203 до 193 K; от −94 до −112 °F) под давлением 200 МПа (2000 атм). Тамманн отметил, что в этом состоянии лед II был плотнее, чем, как он наблюдал, лед III. Он также обнаружил, что оба типа льда могут поддерживаться при нормальном атмосферном давлении в стабильном состоянии, пока температура поддерживается на уровне температуры жидкого воздуха , что замедляет изменение конформации обратно в лед I h . [45]
В более поздних экспериментах Бриджмена в 1912 году было показано, что разница в объеме между льдом II и льдом III находилась в диапазоне 0,0001 м 3 /кг (2,8 куб. дюймов/фунт). Эта разница не была обнаружена Тамманном из-за небольшого изменения, и именно поэтому он не смог определить кривую равновесия между ними. Кривая показала, что структурное изменение от льда III к льду II с большей вероятностью произойдет, если среда ранее находилась в структурной конформации льда II. Однако, если был получен образец льда III, который никогда не был в состоянии льда II, его можно было переохладить даже ниже −70 °C без того, чтобы он превратился в лед II. Однако, наоборот, любой перегрев льда II был невозможен в отношении сохранения той же формы. Бриджмен обнаружил, что кривая равновесия между льдом II и льдом IV была во многом такой же, как и для льда III, имея те же свойства стабильности и небольшое изменение объема. Однако кривая между льдом II и льдом V была совершенно разной: пузырек кривой представлял собой по сути прямую линию, а разница в объеме почти всегда составляла 0,000 0545 м 3 /кг (1,51 куб. дюйма/фунт). [45]
Поскольку лед II полностью упорядочен по водороду, присутствие его неупорядоченного аналога представляет большой интерес. Шепард и др. [83] исследовали фазовые границы льдов, легированных NH 4 F, поскольку сообщалось, что NH 4 F является реагентом, разупорядочивающим водород. Однако добавление 2,5 мол.% NH 4 F привело к исчезновению льда II вместо образования неупорядоченного льда II. Согласно расчету DFC Накамуры и др. [84], фазовая граница между льдом II и его неупорядоченным аналогом оценивается в области стабильности жидкой воды.
Исследование 1981 года Энгельгардта и Камба выявило кристаллическую структуру льда IV с помощью низкотемпературной монокристаллической рентгеновской дифракции, описав ее как ромбоэдрическую элементарную ячейку с пространственной группой R-3c. [85] В этом исследовании упоминалось, что структура льда IV может быть получена из структуры льда Ic путем разрезания и формирования некоторых водородных связей и добавления тонких структурных искажений. Шепард и др. [86] сжали окружающую фазу NH 4 F, изоструктурного материала льда, чтобы получить NH 4 F II, водородно-связанная сеть которого похожа на лед IV. Поскольку сжатие льда Ih приводит к образованию высокоплотного аморфного льда (HDA), а не льда IV, они утверждали, что вызванное сжатием преобразование льда I в лед IV важно, назвав это «коллапсом Энгельгардта–Камба» (EKC). Они предположили, что причина, по которой мы не можем получить лед IV напрямую из льда Ih, заключается в том, что лед Ih неупорядочен по водороду; если атомы кислорода расположены в структуре льда IV, водородные связи могут не образовываться из-за несоответствия донора и акцептора. [87] и Раман [88]
Неупорядоченная природа льда IV была подтверждена исследованиями нейтронной порошковой дифракции Лоббана (1998) [89] и Клотца и др. (2003). [90] Кроме того, разница энтропии между льдом VI (неупорядоченная фаза) и льдом IV очень мала, согласно измерениям Бриджмена. [91]
Было предложено несколько органических зародышеобразующих реагентов для селективной кристаллизации льда IV из жидкой воды [92] , но даже с такими реагентами кристаллизация льда IV из жидкой воды была очень сложной и, по-видимому, была случайным событием. В 2001 году Зальцманн и его коллеги сообщили о совершенно новом методе воспроизводимого приготовления льда IV ; [93] когда аморфный лед высокой плотности (HDA) нагревается со скоростью 0,4 К/мин и давлением 0,81 ГПа, лед IV кристаллизуется при температуре около 165 К. Продукты кристаллизации определяются скоростью нагрева; быстрый нагрев (более 10 К/мин) приводит к образованию однофазного льда XII.
Упорядоченный аналог льда IV еще никогда не сообщался. Исследование группы Зальцмана 2011 года сообщило о более подробных данных ДСК, где эндотермическая характеристика становится больше, когда образец восстанавливается при более высоком давлении. Они предложили три сценария для объяснения экспериментальных результатов: слабое упорядочение водорода, ориентационный стеклование и механические искажения. [94] сообщили о термограммах ДСК льда IV, легированного HCl, обнаруживших эндотермическую характеристику при температуре около 120 К. Десять лет спустя Розу-Финсен и Зальцманн (2021) сообщили о более подробных данных ДСК, где эндотермическая характеристика становится больше, когда образец восстанавливается при более высоком давлении. Они предложили три сценария для объяснения экспериментальных результатов: слабое упорядочение водорода, ориентационный стеклование и механические искажения. [95]
Лед VII — единственная неупорядоченная фаза льда, которая может быть упорядочена простым охлаждением. (В то время как лед I h теоретически превращается в протонно-упорядоченный лед XI в геологических масштабах времени, на практике необходимо добавлять небольшие количества катализатора KOH.) Он образует (упорядоченный) лед VIII ниже 273 К до ~8 ГПа. Выше этого давления температура перехода VII–VIII быстро падает, достигая 0 К при ~60 ГПа. [96] Таким образом, лед VII имеет наибольшее поле стабильности из всех молекулярных фаз льда. Кубические кислородные подрешетки, которые образуют основу структуры льда VII, сохраняются до давлений не менее 128 ГПа; [97] это давление существенно выше, чем давление, при котором вода полностью теряет свой молекулярный характер, образуя лед X. Во льдах высокого давления протонная диффузия (движение протонов вокруг кислородной решетки) доминирует над молекулярной диффузией, эффект, который был измерен напрямую. [98]


Лед XI — это водородоупорядоченная форма обычного льда. Полная внутренняя энергия льда XI примерно на одну шестую ниже, чем у льда I h , поэтому в принципе он должен естественным образом образовываться, когда лед I h охлаждается до температуры ниже 72 К. Низкая температура, необходимая для достижения этого перехода, коррелирует с относительно низкой разницей энергий между двумя структурами. [99] Намеки на водородоупорядоченность во льду наблюдались еще в 1964 году, когда Денгель и др. приписали пик тока термостимулированной деполяризации (TSD) существованию протонно-упорядоченной сегнетоэлектрической фазы. [100] Однако они не смогли окончательно доказать, что фазовый переход имел место, и Онзагер указал, что пик также может возникнуть из-за движения дефектов и несовершенств решетки. Онзагер предложил экспериментаторам искать резкое изменение теплоемкости, проводя тщательный калориметрический эксперимент. Фазовый переход в лед XI был впервые экспериментально обнаружен в 1972 году Шуджи Кавадой и другими. [101] [102] [103]
Молекулы воды во льду I h окружены четырьмя полухаотично направленными водородными связями. Такие расположения должны измениться на более упорядоченное расположение водородных связей, обнаруженное во льду XI при низких температурах, пока локализованные протонные прыжки достаточно активны; процесс, который становится легче с ростом давления. [104] Соответственно, лед XI, как полагают, имеет тройную точку с гексагональным льдом и газообразной водой при (~72 К, ~0 Па). Лед I h , который был преобразован в лед XI, а затем обратно в лед I h , при повышении температуры сохраняет некоторые упорядоченные по водороду домены и более легко снова преобразуется обратно в лед XI. [105] Исследование нейтронной порошковой дифракции показало, что небольшие упорядоченные по водороду домены могут существовать до 111 К. [106]
Существуют четкие различия в спектрах Рамана между льдами I h и XI, причем лед XI показывает гораздо более сильные пики в трансляционной (~230 см −1 ), либрационной (~630 см −1 ) и синфазной асимметричной области растяжения (~3200 см −1 ) [107] [108]
Ice I c также имеет протонно-упорядоченную форму. Общая внутренняя энергия льда XI c была предсказана как подобная льду XI h . [109]
Лед XI является сегнетоэлектриком , что означает, что он имеет собственную поляризацию. Чтобы считаться сегнетоэлектриком, он также должен демонстрировать переключение поляризации под действием электрического поля, что не было окончательно продемонстрировано, но неявно предполагается возможным. [110] Кубический лед также имеет сегнетоэлектрическую фазу, и в этом случае сегнетоэлектрические свойства льда были экспериментально продемонстрированы на монослойных тонких пленках. [111] В аналогичном эксперименте сегнетоэлектрические слои гексагонального льда были выращены на платиновой (111) поверхности. Материал имел поляризацию, которая имела длину затухания 30 монослоев, что предполагает, что тонкие слои льда XI можно выращивать на подложках при низкой температуре без использования легирующих примесей. [112] Одномерный нано-ограниченный сегнетоэлектрический лед XI был создан в 2010 году. [113]
Хотя исходная фаза льда VI была открыта в 1935 году, соответствующие протонно-упорядоченные формы (лед XV) не наблюдались до 2009 года. Теоретически, протонное упорядочение во льду VI было предсказано несколько раз; например, расчеты теории функционала плотности предсказали, что температура фазового перехода составляет 108 К, а наиболее стабильная упорядоченная структура является антисегнетоэлектрической в пространственной группе Cc , в то время как антисегнетоэлектрическая структура P 2 1 2 1 2 1 была обнаружена на 4 К на молекулу воды выше по энергии. [114]
14 июня 2009 года Кристоф Зальцманн и его коллеги из Оксфордского университета сообщили об экспериментальном обнаружении упорядоченной фазы льда VI, названной льдом XV, и заявили, что ее свойства существенно отличаются от предсказанных. В частности, лед XV является антисегнетоэлектриком , а не сегнетоэлектриком, как было предсказано. [115] [116]
В частности, лед XV имеет меньшую плотность (больший объем элементарной ячейки), чем лед VI. Это делает переход от беспорядка к порядку от VI к XV более предпочтительным при низких давлениях. Действительно, дифференциальная сканирующая калориметрия Шепарда и Зальцмана показала, что повторный нагрев охлажденного допированного HCl льда XV при давлении окружающей среды даже приводит к экзотермам, возникающим из-за переходного упорядочения, т. е. более упорядоченный лед XV получается при давлении окружающей среды. В соответствии с этим, переход льда VI-XV является обратимым при давлении окружающей среды. [117] Также было показано, что допирование HCl селективно эффективно в производстве льда XV, в то время как другие кислоты и основания (HF, LiOH, HClO 4 , HBr) не значительно усиливают образование льда XV. [118]
На основе порошковой нейтронной дифракции была подробно исследована кристаллическая структура льда XV. Некоторые исследователи предположили, что в сочетании с расчетами теории функционала плотности ни одна из возможных идеально упорядоченных ориентационных конфигураций не является энергетически предпочтительной. Это подразумевает, что существует несколько энергетически близких конфигураций, которые сосуществуют во льду XV. Они предложили «орторомбическую пространственную группу Pmmn как правдоподобную пространственную группу для описания усредненной по времени и пространству структуры льда XV». [119] Другие исследователи утверждали, что модель P -1 по-прежнему является лучшей (со вторым лучшим кандидатом P21 ) , тогда как уточнение Ритвельда с использованием пространственной группы Pmmn хорошо работает только для плохо упорядоченных образцов. Параметры решетки, в частности b и c , являются хорошими индикаторами образования льда XV. Объединив расчеты теории функционала плотности, они успешно построили полностью упорядоченную модель в P -1 и показали, что экспериментальные данные дифракции следует анализировать с использованием пространственных групп, которые допускают полный водородный порядок, в то время как модель Pmmn принимает только частично упорядоченные структуры. [120] -->

В 2016 году было объявлено об открытии новой формы льда. [77] Эта новая форма, характеризуемая как «пористый водный лед, метастабильный при атмосферных температурах», была открыта путем взятия заполненного льда и удаления неводных компонентов, оставляя кристаллическую структуру позади, подобно тому, как лед XVI, другая пористая форма льда, была синтезирована из клатратного гидрата . [121] [122]
Чтобы создать лед XVII, исследователи сначала создали заполненный лед в стабильной фазе под названием C0 из смеси водорода (H2 ) и воды (H2O ) , используя температуры от 100 до 270 К (от -173 до -3 °C; от -280 до 26 °F) и давления от 360 до 700 МПа (от 52 000 до 102 000 фунтов на кв. дюйм; от 3600 до 6900 атм), и C2 - это все стабильные твердые фазы смеси молекул H2 и H2O , образованные при высоких давлениях. [121] [78] Хотя их иногда называют клатратными гидратами (или клатратами), у них отсутствует структура, похожая на клетку, обычно встречающаяся в клатратных гидратах, и их правильнее называть заполненными льдами. [121] Затем заполненный лед помещают в вакуум, и температура постепенно повышается до тех пор, пока водород не освободится от кристаллической структуры. [78] Если поддерживать температуру в диапазоне от 110 до 120 К (от −163 до −153 °C; от −262 до −244 °F), примерно через два часа структура освободится от любых обнаруживаемых молекул водорода. [77] Полученная форма метастабильна при комнатной температуре при температуре ниже 120 К (−153 °C; −244 °F), но разрушается в лед I h (обычный лед) при температуре выше 130 К (−143 °C; −226 °F). [78] Кристаллическая структура имеет гексагональную природу, а поры представляют собой спиральные каналы диаметром около 6,10 Å (6,10 × 10−10 м; 2,40 × 10−8 дюймов ). [ 77 ] [78]
В 2020 году было сообщено, что кубический лед на основе тяжелой воды (D 2 O) может быть образован из льда XVII. [29] Это было сделано путем нагревания специально подготовленного порошка льда XVII D 2 O. [29] Результат не имел структурных деформаций по сравнению со стандартным кубическим льдом, или льдом I sd . [29] Это открытие было сообщено примерно в то же время, когда другая исследовательская группа объявила, что им удалось получить чистый кубический лед D 2 O, сначала синтезировав заполненный лед в фазе C 2 , а затем декомпрессировав его. [123]
В 1988 году были сделаны предсказания о так называемом состоянии суперионной воды. [124] В суперионной воде молекулы воды распадаются, а ионы кислорода кристаллизуются в равномерно распределенную решетку, в то время как ионы водорода свободно плавают внутри решетки кислорода. [125] Свободно подвижные ионы водорода делают суперионную воду почти такой же проводящей , как типичные металлы, что делает ее суперионным проводником . [79] Лед кажется черным по цвету. [126] [127] Он отличается от ионной воды , которая является гипотетическим жидким состоянием, характеризующимся неупорядоченным супом ионов водорода и кислорода.
Первоначальные доказательства были получены из оптических измерений лазерно-нагретой воды в ячейке с алмазной наковальней [128] и из оптических измерений воды, подвергнутой удару чрезвычайно мощными лазерами. [126] Первое окончательное доказательство кристаллической структуры кислородной решетки в суперионной воде было получено из рентгеновских измерений лазерно-шокированной воды, о которых было сообщено в 2019 году. [79] В 2005 году Лоуренс Фрид возглавил группу в Ливерморской национальной лаборатории имени Лоуренса (LLNL) для воссоздания условий формирования суперионной воды. Используя технику, включающую столкновение молекул воды между алмазами и ее сверхнагрев лазерами, они наблюдали сдвиги частот, которые указывали на то, что произошел фазовый переход . Группа также создала компьютерные модели , которые указывали на то, что они действительно создали суперионную воду. [129] В 2013 году Хью Ф. Уилсон, Майкл Л. Вонг и Буркхард Милитцер из Калифорнийского университета в Беркли опубликовали статью, в которой предсказывали гранецентрированную кубическую решетчатую структуру, которая возникнет при более высоких давлениях. [130] Дополнительные экспериментальные доказательства были получены Мариусом Миллотом и его коллегами в 2018 году путем создания высокого давления в воде между алмазами и последующего воздействия на воду лазерным импульсом. [126] [127]
По состоянию на 2013 год [update]предполагается, что суперионный лед может обладать двумя кристаллическими структурами. При давлениях свыше 50 ГПа (7 300 000 фунтов на квадратный дюйм) предсказывается, что суперионный лед примет объемно-центрированную кубическую структуру. Однако при давлениях свыше 100 ГПа и температурах свыше 2000 К предсказывается, что структура сместится к более стабильной гранецентрированной кубической решетке. [130]
В 2018 году существование суперионного льда было подтверждено в лабораторных условиях. Чтобы создать необходимое давление, исследователи LLNL сжимали небольшие количества воды между кусками алмаза. При 2500 МПа (360 000 фунтов на квадратный дюйм) вода превращалась в лед VII, форму, которая является твердой при комнатной температуре. Этот лед, заключенный в ячейки алмазной наковальни , был доставлен в Рочестерский университет для взрыва лазером. Менее чем за миллиардную долю секунды лед подвергался условиям, аналогичным условиям в мантии ледяного гиганта . Температура в ячейках алмаза поднялась на тысячи градусов, а давление увеличилось более чем в миллион раз по сравнению с атмосферой Земли. [131] [132] Эксперимент пришел к выводу, что ток в проводящей воде действительно переносится ионами, а не электронами, и, таким образом, указал на то, что вода является суперионной. [131] Более поздние эксперименты той же группы LLNL использовали рентгеновскую кристаллографию на каплях воды, подвергнутых лазерному шоку, чтобы определить, что ионы кислорода входят в гранецентрированную кубическую фазу, которая была названа льдом XVIII и описана в журнале Nature в мае 2019 года. [79]
Первый отчет относительно льда XIX был опубликован в 2018 году группой Томаса Лёртинга из Австрии. [80] Они закалили лед VI, легированный HCl, до 77 К при различных давлениях от 1,0 до 1,8 ГПа, чтобы собрать термограммы дифференциальной сканирующей калориметрии (ДСК), диэлектрический спектр , спектр Рамана и картины рентгеновской дифракции . В сигналах ДСК наблюдалась эндотермическая особенность при температуре около 110 К в дополнение к эндотерме, соответствующей переходу льда XV-VI. Кроме того, спектры Рамана, диэлектрические свойства и соотношение параметров решетки отличались от таковых у льда XV. Основываясь на этих наблюдениях, они предположили существование второй упорядоченной по водороду фазы льда VI, назвав ее льдом бета-XV.
В 2019 году Александр Розу-Финсен и Кристоф Зальцман утверждали, что нет необходимости считать это новой фазой льда, и предложили сценарий состояния «глубокого стеклообразного». [133] Согласно их данным ДСК, размер эндотермической особенности зависит не только от давления закалки-восстановления, но также от скорости нагрева и продолжительности отжига при 93 К. Они также собрали профили нейтронной дифракции льда VI/XV , легированного хлоридом дейтерия , восстановленного при закалке, и полученного при различных давлениях 1,0, 1,4 и 1,8 ГПа, чтобы показать, что между ними нет существенных различий. Они пришли к выводу, что низкотемпературная эндотерма возникла из-за кинетических особенностей, связанных со стеклованием глубоких стеклообразных состояний неупорядоченного льда VI.
Различение двух сценариев (новая водородно-упорядоченная фаза против глубоко-стеклообразного неупорядоченного льда VI) стало открытым вопросом, и дебаты между двумя группами продолжились. Тоени и др. (группа Лёртинга) [134] собрали еще одну серию спектров Рамана льда бета-XV и сообщили, что (i) лед XV, приготовленный по протоколу, описанному ранее, содержит как домены льда XV, так и домены льда бета-XV; (ii) при нагревании спектры Рамана льда бета-XV показали потерю H-порядка. Напротив, группа Зальцмана снова выступила за правдоподобность сценария «глубоко-стеклообразного состояния», основанного на экспериментах по дифракции нейтронов и неупругому рассеянию нейтронов. [135] Основываясь на своих экспериментальных результатах, лед VI и глубоко-стекловидный лед VI имеют очень похожие характеристики, основанные как на упругом (дифракционном) рассеянии, так и на неупругом рассеянии, и отличаются от свойств льда XV.
В 2021 году три группы по отдельности сообщили о дополнительных кристаллографических доказательствах новой фазы (лед XIX): Ямане и др. (группа Хироюки Каги и Казуки Комацу из Японии), Гассера и др. (группа Лёртинга) и группа Зальцмана. Ямане и др. [82] собрали профили нейтронной дифракции in situ ( т. е. под высоким давлением) и обнаружили новые характеристики Брэгга, полностью отличающиеся как от льда VI, так и от льда XV. Они выполнили уточнение профилей методом Ритвельда на основе суперъячейки льда XV и предложили несколько ведущих кандидатов для пространственной группы льда XIX: P-4, Pca21, Pcc2, P21/a и P21/c. Они также измерили диэлектрические спектры in situ и определили фазовые границы льдов VI/XV/XIX. Они обнаружили, что знак наклона границы становится отрицательным с положительного при 1,6 ГПа, что указывает на существование двух различных фаз согласно соотношению Клаузиуса–Клапейрона .
Гассер и др. [136] также собрали порошковые нейтронные дифрактограммы льдов VI, XV и XIX, восстановленных путем закалки, и обнаружили схожие кристаллографические особенности с теми, о которых сообщали Ямане и др., заключив, что P-4 и Pcc2 являются вероятными кандидатами на пространственную группу. Результаты Ямане и др. и Гассера и др. предполагают частично упорядоченную водородом структуру. Гассер и др. также обнаружили изотопный эффект с помощью ДСК; низкотемпературная эндотерма для льда XIX D 2 O, легированного DCl, была значительно меньше, чем для льда XIX H 2 O, легированного HCl, и что легирование 0,5% H 2 O в D 2 O достаточно для перехода к упорядочению.
Несколько месяцев спустя Зальцманн и др. опубликовали статью, основанную на экспериментах по дифракции нейтронов in-situ порошка льда XIX. [137] В отличие от своих предыдущих отчетов они приняли идею новой фазы (лед XIX), поскольку наблюдали схожие особенности с предыдущими двумя отчетами. Однако они уточнили свои профили дифракции на основе неупорядоченной структурной модели (Pbcn) и утверждали, что новые отражения Брэгга можно объяснить искажениями льда VI, поэтому лед XIX все еще можно рассматривать как глубокое стеклообразное состояние льда VI. Кристаллическая структура льда XIX, включая водородный порядок/беспорядок, по состоянию на 2022 год все еще является предметом дискуссий.


Практически весь лед в биосфере представляет собой лед I h (произносится: ice one h , также известный как ice-phase-one ). Лед I h проявляет множество своеобразных свойств, которые имеют отношение к существованию жизни и регулированию глобального климата . [138] Например, его плотность ниже, чем у жидкой воды . Это объясняется наличием водородных связей , которые заставляют атомы сближаться в жидкой фазе. [139] Из-за этого лед I h плавает на воде, что весьма необычно по сравнению с другими материалами. Твердая фаза материалов обычно более плотно и аккуратно упакована и имеет более высокую плотность, чем жидкая фаза. Когда озера замерзают, они делают это только на поверхности, в то время как дно озера остается около 4 °C (277 K; 39 °F), потому что вода имеет наибольшую плотность при этой температуре. Это аномальное поведение воды и льда позволяет рыбам выживать в суровые зимы. Плотность льда I h увеличивается при охлаждении примерно до −211 °C (62 K; −348 °F); ниже этой температуры лед снова расширяется ( отрицательное тепловое расширение ). [5] [6]
Помимо льда I h , в верхних слоях атмосферы иногда может присутствовать небольшое количество льда I c . [140] Считается, что он отвечает за наблюдение гало Шайнера , редкого кольца, которое возникает около 28 градусов от Солнца или Луны. [141] Однако позже было показано, что многие образцы атмосферы, которые ранее описывались как кубический лед, представляют собой неупорядоченный лед с тригональной симметрией, [142] [143] [144] и его окрестили «наиболее граненой ледяной фазой в буквальном и более общем смысле». [145] Первые настоящие образцы кубического льда были зарегистрированы только в 2020 году. [30] [123]
Низкоплотная ASW (LDA), также известная как гиперзакаленная стекловидная вода, может быть ответственна за серебристые облака на Земле и обычно образуется путем осаждения водяного пара в холодных или вакуумных условиях. Ледяные облака образуются на и ниже мезопаузы высокой широты Земли (~90 км), где наблюдаются температуры, падающие ниже 100 К. [146] Было высказано предположение, что однородное зарождение ледяных частиц приводит к аморфному льду низкой плотности. [147] Аморфный лед, вероятно, ограничен самыми холодными частями облаков, а укладка неупорядоченного льда I, как полагают, доминирует в других местах этих полярных мезосферных облаков . [148]
В 2018 году лед VII был идентифицирован среди включений , обнаруженных в природных алмазах . [149] Благодаря этой демонстрации того, что лед VII существует в природе, Международная минералогическая ассоциация должным образом классифицировала лед VII как отдельный минерал . [150] Лед VII предположительно образовался, когда вода, заключенная внутри алмазов, сохраняла высокое давление глубокой мантии из-за прочности и жесткости алмазной решетки, но охлаждалась до поверхностных температур, создавая необходимую среду высокого давления без высокой температуры. [151]
Лед XI считается более стабильной конформацией, чем лед I h , и поэтому он может образовываться на Земле. Однако трансформация происходит очень медленно. Согласно одному отчету, в условиях Антарктиды, по оценкам, для его образования без помощи катализаторов требуется не менее 100 000 лет. [ требуется ссылка ] Лед XI был найден в антарктическом льду, которому было около 100 лет в 1998 году. [152] Однако дальнейшее исследование в 2004 году не смогло воспроизвести это открытие после изучения антарктического льда, которому было около 3000 лет. [153] В исследовании Антарктиды 1998 года также утверждалось, что температура превращения (лед XI => лед I h ) составляет −36 °C (237 K), что намного выше температуры ожидаемой тройной точки, упомянутой выше (72 K, ~0 Па). Лед XI также был обнаружен в экспериментах с использованием чистой воды при очень низкой температуре (~10 K) и низком давлении — условиях, которые, как считается, присутствуют в верхних слоях атмосферы. [154] Недавно [ когда? ] было обнаружено, что небольшие домены льда XI образуются в чистой воде; его фазовый переход обратно в лед Ih произошел при 72 К в условиях гидростатического давления до 70 МПа. [155]
Аморфный лед используется в некоторых научных экспериментах, особенно в криоэлектронной микроскопии биомолекул. [156] Отдельные молекулы можно сохранить для визуализации в состоянии, близком к тому, в котором они находятся в жидкой воде.
Лед XVII может многократно адсорбировать и выделять молекулы водорода, не разрушая свою структуру. [77] Общее количество водорода, которое может адсорбировать лед XVII, зависит от величины приложенного давления, но молекулы водорода могут адсорбироваться льдом XVII даже при давлении всего в несколько миллибар [a] , если температура ниже 40 К (−233,2 °C; −387,7 °F). [77] Затем адсорбированные молекулы водорода могут быть освобождены или десорбированы посредством применения тепла. [157] Это было неожиданным свойством льда XVII, и могло бы позволить использовать его для хранения водорода , проблема, часто упоминаемая в экологических технологиях . [157]
Помимо хранения водорода посредством сжатия или сжижения , его также можно хранить в твердом веществе, либо посредством обратимого химического процесса ( хемосорбции ), либо посредством присоединения молекул водорода к веществу посредством силы Ван-дер-Ваальса ( физисорбции ). Последний процесс может происходить внутри льда XVII. [157] При физисорбции химическая реакция отсутствует, и химическая связь между двумя атомами внутри молекулы водорода остается нетронутой. Из-за этого количество циклов адсорбции-десорбции, которые может выдержать лед XVII, «теоретически бесконечно». [157]
Одним из существенных преимуществ использования льда XVII в качестве среды хранения водорода является низкая стоимость только двух используемых химических веществ: водорода и воды. [157] Кроме того, лед XVII продемонстрировал способность хранить водород при молярном соотношении H 2 к H 2 O выше 40%, что выше теоретического максимального соотношения для клатратных гидратов sII , еще одной потенциальной среды хранения. [77] Однако, если лед XVII используется в качестве среды хранения, его необходимо поддерживать при температуре 130 К (−143 °C; −226 °F), иначе он рискует дестабилизироваться. [157]
В открытом космосе гексагональный кристаллический лед (преобладающая форма, встречающаяся на Земле) встречается крайне редко. Известные примеры обычно связаны с вулканической деятельностью. [158] Вода в межзвездной среде вместо этого преобладает в виде аморфного льда, что делает ее, вероятно, наиболее распространенной формой воды во Вселенной. [159] [34]
Аморфный лед можно отделить от кристаллического льда на основе его ближнего инфракрасного и инфракрасного спектра. На ближних ИК-длинах волны характеристики линий поглощения воды 1,65, 3,1 и 4,53 мкм зависят от температуры льда и порядка кристаллов. [160] Пиковая сила полосы 1,65 мкм, а также структура полосы 3,1 мкм особенно полезны для определения кристалличности водяного льда. [161] [162]
На более длинных ИК-волнах аморфный и кристаллический лед имеют характерно разные полосы поглощения при 44 и 62 мкм, поскольку кристаллический лед имеет значительное поглощение при 62 мкм, а аморфный лед — нет. [163] Кроме того, эти полосы можно использовать в качестве индикатора температуры при очень низких температурах, когда другие индикаторы (такие как полосы 3,1 и 12 мкм) не работают. [164] Это полезно для изучения льда в межзвездной среде и околозвездных дисках. Однако наблюдение этих особенностей затруднено, поскольку атмосфера непрозрачна на этих длинах волн, что требует использования инфракрасных обсерваторий космического базирования.
В общем, аморфный лед может образовываться ниже ~130 К. [165] При этой температуре молекулы воды не способны образовывать кристаллическую структуру, обычно встречающуюся на Земле. Аморфный лед может также образовываться в самой холодной области атмосферы Земли, летней полярной мезосфере, где существуют серебристые облака . [166] Эти низкие температуры легко достигаются в астрофизических средах, таких как молекулярные облака, околозвездные диски и поверхности объектов во внешней Солнечной системе. В лаборатории аморфный лед превращается в кристаллический лед, если его нагреть выше 130 К, хотя точная температура этого превращения зависит от окружающей среды и условий роста льда. [167] Реакция необратима и экзотермична, выделяя 1,26–1,6 кДж/моль. [167]
Дополнительным фактором, определяющим структуру водяного льда, является скорость осаждения. Даже если достаточно холодно для образования аморфного льда, кристаллический лед будет образовываться, если поток водяного пара на субстрат меньше, чем зависящий от температуры критический поток. [168] Этот эффект важно учитывать в астрофизических средах, где поток воды может быть низким. И наоборот, аморфный лед может образовываться при температурах выше ожидаемых, если поток воды высок, например, при явлениях мгновенного замерзания, связанных с криовулканизмом .
При температурах ниже 77 К облучение ультрафиолетовыми фотонами, а также высокоэнергетическими электронами и ионами может повредить структуру кристаллического льда, превратив его в аморфный лед. [169] [163] Аморфный лед, по-видимому, не подвергается значительному воздействию радиации при температурах ниже 110 К, хотя некоторые эксперименты показывают, что радиация может понизить температуру, при которой аморфный лед начинает кристаллизоваться. [163]
Питер Дженнискенс и Дэвид Ф. Блейк продемонстрировали в 1994 году, что форма аморфного льда высокой плотности также создается во время осаждения паров воды на низкотемпературных (< 30 К) поверхностях, таких как межзвездные зерна. Молекулы воды не полностью выстраиваются, чтобы создать открытую клеточную структуру аморфного льда низкой плотности. Многие молекулы воды оказываются в интерстициальных положениях. При нагревании выше 30 К структура перестраивается и трансформируется в форму низкой плотности. [35] [41]
Молекулярные облака имеют чрезвычайно низкие температуры (~10 К), что хорошо соответствует режиму аморфного льда. Наличие аморфного льда в молекулярных облаках было подтверждено наблюдениями. [170] Когда молекулярные облака коллапсируют, образуя звезды, температура полученного околозвездного диска , как ожидается, не поднимется выше 120 К, что указывает на то, что большая часть льда должна оставаться в аморфном состоянии. [168] Однако, если температура поднимется достаточно высоко, чтобы сублимировать лед, то он может повторно сконденсироваться в кристаллическую форму, поскольку скорость потока воды настолько мала. Ожидается, что это будет иметь место в околозвездном диске IRAS 09371+1212, где были обнаружены признаки кристаллизованного льда, несмотря на низкую температуру 30–70 К. [171]
Для первичной солнечной туманности существует большая неопределенность относительно кристалличности водяного льда во время фаз формирования околозвездного диска и планеты. Если исходный аморфный лед пережил коллапс молекулярного облака, то он должен был сохраниться на гелиоцентрических расстояниях за пределами орбиты Сатурна (~12 а.е.). [168]
Возможность присутствия аморфного водяного льда в кометах и высвобождение энергии во время фазового перехода в кристаллическое состояние были впервые предложены в качестве механизма вспышек комет. [172] Доказательства наличия аморфного льда в кометах обнаружены в высоких уровнях активности, наблюдаемых в долгопериодических кометах, кометах семейства Центавра и Юпитера на гелиоцентрических расстояниях за пределами ~6 а.е. [173] Эти объекты слишком холодны для сублимации водяного льда, которая приводит к активности комет ближе к Солнцу, чтобы иметь большой эффект. Термодинамические модели показывают, что температура поверхности этих комет близка к температуре перехода аморфного/кристаллического льда ~130 К, что подтверждает это как вероятный источник активности. [174] Неконтролируемая кристаллизация аморфного льда может производить энергию, необходимую для питания вспышек, таких как те, которые наблюдались для кометы Центавра 29P/Швассмана–Вахмана 1. [175] [176]
При равновесных температурах излучения 40–50 К [177] ожидается, что объекты в поясе Койпера будут иметь аморфный водяной лед. Хотя водяной лед наблюдался на нескольких объектах, [178] [179] чрезвычайная слабость этих объектов затрудняет определение структуры льдов. Признаки кристаллического водяного льда наблюдались на 50000 Quaoar , возможно, из-за событий, связанных с выходом на поверхность, таких как удары или криовулканизм. [180]
Картографический спектрометр ближнего инфракрасного диапазона (NIMS) на космическом аппарате NASA Galileo спектроскопически картировал поверхностный лед спутников Юпитера Европы , Ганимеда и Каллисто . Температура этих лун колеблется от 90 до 160 К, [181] достаточно теплая, чтобы аморфный лед, как ожидается, кристаллизовался в относительно короткие сроки. Однако было обнаружено, что Европа имеет в основном аморфный лед, Ганимед имеет как аморфный, так и кристаллический лед, а Каллисто в основном кристаллический. [182] Считается, что это является результатом конкурирующих сил: термической кристаллизации аморфного льда против преобразования кристаллического в аморфный лед потоком заряженных частиц с Юпитера. Находясь ближе к Юпитеру, чем три других луны, Европа получает самый высокий уровень радиации и, таким образом, благодаря облучению имеет самый аморфный лед. Каллисто находится дальше всего от Юпитера, получая наименьший поток радиации и, следовательно, сохраняя свой кристаллический лед. Ганимед, который находится между ними, демонстрирует аморфный лед на высоких широтах и кристаллический лед на более низких широтах. Считается, что это является результатом внутреннего магнитного поля луны, которое направляет заряженные частицы на более высокие широты и защищает более низкие широты от облучения. [182] Внутри Ганимеда, вероятно, находится океан жидкой воды с десятками-сотнями километров льда V у его основания. [183]
Поверхностный лед спутника Сатурна Энцелада был нанесен на карту с помощью спектрометра визуального и инфракрасного картирования (VIMS) на космическом зонде NASA/ESA/ASI Cassini. Зонд обнаружил как кристаллический, так и аморфный лед с более высокой степенью кристалличности в трещинах « тигровых полос » на поверхности и большим количеством аморфного льда между этими областями. [160] Кристаллический лед около тигровых полос можно объяснить более высокими температурами, вызванными геологической активностью, которая является предполагаемой причиной трещин. Аморфный лед можно объяснить мгновенным замерзанием из-за криовулканизма, быстрой конденсацией молекул из водных гейзеров или облучением высокоэнергетическими частицами с Сатурна. [160] Аналогично, один из внутренних слоев Титана , как полагают, содержит лед VI. [184]
Аморфный лед средней плотности может присутствовать на Европе, поскольку экспериментальные условия его формирования, как ожидается, также будут там. Возможно, что уникальное свойство льда MDA выделять большое количество тепловой энергии после освобождения от сжатия может быть причиной «ледяных землетрясений» в толстых слоях льда. [21]
Поскольку лед XI теоретически может образовываться при низких давлениях при температурах от 50 до 70 К — температурах, присутствующих в астрофизических средах внешней солнечной системы и в постоянно затененных полярных кратерах на Луне и Меркурии. Лед XI легче всего образуется около 70 К — как это ни парадоксально, при более низких температурах его формирование занимает больше времени. Экстраполируя экспериментальные измерения, можно предположить, что для его образования потребуется ~50 лет при 70 К и ~300 миллионов лет при 50 К. [185] Предполагается, что он присутствует в таких местах, как верхние слои атмосферы Урана и Нептуна [106] и на Плутоне и Хароне . [185]
Лед VII может составлять дно океана Европы, а также экзопланет (таких как Авохали и Энайпоша ), которые в основном состоят из воды. [186] [187]
Небольшие домены льда XI могут существовать также в атмосферах Юпитера и Сатурна. [106] Тот факт, что небольшие домены льда XI могут существовать при температурах до 111 К, заставляет некоторых ученых предполагать, что он может быть довольно распространен в межзвездном пространстве, с небольшими «семенами зародышеобразования», распространяющимися в пространстве и преобразующими обычный лед, во многом похожими на легендарный лед-девять, упомянутый в « Колыбели для кошки» Воннегута . [106] [188] Возможные роли льда XI в межзвездном пространстве [185] [189] и формировании планет [190] были предметом нескольких исследовательских работ. Пока не будет получено наблюдательное подтверждение наличия льда XI в космическом пространстве, присутствие льда XI в космосе остается спорным из-за вышеупомянутой критики, высказанной Иитакой. [191] Инфракрасные спектры поглощения льда XI были изучены в 2009 году в рамках подготовки к поискам льда XI в космосе. [192]
Предполагается, что ледяные гигантские планеты Уран и Нептун содержат слой суперионной воды. [193] [129] [194] [130] Методы машинного обучения и свободной энергии предсказывают, что плотноупакованные суперионные фазы будут стабильными в широком диапазоне температур и давлений, а объемно-центрированная кубическая суперионная фаза будет кинетически предпочтительной, но стабильной в небольшом диапазоне параметров. [195] С другой стороны, есть также исследования, которые предполагают, что другие элементы, присутствующие внутри этих планет, в частности углерод , могут предотвратить образование суперионной воды. [196] [197]
{{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite web}}: CS1 maint: bot: original URL status unknown (link)[self-published source?]{{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link)