Ацетоуксусная кислота ( название IUPAC : 3-оксобутановая кислота , также известная как ацетонкарбоновая кислота или диауксусная кислота ) представляет собой органическое соединение с формулой CH 3 COCH 2 COOH. Это простейшая бета- кетокислота , и, как и другие представители этого класса, она нестабильна. Метиловые и этиловые эфиры, которые весьма стабильны, производятся в промышленных масштабах в качестве прекурсоров красителей. Ацетоуксусная кислота — слабая кислота . [3]
В типичных физиологических условиях ацетоуксусная кислота существует в виде сопряженного с ней основания — ацетоацетата :
Несвязанный ацетоацетат вырабатывается в основном митохондриями печени из его тиоэфира с коферментом А (КоА):
Сам ацетоацетат-КоА образуется тремя путями:
У млекопитающих ацетоацетат, вырабатываемый в печени (вместе с двумя другими « кетоновыми телами »), высвобождается в кровоток в качестве источника энергии в периоды голодания , физических упражнений или в результате сахарного диабета 1 типа . [5] Сначала к нему ферментативно переносится группа КоА от сукцинил-КоА , превращая ее обратно в ацетоацетил-КоА; Затем он расщепляется тиолазой на две молекулы ацетил-КоА, которые затем вступают в цикл лимонной кислоты . Сердечная мышца и кора почек предпочитают ацетоацетат глюкозе. Мозг использует ацетоацетат, когда уровень глюкозы низкий из-за голодания или диабета. [4] : 394
Ацетоуксусную кислоту можно получить гидролизом дикетена . Его эфиры получают аналогично реакциями дикетена со спиртами [3] , а ацетоуксусную кислоту можно получить гидролизом этих соединений. [6] Как правило, ацетоуксусная кислота образуется при 0 °C и немедленно используется на месте. [7]
Он разлагается с умеренной скоростью реакции на ацетон и диоксид углерода :
Кислотная форма имеет период полураспада 140 минут при 37 ° C в воде, тогда как основная форма (анион) имеет период полураспада 130 часов. То есть он реагирует примерно в 55 раз медленнее. [8] Соответствующее декарбоксилирование трифторацетоацетата используется для получения трифторацетона :
Это слабая кислота (как и большинство алкилкарбоновых кислот) с p K a 3,58.
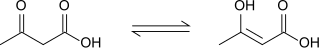
Ацетоуксусная кислота демонстрирует кето-еноловую таутомеризацию , при этом енольная форма частично стабилизируется за счет расширенной конъюгации и внутримолекулярных Н-связей . Равновесие сильно зависит от растворителя; при этом в полярных растворителях преобладает кето-форма (98% в воде), а в неполярных растворителях енольная форма составляет 25-49% вещества. [9]

Эфиры ацетоуксусной кислоты используются для реакции ацетоацетилирования , которая широко используется в производстве арилидных желтых и диарилидных красителей. [3] Хотя в этой реакции можно использовать сложные эфиры, дикетен также реагирует со спиртами и аминами с образованием соответствующих производных ацетоуксусной кислоты в процессе, называемом ацетоацетилированием . Примером может служить реакция с 4-аминоинданом : [ 10]
Ацетоуксусную кислоту измеряют в моче людей с диабетом для проверки на кетоацидоз [11] и для наблюдения за людьми, соблюдающими кетогенную или низкоуглеводную диету . [12] [13] Это делается с помощью щупов, покрытых нитропруссидом или аналогичными реагентами. Нитропруссид меняет цвет с розового на фиолетовый в присутствии ацетоацетата, сопряженного основания ацетоуксусной кислоты, причем изменение цвета можно оценить на глаз. Тест не измеряет β-гидроксибутират, самый распространенный кетон в организме; во время лечения кетоацидоза β-гидроксибутират превращается в ацетоацетат, поэтому тест бесполезен после начала лечения [11] и может быть ошибочно низким при постановке диагноза. [14]
Подобные тесты используются у молочных коров для проверки на кетоз . [15]