Перегруппировка Бекмана , названная в честь немецкого химика Эрнста Отто Бекмана (1853–1923), представляет собой перегруппировку функциональной группы оксима в замещенные амиды . [1] [2] Перегруппировка также была успешно выполнена на галоиминах и нитронах . Циклические оксимы и галоимины дают лактамы .
Перегруппировка Бекмана часто катализируется кислотой; однако, известно, что другие реагенты способствуют перегруппировке. К ним относятся тозилхлорид , тионилхлорид , пентахлорид фосфора , пентоксид фосфора , триэтиламин , гидроксид натрия , триметилсилилйодид и другие. [3] Фрагментация Бекмана — еще одна реакция, которая часто конкурирует с перегруппировкой, хотя тщательный выбор условий для промотирующего реагента и растворителя может способствовать образованию одного из них, а не другого, иногда давая почти исключительно один продукт. Перегруппировка происходит стереоспецифично для кетоксимов и N-хлор/N-фториминов, причем мигрирующая группа является антиперипланарной по отношению к уходящей группе на азоте. Известно, что определенные условия рацемизируют геометрию оксима, что приводит к образованию обоих региоизомеров . Перегруппировка альдоксимов происходит со стереоспецифичностью в газовой фазе и без стереоспецифичности в фазе раствора. Несколько методик допускают перегруппировку альдоксимов в первичные амиды, но в этих системах обычно конкурирует фрагментация. Перегруппировка нитрона также происходит без стереоспецифичности; образующийся региоизомер имеет амидный азот, замещенный группой, обладающей наибольшей миграционной способностью .

Архетипическая перегруппировка Бекмана [4] представляет собой превращение циклогексанона в капролактам через оксим. Капролактам является исходным сырьем в производстве нейлона 6. [5 ]
Раствор Бекмана состоит из уксусной кислоты , соляной кислоты и уксусного ангидрида и широко использовался для катализа перегруппировки. Другие кислоты, такие как серная кислота , полифосфорная кислота и фтористый водород , также использовались. Серная кислота является наиболее часто используемой кислотой для коммерческого производства лактама из-за образования побочного продукта сульфата аммония при нейтрализации аммиаком . Сульфат аммония является распространенным сельскохозяйственным удобрением, обеспечивающим азот и серу.
Наиболее распространенный механизм реакции перегруппировки Бекмана обычно состоит из алкильной миграции анти-перипланарно к вытеснению уходящей группы с образованием нитрилиевого иона . За этим следует сольволиз до имидата и затем таутомеризация до амида: [6]
Известно, что этот ион нитрилия перехватывается другими нуклеофилами, включая уходящую группу из оксима. [3]

Предположительно после того, как фенильная группа мигрирует и вытесняет цианат , последний затем атакует образовавшийся ион нитрилия. В четыреххлористом углероде изоцианат может быть выделен, тогда как в этаноле уретан образуется после сольволиза изоцианата.
Одно вычислительное исследование установило механизм, учитывающий молекулы растворителя и заместители. [7] Перегруппировка оксима ацетона в растворе Бекмана включала три молекулы уксусной кислоты и один протон (присутствующий в виде иона оксониума ). В переходном состоянии, приводящем к иону иминия (σ-комплекс), метильная группа мигрирует к атому азота в согласованной реакции , поскольку гидроксильная группа вытесняется. Атом кислорода в гидроксильной группе стабилизируется тремя молекулами уксусной кислоты. На следующем этапе электрофильный атом углерода в ионе нитрилия подвергается атаке воды, и протон отдается обратно уксусной кислоте. В переходном состоянии, приводящем к имидату, атом кислорода воды координируется с 4 другими атомами. На третьем этапе стадия изомеризации протонирует атом азота, приводя к амиду .
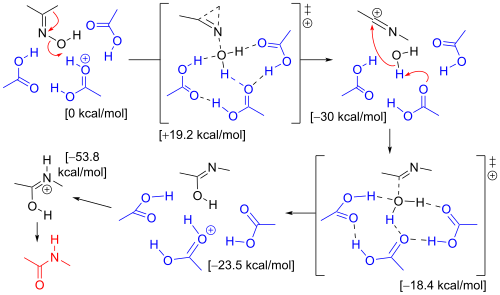
Тот же расчет с ионом гидроксония и 6 молекулами воды дает тот же результат, но когда мигрирующий заместитель является фенильной группой, механизм благоприятствует образованию промежуточного трехчленного π-комплекса. Этот π-комплекс не обнаружен в H 3 O + (H 2 O) 6 .

В случае циклогексаноноксима снятие напряжения кольца приводит к третьему механизму реакции, приводящему непосредственно к протонированному капролактаму в одну согласованную стадию без промежуточного образования π-комплекса или σ-комплекса.
Перегруппировка Бекмана может быть сделана каталитической с использованием цианурхлорида и хлорида цинка в качестве сокатализатора . Например, циклододеканон может быть преобразован в соответствующий лактам , мономер, используемый в производстве нейлона 12. [ 8] [9]
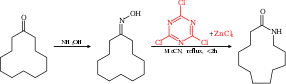
Механизм реакции для этой реакции основан на каталитическом цикле с цианурхлоридом, активирующим гидроксильную группу через нуклеофильное ароматическое замещение . Продукт реакции вытесняется и заменяется новым реагентом через промежуточный комплекс Мейзенгеймера .

Фрагментация Бекмана — это реакция, которая часто конкурирует с перегруппировкой Бекмана. [3] Когда группа α в оксиме способна стабилизировать образование карбокатиона , фрагментация становится жизнеспособным путем реакции. Реакция генерирует нитрил и карбокатион, который быстро перехватывается с образованием различных продуктов. Нитрил также может быть гидролизован в условиях реакции с образованием карбоновых кислот . Различные условия реакции могут благоприятствовать фрагментации по сравнению с перегруппировкой.

Четвертичные углеродные центры способствуют фрагментации, стабилизируя образование карбокатиона посредством гиперконъюгации . Как показано на рисунке выше, образуется «стабильный» карбокатион, который затем теряет водород, давая участок ненасыщенности . Атомы кислорода и азота также способствуют фрагментации посредством образования кетонов и иминов соответственно.

Сера также способна способствовать фрагментации, хотя и на более дальнем расстоянии, чем кислород или азот.

Кремний способен направлять фрагментацию посредством эффекта бета-кремния .
Промежуточный карбокатион в этой реакции перехватывается нуклеофильным фторидом из трифторида диэтиламиносеры ( DAST ): [10]
Оксим циклогексенона с кислотой образует анилин в реакции дегидратации – ароматизации , называемой реакцией Земмлера–Вольфа или ароматизацией Вольфа [11] [12] [13] [14]

Механизм можно проиллюстрировать следующим образом:

Реакция по сути является частным случаем перегруппировки Бекмана в сочетании с участием соседних групп .
Промышленный синтез парацетамола, разработанный Hoechst – Celanese, включает превращение метилкетона в ацетанилид посредством перегруппировки Бекмана. [15]
Термическая перегруппировка, происходящая при синтезе кетамина, была названа перегруппировкой Бекмана согласно: url.