Искусственная клетка , синтетическая клетка или минимальная клетка — это искусственно созданная частица, которая имитирует одну или несколько функций биологической клетки . Зачастую искусственные клетки представляют собой биологические или полимерные мембраны, содержащие биологически активные материалы. [1] Таким образом, липосомы , полимерсомы , наночастицы , микрокапсулы и ряд других частиц могут квалифицироваться как искусственные клетки.
Термины «искусственная клетка» и «синтетическая клетка» используются в самых разных областях и могут иметь разные значения, что также отражено в разных разделах этой статьи. Некоторые более строгие определения основаны на предположении, что термин «клетка» напрямую относится к биологическим клеткам и что эти структуры, следовательно, должны быть живыми (или частью живого организма) и, кроме того, что термин «искусственный» подразумевает, что эти структуры искусственно строятся снизу вверх, т.е. из базовых компонентов. Таким образом, в области синтетической биологии искусственную клетку можно понимать как полностью синтетически созданную клетку, которая может улавливать энергию , поддерживать ионные градиенты , содержать макромолекулы , а также хранить информацию и иметь способность к репликации . [2] Такого рода искусственная клетка еще не создана.
Однако в других случаях термин «искусственный» не подразумевает, что вся структура создана человеком, а вместо этого может относиться к идее о том, что определенные функции или структуры биологических клеток могут быть изменены, упрощены, заменены или дополнены с помощью синтетическая сущность.
В других областях термин «искусственная клетка» может относиться к любому компартменту, который чем-то напоминает биологическую клетку по размеру или структуре, но создан синтетически или даже полностью изготовлен из небиологических компонентов. Термин «искусственная клетка» также используется для структур прямого применения, таких как отсеки для доставки лекарств. Микроинкапсуляция обеспечивает метаболизм внутри мембраны, обмен малых молекул и предотвращение прохождения через нее крупных веществ. [3] [4] Основные преимущества инкапсуляции включают улучшение мимикрии в организме, повышение растворимости груза и снижение иммунных реакций . Примечательно, что искусственные клетки оказались клинически успешными при гемоперфузии . [5]
Немецкий патолог Рудольф Вирхов выдвинул идею, что жизнь не только возникает из клеток, но и каждая клетка происходит из другой клетки; « Все клетки и клетки ». [6] До сих пор большинство попыток создать искусственную клетку сводились только к созданию пакета, который может имитировать определенные задачи клетки. Достижения в области бесклеточных реакций транскрипции и трансляции позволяют экспрессировать многие гены , но эти усилия далеки от создания полностью работоспособной клетки.
Восходящий подход к созданию искусственной клетки предполагает создание протоклетки de novo , полностью из неживых материалов. Как следует из термина «клетка», одной из предпосылок является создание своего рода компартмента, который определяет индивидуальную клеточную единицу. Фосфолипидные мембраны являются очевидным выбором в качестве разделяющих границ [7] , поскольку они действуют как селективные барьеры во всех живых биологических клетках. Ученые могут инкапсулировать биомолекулы в фосфолипидные везикулы размером с клетку и тем самым наблюдать, как эти молекулы действуют так же, как и в биологических клетках, и тем самым воссоздают определенные клеточные функции. [8] Аналогичным образом функциональные биологические строительные блоки могут быть инкапсулированы в эти липидные компартменты для достижения синтеза (пусть и рудиментарных) искусственных клеток.
Предлагается создать фосфолипидный двухслойный везикулу с ДНК, способной к самовоспроизведению, используя синтетическую генетическую информацию. Тремя основными элементами таких искусственных клеток являются образование липидной мембраны , репликация ДНК и РНК посредством матричного процесса и сбор химической энергии для активного транспорта через мембрану. [9] [10] Основными препятствиями, которые предвидятся и с которыми приходится сталкиваться при создании этой предложенной протоклетки, являются создание минимальной синтетической ДНК, содержащей всю достаточную для жизни информацию, и воспроизводство негенетических компонентов, которые являются неотъемлемой частью клеточного развития, таких как молекулярное «я». -организация. [11] Однако есть надежда, что такой подход «снизу вверх» позволит лучше понять фундаментальные вопросы организации на клеточном уровне и происхождения биологической жизни. До сих пор не была синтезирована ни одна полностью искусственная клетка, способная к самовоспроизведению с использованием молекул жизни, и эта цель все еще находится в отдаленном будущем, хотя различные группы в настоящее время работают над достижением этой цели. [12]
Другой метод, предложенный для создания протоклетки, более близко напоминает условия, которые, как полагают, присутствовали во время эволюции, известные как «первичный суп». Различные полимеры РНК можно было бы инкапсулировать в везикулы, и при таких малых граничных условиях можно было бы проверять химические реакции. [13]
Исследования протоклеток вызвали разногласия и противоположные мнения, включая критику расплывчатого определения «искусственной жизни». [14] Создание базовой единицы жизни является наиболее насущной этической проблемой. [15] Наибольшее беспокойство по поводу протоклеток вызывает их потенциальная угроза здоровью человека и окружающей среде из-за неконтролируемой репликации. Однако искусственные клетки, созданные методом «сверху вниз», или любые другие манипулируемые формы существующих живых клеток, с гораздо большей вероятностью смогут существовать и размножаться за пределами лаборатории и, следовательно, представлять подобную угрозу.
В середине 2010-х годов исследовательское сообщество начало осознавать необходимость унификации области исследований синтетических клеток, признавая, что задача создания целого живого организма из неживых компонентов выходит за рамки ресурсов одной страны. [16]
В 2017 году было начато международное крупномасштабное исследовательское сотрудничество Build-a-Cell по созданию синтетических живых клеток, финансируемое NSF [17] . Build-a-Cell провела девять междисциплинарных семинаров, открытых для всех заинтересованных, для обсуждения и определения будущего сообщества синтетических клеток. За инициативой Build-a-Cell последовали национальные организации по производству синтетических клеток в ряде других стран. В число этих национальных организаций входят FabriCell, [18] MaxSynBio [19] и BaSyC. [20] Европейские усилия по созданию синтетических клеток были объединены в 2019 году в инициативу SynCellEU. [21]
Члены Института Дж. Крейга Вентера использовали нисходящий вычислительный подход, чтобы «выбить» гены в живом организме до минимального набора генов. [22] В 2010 году команде удалось создать реплицирующийся штамм (названный Mycoplasma Laboratorium ) Mycoplasma mycoides с использованием синтетически созданной ДНК, которая считается минимальным требованием для жизни и была вставлена в геномно пустую бактерию. [22] Есть надежда, что процесс нисходящего биосинтеза позволит внедрить новые гены, которые будут выполнять полезные функции, такие как выработка водорода в качестве топлива или улавливание избытка углекислого газа в атмосфере. [15] Множество регуляторных, метаболических и сигнальных сетей полностью не охарактеризованы. Эти нисходящие подходы имеют ограничения для понимания фундаментальной молекулярной регуляции, поскольку организмы-хозяева имеют сложный и не полностью определенный молекулярный состав. [23] В 2019 году была опубликована полная вычислительная модель всех путей в клетке Mycoplasma Syn3.0, представляющая собой первую полную модель in silico для живого минимального организма. [24]
Крупные инвестиции в биологию вложили такие крупные компании, как ExxonMobil , сотрудничающая с Synthetic Genomics Inc ; Собственная биосинтетическая компания Крейга Вентера занимается разработкой топлива из водорослей. [25]
По состоянию на 2016 год Mycoplasmagentium является единственным организмом, используемым в качестве отправной точки для создания минимальной клетки, поскольку он имеет наименьший известный геном, который можно культивировать в лабораторных условиях; сорт дикого типа имеет 482, и удаление ровно 100 генов, считающихся несущественными, привело к созданию жизнеспособного штамма с улучшенными темпами роста. Escherichia coli с уменьшенным геномом считается более полезной, и были разработаны жизнеспособные штаммы с удаленным 15% генома. [26] : 29–30
Была создана разновидность искусственной клетки, в которой полностью синтетический геном был введен в опустошенные клетки-хозяева. [22] Хоть и не полностью искусственная, поскольку цитоплазматические компоненты , а также мембрана клетки-хозяина сохраняются, сконструированная клетка находится под контролем синтетического генома и способна размножаться .
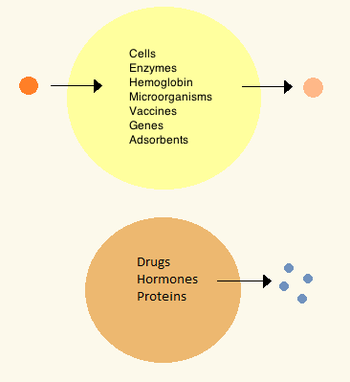
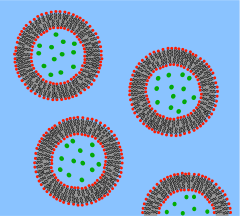
В 1960-х годах Томас Чанг разработал микрокапсулы, которые он позже назовет «искусственными клетками», поскольку они представляли собой отсеки размером с клетку, сделанные из искусственных материалов. [27] Эти клетки состояли из ультратонких мембран из нейлона, коллодия или сшитого белка, полупроницаемые свойства которых позволяли диффузию небольших молекул внутрь и наружу клетки. Эти клетки имели микронный размер и содержали клетки , ферменты , гемоглобин , магнитные материалы, адсорбенты и белки . [3]
Позже размеры искусственных клеток варьировались от сотен микрометров до нанометров и могли нести микроорганизмы, вакцины , гены , лекарства, гормоны и пептиды . [3] Первое клиническое применение искусственных клеток было при гемоперфузии путем инкапсуляции активированного угля . [28]
В 1970-х годах исследователи смогли ввести ферменты, белки и гормоны в биоразлагаемые микрокапсулы, что позже привело к клиническому использованию при таких заболеваниях, как синдром Леша-Нихана . [29] Хотя первоначальные исследования Чанга были сосредоточены на искусственных эритроцитах , только в середине 1990-х годов были разработаны биоразлагаемые искусственные эритроциты. [30] Искусственные клетки в инкапсуляции биологических клеток были впервые использованы в клинике в 1994 году для лечения пациентов с диабетом [31] и с тех пор другие типы клеток, такие как гепатоциты , взрослые стволовые клетки и генно-инженерные клетки, были инкапсулированы и находятся под контролем. исследование для использования в регенерации тканей. [32] [33]

Мембраны для искусственных клеток могут быть изготовлены из простых полимеров , сшитых белков, липидных мембран или полимер-липидных комплексов. Кроме того, можно сконструировать мембраны для представления поверхностных белков, таких как альбумин , антигены , носители Na/K-АТФазы , или пор, таких как ионные каналы . Обычно используемые материалы для производства мембран включают гидрогелевые полимеры, такие как альгинат , целлюлоза и термопластичные полимеры, такие как гидроксиэтилметакрилат-метилметакрилат (ГЕМА-ММА), полиакрилонитрил-поливинилхлорид (ПАН-ПВХ), а также варианты вышеуказанных материалов. упомянул. [4] Используемый материал определяет проницаемость клеточной мембраны, которая для полимера зависит от того, насколько важна адекватная диффузия питательных веществ, отходов и других важных молекул. Гидрофильные полимеры обладают потенциалом биосовместимости и могут быть изготовлены в различных формах, включая полимерные мицеллы , золь-гель смеси, физические смеси, а также сшитые частицы и наночастицы. [4] Особый интерес представляют чувствительные к раздражителям полимеры, которые реагируют на изменения pH или температуры для использования в адресной доставке. Эти полимеры можно вводить в жидкой форме посредством макроскопической инъекции и затвердевать или превращать в гель in situ из-за разницы в pH или температуре. Препараты наночастиц и липосом также обычно используются для инкапсуляции и доставки материалов. Основным преимуществом липосом является их способность сливаться с мембранами клеток и органелл .
Было разработано множество вариантов приготовления и инкапсуляции искусственных клеток. Обычно синтезируются везикулы, такие как наночастицы , полимерсомы или липосомы . Эмульсию обычно получают с использованием оборудования высокого давления, такого как гомогенизатор высокого давления или микрофлюидизатор. Ниже также описаны два метода микрокапсулирования нитроцеллюлозы.
В гомогенизаторе высокого давления две жидкости в суспензии масло/жидкость проталкиваются через небольшое отверстие под очень высоким давлением. Этот процесс разделяет продукты и позволяет создавать чрезвычайно мелкие частицы размером всего 1 нм.
В этом методе используется запатентованный микрофлюидизатор для получения большего количества гомогенных суспензий, которые могут создавать частицы меньшего размера, чем гомогенизаторы. Гомогенизатор сначала используется для создания грубой суспензии, которую затем закачивают в микрофлюидизатор под высоким давлением. Затем поток разделяется на два потока, которые будут реагировать с очень высокими скоростями в камере взаимодействия до тех пор, пока не будет получен желаемый размер частиц. [34] Этот метод позволяет осуществлять крупномасштабное производство фосфолипидных липосом и последующее наноинкапсулирование материалов.
В этом методе раствор клеток по каплям добавляют в коллодиевый раствор нитрата целлюлозы. Когда капля проходит через коллодий, она покрывается мембраной благодаря свойствам межфазной полимеризации коллодия. Позже клетка оседает в парафин, где закрепляется мембрана, которую затем суспендируют с помощью солевого раствора. Метод капли используется для создания крупных искусственных клеток, инкапсулирующих биологические клетки, стволовые клетки и генно-инженерные стволовые клетки.
Эмульсионный метод отличается тем, что инкапсулируемый материал обычно меньшего размера и помещается на дно реакционной камеры, куда сверху добавляется коллодий и центрифугируется или перемешивается иным образом для создания эмульсии. Инкапсулированный материал затем диспергируют и суспендируют в солевом растворе.
Искусственные клетки, используемые для доставки лекарств, отличаются от других искусственных клеток, поскольку их содержимое предназначено для диффундирования из мембраны или для поглощения и переваривания клеткой-мишенью-хозяином. Часто используются субмикронные искусственные клетки с липидными мембранами, которые можно называть нанокапсулами, наночастицами, полимерсомами или другими вариациями этого термина. [35]
Ферментная терапия активно изучается при генетических метаболических заболеваниях , при которых фермент чрезмерно или недостаточно экспрессируется, дефектен или вообще отсутствует. В случае недостаточной экспрессии или экспрессии дефектного фермента в организм вводится активная форма фермента для компенсации дефицита. С другой стороны, сверхэкспрессии ферментов можно противодействовать введением конкурирующего нефункционального фермента; то есть фермент, который превращает субстрат в неактивные продукты. Помещенные в искусственную клетку, ферменты могут выполнять свою функцию в течение гораздо более длительного периода по сравнению со свободными ферментами [3] и могут быть дополнительно оптимизированы путем конъюгации полимера. [36]
Первым ферментом, изученным при инкапсуляции искусственных клеток, была аспарагиназа для лечения лимфосаркомы у мышей. Такое лечение задержало появление и рост опухоли . [37] Эти первоначальные результаты привели к дальнейшим исследованиям по использованию искусственных клеток для доставки ферментов при тирозин- зависимых меланомах . [38] Рост этих опухолей в большей степени зависит от тирозина , чем нормальных клеток, и исследования показали, что снижение системного уровня тирозина у мышей может ингибировать рост меланомы. [39] Использование искусственных клеток для доставки тирозиназы ; и фермент, который переваривает тирозин, обеспечивает лучшую стабильность фермента и эффективен при удалении тирозина без серьезных побочных эффектов, связанных с недостатком тирозина в рационе. [40]
Ферментная терапия искусственными клетками также представляет интерес для активации пролекарств , таких как ифосфамид , при некоторых видах рака. Искусственные клетки, инкапсулирующие фермент цитохрома p450 , который превращает это пролекарство в активное лекарство, можно адаптировать для накопления в карциноме поджелудочной железы или имплантировать искусственные клетки близко к месту опухоли. Здесь локальная концентрация активированного ифосфамида будет намного выше, чем в остальной части организма, что предотвращает системную токсичность . [41] Лечение было успешным на животных [42] и показало удвоение средней выживаемости среди пациентов с поздней стадией рака поджелудочной железы в клинических исследованиях фазы I/II, а также утроение годовой выживаемости. [41]
При лечении генетических заболеваний целью генной терапии является вставка, изменение или удаление генов в клетках больного человека. Технология в значительной степени опирается на вирусные векторы , что вызывает опасения по поводу инсерционного мутагенеза и системного иммунного ответа , которые привели к гибели людей [43] [44] и развитию лейкемии [45] [46] в клинических испытаниях. Обход необходимости в векторах путем использования голой или плазмидной ДНК в качестве собственной системы доставки также сталкивается с такими проблемами, как низкая эффективность трансдукции и плохое нацеливание на ткани при системном введении. [4]
Искусственные клетки были предложены в качестве невирусного вектора, с помощью которого генетически модифицированные неаутологичные клетки инкапсулируются и имплантируются для доставки рекомбинантных белков in vivo . [47] Этот тип иммуноизоляции оказался эффективным на мышах благодаря доставке искусственных клеток, содержащих мышиный гормон роста , которые предотвратили задержку роста у мутантных мышей. [48] Несколько стратегий прошли клинические испытания на людях для лечения рака поджелудочной железы , бокового склероза и контроля боли. [4]
Первое клиническое применение искусственных клеток произошло при гемоперфузии путем инкапсуляции активированного угля . [28] Активированный уголь обладает способностью адсорбировать многие крупные молекулы и уже давно известен своей способностью удалять токсичные вещества из крови при случайном отравлении или передозировке. Однако перфузия посредством прямого введения угля токсична, поскольку приводит к эмболии и повреждению клеток крови с последующим удалением тромбоцитов. [49] Искусственные клетки позволяют токсинам диффундировать в клетку, сохраняя при этом опасный груз внутри своей ультратонкой мембраны. [28]
Искусственная клеточная гемоперфузия была предложена как менее затратный и более эффективный вариант детоксикации , чем гемодиализ [3] , при котором фильтрация крови происходит только за счет разделения размеров с помощью физической мембраны. При гемоперфузии тысячи адсорбирующих искусственных клеток удерживаются внутри небольшого контейнера за счет использования двух экранов на обоих концах, через которые перфузируется кровь пациента . По мере циркуляции крови токсины или лекарства диффундируют в клетки и удерживаются поглощающим материалом. Мембраны искусственных клеток намного тоньше тех, которые используются при диализе, а их небольшой размер означает, что они имеют большую площадь поверхности мембраны . Это означает, что часть клетки может иметь теоретический массоперенос, который в сто раз выше, чем у всей машины искусственной почки. [3] Устройство было признано рутинным клиническим методом для пациентов, лечившихся от случайного или суицидального отравления, но также было внедрено в качестве терапии при печеночной и почечной недостаточности , выполняя часть функций этих органов. [3] Гемоперфузия искусственных клеток также была предложена для использования в иммуноадсорбции, посредством которой антитела могут быть удалены из организма путем прикрепления иммуноадсорбирующего материала, такого как альбумин, к поверхности искусственных клеток. Этот принцип использовался для удаления антител группы крови из плазмы при трансплантации костного мозга [50] и для лечения гиперхолестеринемии с помощью моноклональных антител для удаления липопротеинов низкой плотности . [51] Гемоперфузия особенно полезна в странах со слабой промышленностью по производству гемодиализа, поскольку устройства там, как правило, дешевле и используются у пациентов с почечной недостаточностью .

Наиболее распространенным методом получения искусственных клеток является инкапсуляция клеток . Инкапсулированные клетки обычно достигаются путем создания капель контролируемого размера из жидкой клеточной суспензии , которые затем быстро затвердевают или гелеобразуют для обеспечения дополнительной стабильности. Стабилизация может быть достигнута за счет изменения температуры или за счет сшивки материала. [4] Микроокружение, в котором находится клетка, меняется при инкапсуляции. Обычно он переходит от монослоя к суспензии в полимерном каркасе внутри полимерной мембраны. Недостатком метода является то, что инкапсулирование клетки снижает ее жизнеспособность и способность к пролиферации и дифференцировке. [52] Кроме того, через некоторое время внутри микрокапсулы клетки образуют кластеры, которые подавляют обмен кислорода и метаболических отходов, [53] что приводит к апоптозу и некрозу , что ограничивает эффективность клеток и активирует иммунную систему хозяина . Искусственные клетки оказались успешными для трансплантации ряда клеток, включая островки Лангерганса для лечения диабета , [54] клетки паращитовидной железы и клетки коры надпочечников.
Нехватка донорских органов делает искусственные клетки ключевыми игроками в альтернативных методах лечения печеночной недостаточности . Использование искусственных клеток для трансплантации гепатоцитов продемонстрировало осуществимость и эффективность обеспечения функции печени на моделях заболеваний печени животных и биоискусственных устройствах печени . [55] Исследования возникли в результате экспериментов, в которых гепатоциты были прикреплены к поверхности микроносителей [56] и превратились в гепатоциты, которые инкапсулированы в трехмерную матрицу в микрокаплях альгината , покрытых внешней оболочкой из полилизина . Ключевым преимуществом этого метода доставки является отсутствие необходимости применения иммуносупрессивной терапии на время лечения. Инкапсуляции гепатоцитов были предложены для использования в биоискусственной печени . Устройство состоит из цилиндрической камеры, внутри которой находятся изолированные гепатоциты, через которые плазма пациента циркулирует экстракорпорально в виде гемоперфузии . Поскольку микрокапсулы имеют высокое соотношение площади поверхности к объему , они обеспечивают большую поверхность для диффузии субстрата и могут вместить большое количество гепатоцитов. Лечение мышей с индуцированной печеночной недостаточностью показало значительное увеличение выживаемости. [55] Системы искусственной печени все еще находятся на ранней стадии разработки, но демонстрируют потенциал для пациентов, ожидающих трансплантации органов , или пока собственная печень пациента регенерирует в достаточной степени, чтобы возобновить нормальное функционирование. На данный момент клинические испытания с использованием искусственных систем печени и трансплантации гепатоцитов при терминальных стадиях заболеваний печени показали улучшение показателей здоровья, но еще не улучшили выживаемость. [57] Короткая продолжительность жизни и агрегация искусственных гепатоцитов после трансплантации являются основными препятствиями, с которыми приходится сталкиваться. Гепатоциты, совместно инкапсулированные со стволовыми клетками, демонстрируют большую жизнеспособность в культуре и после имплантации [58] , а имплантация только искусственных стволовых клеток также показала регенерацию печени. [59] В связи с этим возник интерес к использованию стволовых клеток для инкапсуляции в регенеративной медицине .
Пероральный прием колоний живых бактериальных клеток был предложен и в настоящее время используется для модуляции микрофлоры кишечника , [60] профилактики диарейных заболеваний , [61] лечения инфекций H. pylori , атопических воспалений, [62] непереносимости лактозы [62 ]. 63] и иммунная модуляция , [64] среди других. Предлагаемый механизм действия не до конца понятен, но считается, что он имеет два основных эффекта. Во-первых, это питательный эффект, при котором бактерии конкурируют с бактериями, продуцирующими токсины. Второй — санитарный эффект, который стимулирует устойчивость к колонизации и стимулирует иммунный ответ . [4] Пероральная доставка бактериальных культур часто является проблемой, поскольку они подвергаются воздействию иммунной системы и часто разрушаются при пероральном приеме. Искусственные клетки помогают решить эти проблемы, обеспечивая мимикрию в организме и избирательное или долговременное высвобождение, тем самым увеличивая жизнеспособность бактерий, достигающих желудочно-кишечной системы . [4] Кроме того, можно спроектировать инкапсуляцию живых бактериальных клеток, позволяющую диффузию небольших молекул, включая пептиды, в организм в терапевтических целях. [4] Мембраны, доказавшие свою эффективность для доставки бактерий, включают ацетат целлюлозы и варианты альгината . [4] Дополнительные области применения, возникшие в результате инкапсуляции бактериальных клеток, включают защиту от заражения M. Tuberculosis [65] и активацию клеток, секретирующих Ig, со стороны иммунной системы. [66] Технология ограничена риском системных инфекций, неблагоприятной метаболической активности и риском переноса генов. [4] Однако более серьезной проблемой остается доставка достаточного количества жизнеспособных бактерий в интересующий участок. [4]
Наноразмерные переносчики кислорода используются как своего рода заменители эритроцитов , хотя в них отсутствуют другие компоненты эритроцитов. Они состоят из синтетической полимерсомы или искусственной мембраны, окружающей очищенный гемоглобин животного, человека или рекомбинантный гемоглобин . [67] В целом, доставка гемоглобина по-прежнему остается сложной задачей, поскольку он очень токсичен, если доставлен без каких-либо модификаций. В некоторых клинических исследованиях наблюдались вазопрессорные эффекты. [68] [69]
Исследовательский интерес к использованию искусственных клеток для получения крови возник после паники по поводу СПИДа в 1980-х годах. Помимо исключения возможности передачи заболеваний, искусственные эритроциты желательны, поскольку они устраняют недостатки, связанные с переливанием аллогенной крови, такие как тип крови, иммунные реакции и короткий срок хранения, составляющий 42 дня. Заменитель гемоглобина можно хранить при комнатной температуре, а не в холодильнике, более года. [3] Были предприняты попытки разработать полноценные рабочие эритроциты, которые содержат не только углеродный переносчик кислорода, но и ферменты, связанные с клеткой. Первая попытка была предпринята в 1957 году путем замены мембраны эритроцитов ультратонкой полимерной мембраной [70] , за которой последовала инкапсуляция через липидную мембрану [71] , а в последнее время – через биоразлагаемую полимерную мембрану. [3] Биологическую мембрану эритроцитов, включающую липиды и связанные с ними белки, также можно использовать для инкапсуляции наночастиц и увеличения времени пребывания in vivo за счет обхода поглощения макрофагов и системного клиренса. [72]
Лейкополимерсома — это полимерсома , обладающая адгезионными свойствами лейкоцита . [73] Полимерсомы представляют собой везикулы, состоящие из двухслойного листа, который может инкапсулировать множество активных молекул, таких как лекарства или ферменты . Придав адгезивные свойства лейкоцитам к их мембранам, можно заставить их замедляться или катиться вдоль эпителиальных стенок в быстро текущей кровеносной системе .
Концепция электронной искусственной клетки была расширена в серии из трех проектов ЕС, координируемых Джоном Маккаскиллом с 2004 по 2015 год.
Европейская комиссия спонсировала разработку программы Programmable Artificial Cell Evolution (PACE) [74] с 2004 по 2008 год, целью которой было заложить основу для создания «микроскопических самоорганизующихся, самовоспроизводящихся и эволюционирующих автономных объектов, построенных из простые органические и неорганические вещества, которые могут быть генетически запрограммированы для выполнения определенных функций» [74] для возможной интеграции в информационные системы. В рамках проекта PACE была разработана первая машина «Омега» — микрофлюидная система жизнеобеспечения искусственных клеток, которая могла бы дополнять химически недостающие функции (как первоначально предлагалось Норманом Паккардом, Стин Расмуссеном, Марком Бидау и Джоном Маккаскиллом). Конечная цель состояла в том, чтобы создать развивающуюся гибридную клетку в сложной программируемой микромасштабной среде. Затем функции Омега-машины можно было бы постепенно устранить, поставив перед химией искусственных клеток ряд разрешимых эволюционных проблем. В рамках проекта была достигнута химическая интеграция до уровня пар трех основных функций искусственных клеток (генетическая подсистема, система сдерживания и метаболическая система), а также созданы новые программируемые микрофлюидные среды с пространственным разрешением для интеграции сдерживания и генетической амплификации. [74] Проект привел к созданию Европейского центра живых технологий. [75]
После этого исследования в 2007 году Джон Маккаскилл предложил сосредоточиться на искусственной клетке с электронными дополнениями, названной «Электронная химическая ячейка». Ключевая идея заключалась в том, чтобы использовать массивно параллельный массив электродов, соединенных с локально выделенными электронными схемами, в двумерной тонкой пленке, чтобы дополнить новые химические клеточные функции. Локальная электронная информация, определяющая схемы переключения и считывания электродов, может служить электронным геномом, дополняя молекулярную последовательную информацию в новых протоколах. Предложение об исследовании было успешно одобрено Европейской комиссией , и международная группа ученых, частично совпадающая с консорциумом ПАСЕ, начала в 2008–2012 годах работу над проектом «Электронные химические клетки». Проект продемонстрировал, среди прочего, что локальный транспорт определенных последовательностей с электронным управлением может использоваться в качестве искусственной системы пространственного контроля для генетической пролиферации будущих искусственных клеток, и что основные процессы метаболизма могут осуществляться с помощью электродных матриц с соответствующим покрытием.
Основным ограничением этого подхода, помимо первоначальных трудностей в освоении микромасштабной электрохимии и электрокинетики, является то, что электронная система взаимосвязана как жесткая неавтономная часть макроскопического оборудования. В 2011 году Маккаскилл предложил инвертировать геометрию электроники и химии: вместо помещения химических веществ в активную электронную среду поместить микроскопическую автономную электронику в химическую среду. Он организовал проект по созданию третьего поколения электронных искусственных клеток размером 100 мкм, которые могли бы самособираться из двух «таблеток» полуэлементов, заключая в себе внутреннее химическое пространство, и функционировать с помощью активной электроники, питаемой от среды. они погружены в воду. Такие клетки могут копировать как свое электронное, так и химическое содержимое и будут способны к эволюции в пределах ограничений, обеспечиваемых их специальными предварительно синтезированными микроскопическими строительными блоками. В сентябре 2012 года работа над этим проектом началась. [76]
Ведутся исследования и разработки в области физических искусственных нейронов – органических и неорганических.
Например, некоторые искусственные нейроны могут получать [77] [78] и выделять дофамин ( химические сигналы , а не электрические сигналы) и взаимодействовать с естественными клетками мышц и мозга крысы , что потенциально может быть использовано в BCI / протезировании . [79] [80]
Биосовместимые мемристоры малой мощности могут позволить создавать искусственные нейроны, которые функционируют при напряжениях биологических потенциалов действия и могут использоваться для непосредственной обработки биосенсорных сигналов , нейроморфных вычислений и/или прямой связи с биологическими нейронами . [81] [82] [83]
Органические нейроморфные схемы, изготовленные из полимеров и покрытые гелем, богатым ионами, позволяющим материалу переносить электрический заряд, как настоящие нейроны , были встроены в робота, что позволяет ему обучаться сенсомоторно в реальном мире, а не посредством моделирования или практически. [84] [85] Более того, искусственные шиповые нейроны, изготовленные из мягкой материи (полимеров), могут работать в биологически значимых средах и обеспечивать синергетическую связь между искусственными и биологическими доменами. [86] [87]Протоклетки Дживану представляют собой синтетические химические частицы, которые обладают клеточной структурой и, по-видимому, обладают некоторыми функциональными живыми свойствами. [88] Впервые синтезированный в 1963 году из простых минералов и основной органики под воздействием солнечного света , до сих пор сообщается, что он обладает некоторыми метаболическими способностями, наличием полупроницаемой мембраны , аминокислот , фосфолипидов , углеводов и РНК-подобных молекул. [88] Однако природа и свойства Дживану еще предстоит выяснить. [88] [89]