
Кислота Льюиса (названная в честь американского физико-химика Гилберта Н. Льюиса ) представляет собой химическую разновидность, содержащую пустую орбиталь , которая способна принимать электронную пару от основания Льюиса с образованием аддукта Льюиса . Таким образом, основание Льюиса — это любой вид, который имеет заполненную орбиталь, содержащую электронную пару, которая не участвует в связывании , но может образовывать дативную связь с кислотой Льюиса с образованием аддукта Льюиса. Например, NH 3 является основанием Льюиса, поскольку может отдавать свою неподеленную пару электронов. Триметилборан ( ) является кислотой Льюиса, поскольку способен присоединять неподеленную пару. В аддукте Льюиса кислота и основание Льюиса имеют общую электронную пару, обеспечиваемую основанием Льюиса, образуя дативную связь. [1] В контексте специфической химической реакции между NH 3 и Me 3 B неподеленная пара NH 3 образует дативную связь с пустой орбиталью Me 3 B с образованием аддукта NH 3 •BMe 3 . Терминология относится к вкладу Гилберта Н. Льюиса . [2]
Термины нуклеофил и электрофил иногда взаимозаменяемы с основанием Льюиса и кислотой Льюиса соответственно. Эти термины, особенно их абстрактные существительные формы нуклеофильность и электрофильность , подчеркивают кинетический аспект реакционной способности, в то время как основность Льюиса и кислотность Льюиса подчеркивают термодинамический аспект образования аддукта Льюиса. [3]
Во многих случаях взаимодействие между основанием Льюиса и кислотой Льюиса в комплексе обозначается стрелкой, указывающей основание Льюиса, отдающее электроны кислоте Льюиса, с использованием обозначения дативной связи — например, Me 3 B ← NH 3 . В некоторых источниках основание Льюиса указывается парой точек (явно отданные электроны), что позволяет последовательно представить переход от самого основания к комплексу с кислотой:
Центральную точку также можно использовать для обозначения аддукта Льюиса, такого как Me 3 B·NH 3 . Другим примером является диэтилэфират трифторида бора , BF 3 · Et 2 O. В немного другом использовании центральная точка также используется для обозначения координации гидратов в различных кристаллах, как в MgSO 4 ·7H 2 O для гидратированного сульфата магния , независимо от того, образует ли вода дативную связь с металлом.
Хотя были попытки использовать вычислительные и экспериментальные энергетические критерии, чтобы отличить дативную связь от недативной ковалентной связи, [4] по большей части, это различие просто отмечает источник электронной пары и дативных связей, когда-то образовавшихся. , ведут себя так же, как и другие ковалентные связи, хотя обычно они имеют значительный полярный характер. Более того, в некоторых случаях (например, сульфоксиды и аминооксиды как R 2 S → O и R 3 N → O ) использование дативной стрелки связи является просто удобством обозначений, позволяющим избежать предъявления формальных обвинений. Однако в целом донорно-акцепторная связь рассматривается как нечто среднее между идеализированной ковалентной связью и ионной связью . [5]

Кислоты Льюиса разнообразны, и этот термин используется широко. Простейшими являются те, которые реагируют непосредственно с основанием Льюиса, например тригалогениды бора и пентагалогениды фосфора, мышьяка и сурьмы.
В том же духе CH 3 + можно рассматривать как кислоту Льюиса в реакциях метилирования. Однако метил-катион никогда не встречается в свободном виде в конденсированной фазе, а реакции метилирования реагентами типа CH 3 I протекают посредством одновременного образования связи нуклеофила с углеродом и разрыва связи между углеродом и йодом ( S N 2 реакция). Учебники по этому поводу расходятся во мнениях: одни утверждают, что алкилгалогениды являются электрофилами, а не кислоты Льюиса, [6] тогда как другие описывают алкилгалогениды (например, CH 3 Br) как разновидность кислоты Льюиса. [7] IUPAC утверждает, что кислоты Льюиса и основания Льюиса реагируют с образованием аддуктов Льюиса, [ 1] и определяет электрофилы как кислоты Льюиса. [8]
Некоторыми из наиболее изученных примеров таких кислот Льюиса являются тригалогениды бора и органобораны : [9]
В этом аддукте все четыре фторидных центра (точнее, лиганды ) эквивалентны.
И BF 4 -, и BF 3 OMe 2 представляют собой аддукты основания Льюиса с трифторидом бора.
Многие аддукты нарушают правило октетов , например, трииодид- анион:
Изменчивость окраски растворов йода отражает переменную способность растворителя образовывать аддукты с кислотой Льюиса I 2 .
Некоторые кислоты Льюиса связываются с двумя основаниями Льюиса, известным примером является образование гексафторосиликата :
Большинство соединений, считающихся кислотами Льюиса, требуют стадии активации перед образованием аддукта с основанием Льюиса. Комплексные соединения, такие как Et 3 Al 2 Cl 3 и AlCl 3 , рассматриваются как тригональные плоские кислоты Льюиса, но существуют в виде агрегатов и полимеров, которые должны разлагаться под действием основания Льюиса. [10] Более простой случай – образование аддуктов борана. Мономерного BH 3 в заметном количестве не существует, поэтому аддукты борана образуются при деградации диборана:
В этом случае можно выделить интермедиат B 2 H 7 − .
Многие комплексы металлов служат кислотами Льюиса, но обычно только после диссоциации более слабо связанного основания Льюиса, часто воды.
Протон (H + ) [11] — одна из самых сильных, но также и одна из самых сложных кислот Льюиса. Принято игнорировать тот факт, что протон сильно сольватирован (связан с растворителем). Учитывая это упрощение, кислотно-основные реакции можно рассматривать как образование аддуктов:
Типичным примером действия кислоты Льюиса является реакция алкилирования Фриделя-Крафтса . [5] Ключевым шагом является принятие AlCl 3 неподеленной пары хлорид-иона, образуя AlCl 4 - и создавая сильнокислотный, то есть электрофильный ион карбония.
Основание Льюиса — это атомная или молекулярная разновидность, у которой высшая занятая молекулярная орбиталь (ВЗМО) сильно локализована. Типичными основаниями Льюиса являются обычные амины , такие как аммиак и алкиламины . Другие распространенные основания Льюиса включают пиридин и его производные. Некоторые из основных классов оснований Льюиса:
Наиболее распространенными основаниями Льюиса являются анионы. Сила основности Льюиса коррелирует с pK исходной кислоты: кислоты с высоким pK a дают хорошие основания Льюиса. Как обычно, более слабая кислота имеет более сильное сопряженное основание .
Силу оснований Льюиса оценивали для различных кислот Льюиса, таких как I 2 , SbCl 5 и BF 3 . [12]
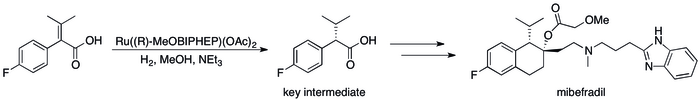
Почти все доноры электронных пар, образующие соединения путем связывания переходных элементов, можно рассматривать как лиганды . Таким образом, основания Льюиса широко применяются для изменения активности и селективности металлических катализаторов . Хиральные основания Льюиса, обычно мультидентатные , придают катализатору хиральность , обеспечивая асимметричный катализ , который полезен для производства фармацевтических препаратов . Например, в промышленном синтезе антигипертензивного препарата мибефрадил используется хиральное основание Льюиса ( R -MeOBIPHEP). [13]
Кислоты и основания Льюиса обычно классифицируются в зависимости от их твердости или мягкости. В этом контексте «жесткий» подразумевает маленькие и неполяризуемые, а «мягкий» указывает на более крупные атомы, которые более поляризуемы.
Например, амин вытеснит фосфин из аддукта с кислотой BF 3 . Таким же образом можно классифицировать базы. Например, основания, отдающие неподеленную пару от атома кислорода, более твердые, чем основания, отдающие неподеленную пару от атома азота. Хотя классификация так и не была определена количественно, она оказалась очень полезной для прогнозирования силы образования аддукта с использованием ключевых концепций, согласно которым взаимодействия твердая кислота-жесткое основание и мягкая кислота-мягкое основание сильнее, чем взаимодействия твердая кислота-мягкое основание или мягкая кислота-жесткое основание. базовые взаимодействия. Более позднее исследование термодинамики взаимодействия показало, что взаимодействия «жесткий-твердый» предпочтительнее с точки зрения энтальпии , тогда как «мягкий-мягкий» - с точки зрения энтропии . [ нужна цитата ]
Было разработано множество методов для оценки и прогнозирования кислотности Льюиса. Многие из них основаны на спектроскопических признаках, таких как сдвиги сигналов ЯМР или ИК-диапазонов, например, метод Гутмана-Беккета и метод Чайлдса [14] .
Модель ECW представляет собой количественную модель, которая описывает и прогнозирует силу кислотно-основных взаимодействий Льюиса, -ΔH. Модель присвоила параметры E и C многим кислотам и основаниям Льюиса. Каждая кислота характеризуется E A и CA. Каждое основание также характеризуется своими собственными E B и C B . Параметры E и C относятся соответственно к электростатическому и ковалентному вкладу в прочность связей, которые образуют кислота и основание. Уравнение
Термин W представляет собой постоянный вклад энергии в кислотно-основную реакцию, такую как расщепление димерной кислоты или основания. Уравнение предсказывает изменение силы кислот и оснований. Графическое представление уравнения показывает, что не существует единого порядка силы оснований Льюиса или силы кислоты Льюиса. [15] [16] и что шкалы отдельных свойств ограничены меньшим диапазоном кислот или оснований.

Эта концепция возникла у Гилберта Н. Льюиса , который изучал химическую связь . В 1923 году Льюис написал : «Кислотное вещество — это вещество, которое может использовать неподеленную пару электронов другой молекулы для формирования стабильной группы одного из своих собственных атомов». [2] [17] В том же году была опубликована кислотно-основная теория Брёнстеда -Лоури . Эти две теории различны, но дополняют друг друга. Основание Льюиса также является основанием Бренстеда-Лоури, но кислота Льюиса не обязательно должна быть кислотой Бренстеда-Лоури. Классификация на жесткие и мягкие кислоты и основания ( теория HSAB ) последовала в 1963 году. Сила кислотно-основных взаимодействий Льюиса, измеряемая стандартной энтальпией образования аддукта, может быть предсказана с помощью двухпараметрического уравнения Драго-Вейланда.
В 1916 году Льюис предположил, что два атома удерживаются вместе в химической связи за счет общей пары электронов. [18] Когда каждый атом вносит в связь один электрон, такая связь называется ковалентной . Когда оба электрона исходят от одного из атомов, это называется дативной ковалентной связью или координатной связью . Различие не очень четкое. Например, при образовании иона аммония из аммиака и водорода молекула аммиака отдает протону пару электронов ; [11] в образующемся ионе аммония теряется идентичность электронов . Тем не менее Льюис предложил классифицировать донор электронной пары как основание, а акцептор электронной пары - как кислоту.
Более современное определение кислоты Льюиса — это атомная или молекулярная разновидность с локализованной пустой атомной или молекулярной орбиталью низкой энергии. Эта молекулярная орбиталь с самой низкой энергией ( LUMO ) может вместить пару электронов.
Основание Льюиса часто является основанием Бренстеда-Лоури, поскольку оно может отдавать пару электронов H + ; [11] Протон является кислотой Льюиса, поскольку он может принимать пару электронов. Сопряженное основание кислоты Бренстеда-Лоури также является основанием Льюиса, поскольку потеря H + из кислоты оставляет те электроны, которые использовались для связи A-H, в виде неподеленной пары на сопряженном основании. Однако основание Льюиса может быть очень трудно протонировать , но все же вступать в реакцию с кислотой Льюиса. Например, окись углерода является очень слабым основанием Бренстеда-Лоури, но образует сильный аддукт с BF 3 .
В другом сравнении кислотности Льюиса и Бренстеда-Лоури, проведенном Брауном и Каннером, [19] 2,6-ди -т -бутилпиридин реагирует с образованием гидрохлоридной соли с HCl, но не реагирует с BF 3 . Этот пример демонстрирует, что стерические факторы, помимо факторов электронной конфигурации, играют роль в определении силы взаимодействия между объемистым ди-т- бутилпиридином и крошечным протоном.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )