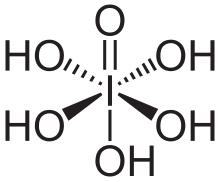
Периодическая кислота-Шифф ( PAS ) — это метод окрашивания, используемый для обнаружения полисахаридов, таких как гликоген , и слизистых веществ, таких как гликопротеины , гликолипиды и муцины в тканях. Реакция периодической кислоты окисляет вицинальные диолы в этих сахарах , обычно разрывая связь между двумя соседними атомами углерода, не участвующими в гликозидной связи или замыкании кольца в кольце моносахаридных единиц, которые являются частями длинных полисахаридов, и создавая пару альдегидов на двух свободных концах каждого разорванного моносахаридного кольца. Условия окисления должны быть достаточно отрегулированы, чтобы не окислять альдегиды дальше. Затем эти альдегиды реагируют с реагентом Шиффа , давая пурпурно-малиновый цвет. Подходящий основной краситель часто используется в качестве контрастного .
• Окраска PAS-диастазой (PAS-D) — это окраска PAS, используемая в сочетании с диастазой , ферментом , расщепляющим гликоген.
• Альциановый синий/йодная кислота–Шифф (AB/PAS или AB-PAS) использует альциановый синий перед этапом PAS.
_PAS_stain.jpg/440px-Gastric_signet_ring_cell_carcinoma_histopatholgy_(2)_PAS_stain.jpg)
_PAS_stain.jpg/440px-Esophageal_candidiasis_(2)_PAS_stain.jpg)

Окрашивание PAS в основном используется для окрашивания структур, содержащих высокую долю углеводных макромолекул ( гликоген , гликопротеин , протеогликаны ), обычно встречающихся, например, в соединительных тканях , слизи , гликокаликсе и базальных пластинках .
Окрашивание PAS может использоваться для диагностики ряда заболеваний:
Наличие гликогена можно подтвердить на участке ткани, используя диастазу для переваривания гликогена из участка, а затем сравнивая переваренный диастазой участок PAS с нормальным участком PAS. Диастаза-отрицательный слайд покажет пурпурное окрашивание там, где присутствует гликоген в участке ткани. Слайд, обработанный диастазой, не будет иметь никакого положительного окрашивания PAS в этих местах на слайде
Окрашивание PAS также используется для окрашивания целлюлозы . Одним из примеров может быть поиск имплантированных медицинских устройств, состоящих из неокисленной целлюлозы.
Если окрашивание PAS будет проводиться на ткани, рекомендуемым фиксатором является 10%-ный нейтральный буферный формалин или раствор Буэна . Для мазков крови рекомендуемым фиксатором является метанол . Глутаральдегид не рекомендуется, поскольку свободные альдегидные группы могут реагировать с реагентом Шиффа , что может привести к ложноположительному окрашиванию. [4]