Т-клетки являются одним из важных типов белых кровяных клеток иммунной системы и играют центральную роль в адаптивном иммунном ответе . Т-клетки можно отличить от других лимфоцитов по наличию Т-клеточного рецептора (TCR) на их клеточной поверхности .
Т-клетки рождаются из гемопоэтических стволовых клеток , [1] находящихся в костном мозге . Развивающиеся Т-клетки затем мигрируют в вилочковую железу для развития (или созревания). Т-клетки получили свое название от тимуса . [2] [3] После миграции в тимус клетки-предшественники созревают в несколько различных типов Т-клеток. Дифференциация Т-клеток продолжается и после того, как они покидают тимус. Группы специфических, дифференцированных подтипов Т-клеток выполняют ряд важных функций в контроле и формировании иммунного ответа .
Одной из этих функций является иммуноопосредованная гибель клеток, и она осуществляется двумя основными подтипами: CD8 + «киллерные» (цитотоксические) и CD4 + «хелперные» Т-клетки. (Они названы так из-за наличия белков клеточной поверхности CD8 или CD4 .) CD8 + Т-клетки, также известные как «киллерные Т-клетки», являются цитотоксическими — это означает, что они способны напрямую убивать инфицированные вирусом клетки, а также раковые клетки. CD8 + Т-клетки также способны использовать небольшие сигнальные белки, известные как цитокины , для привлечения других типов клеток при установке иммунного ответа. Другая популяция Т-клеток, CD4 + Т-клетки, функционируют как «хелперные клетки». В отличие от CD8 + киллерных Т-клеток, CD4 + хелперные Т-клетки (TH ) функционируют путем дальнейшей активации В-клеток памяти и цитотоксических Т-клеток, что приводит к более сильному иммунному ответу. Специфический адаптивный иммунный ответ, регулируемый Т- клеткой , зависит от ее подтипа (например, Т-хелпер 1, Т-хелпер 2, Т-хелпер 17, регуляторная Т-клетка) [4] , который отличается типами цитокинов, которые они секретируют. [2]
Регуляторные Т-клетки — это еще одна особая популяция Т-клеток, которая обеспечивает критический механизм толерантности , посредством которого иммунные клетки способны отличать вторгающиеся клетки от «своих». Это предотвращает ненадлежащую реакцию иммунных клеток против собственных клеток, известную как « аутоиммунный » ответ. По этой причине эти регуляторные Т-клетки также называют «супрессорными» Т-клетками. Эти же регуляторные Т-клетки могут также кооптироваться раковыми клетками для предотвращения распознавания опухолевых клеток и иммунного ответа против них.
Все Т-клетки происходят из c-kit + Sca1 + гемопоэтических стволовых клеток (HSC), которые находятся в костном мозге. В некоторых случаях источником может быть печень плода во время эмбрионального развития . Затем HSC дифференцируются в мультипотентные предшественники (MPP), которые сохраняют потенциал стать как миелоидными , так и лимфоидными клетками . Затем процесс дифференциации переходит к общему лимфоидному предшественнику (CLP), который может дифференцироваться только в клетки T, B или NK. [5] Затем эти клетки CLP мигрируют через кровь в тимус, где они приживаются:. Отныне они известны как тимоциты , незрелая стадия Т-клетки.
Самые ранние клетки, которые прибыли в тимус, обычно называются двойными отрицательными , поскольку они не экспрессируют ни корецептор CD4 , ни корецептор CD8 . Вновь прибывшие клетки CLP являются клетками CD4 − CD8 − CD44 + CD25 − ckit + и называются ранними клетками-предшественниками тимуса (ETP). [6] Эти клетки затем пройдут раунд деления и подавят c-kit и называются двойными отрицательными клетками (DN1). Чтобы стать Т-клетками, тимоциты должны пройти несколько стадий DN, а также положительный и отрицательный отбор.
Двойные негативные тимоциты можно идентифицировать по поверхностной экспрессии CD2 , CD5 и CD7 . Тем не менее, во время двойных негативных стадий экспрессия CD34 прекращается и экспрессируется CD1 . Экспрессия как CD4, так и CD8 делает их двойными позитивными и созревает либо в клетки CD4 + , либо в клетки CD8 + .
Критический шаг в созревании Т-клеток — создание функционального рецептора Т-клеток (TCR). Каждая зрелая Т-клетка в конечном итоге будет содержать уникальный TCR, который реагирует на случайный шаблон, позволяя иммунной системе распознавать множество различных типов патогенов . Этот процесс имеет важное значение для развития иммунитета к угрозам, с которыми иммунная система ранее не сталкивалась, поскольку из-за случайных вариаций всегда будет как минимум один TCR, соответствующий любому новому патогену.
Тимоцит может стать активной Т-клеткой только тогда, когда он переживет процесс развития функционального TCR. TCR состоит из двух основных компонентов, альфа- и бета-цепей. Они оба содержат случайные элементы, предназначенные для создания большого разнообразия различных TCR, но из-за этого огромного разнообразия их необходимо протестировать, чтобы убедиться, что они вообще работают. Сначала тимоциты пытаются создать функциональную бета-цепь, проверяя ее против «фиктивной» альфа-цепи. Затем они пытаются создать функциональную альфа-цепь. После того, как будет создан работающий TCR, клетки должны проверить, будет ли их TCR правильно определять угрозы, и для этого необходимо распознать главный комплекс гистосовместимости организма (MHC) в процессе, известном как положительный отбор. Тимоцит также должен гарантировать, что он не будет негативно реагировать на «собственные» антигены , что называется отрицательным отбором. Если и положительный, и отрицательный отбор успешны, TCR становится полностью работоспособным, и тимоцит становится Т-клеткой.
На стадии DN2 (CD44 + CD25 + ) клетки повышают регуляцию генов рекомбинации RAG1 и RAG2 и перестраивают локус TCRβ , объединяя гены рекомбинации VDJ и константной области в попытке создать функциональную цепь TCRβ. По мере того, как развивающийся тимоцит переходит к стадии DN3 (CD44 − CD25 + ), тимоцит экспрессирует инвариантную α-цепь, называемую pre-Tα, наряду с геном TCRβ. Если перестроенная β-цепь успешно спаривается с инвариантной α-цепью, вырабатываются сигналы, которые прекращают перестройку β-цепи (и заглушают альтернативный аллель). [7] Хотя эти сигналы требуют pre-TCR на поверхности клетки, они не зависят от связывания лиганда с pre-TCR. Если цепи успешно спариваются, формируется пре-TCR, и клетка подавляет CD25 и называется клеткой DN4 (CD25 − CD44 − ). Затем эти клетки проходят раунд пролиферации и начинают перестраивать локус TCRα во время двойной положительной стадии.
Процесс позитивного отбора занимает от 3 до 4 дней и происходит в коре тимуса. [8] Двойные положительные тимоциты (CD4 + /CD8 + ) мигрируют глубоко в кору тимуса , где они представлены аутоантигенами . Эти аутоантигены экспрессируются эпителиальными клетками коры тимуса на молекулах MHC, которые находятся на поверхности эпителиальных клеток коры. Только тимоциты, которые хорошо взаимодействуют с MHC-I или MHC-II, получат жизненно важный «сигнал выживания», в то время как те, которые не могут взаимодействовать достаточно сильно, не получат сигнала и умрут от пренебрежения . Этот процесс гарантирует, что выжившие тимоциты будут иметь «сродство к MHC», что означает, что они будут демонстрировать более сильное сродство связывания со специфическими аллелями MHC в этом организме. [9] Подавляющее большинство развивающихся тимоцитов не пройдут позитивный отбор и умрут во время этого процесса. [10]
Судьба тимоцита определяется во время позитивного отбора. Двойные положительные клетки (CD4 + /CD8 + ), которые хорошо взаимодействуют с молекулами MHC класса II, в конечном итоге станут клетками-«помощниками» CD4 + , тогда как тимоциты, которые хорошо взаимодействуют с молекулами MHC класса I, созревают в клетки-«киллеры» CD8 + . Тимоцит становится клеткой CD4 + путем подавления экспрессии рецепторов на поверхности клеток CD8. Если клетка не теряет свой сигнал, она продолжит подавлять CD8 и станет CD4 + , и клетки CD8 + и CD4 + теперь являются одиночными положительными клетками. [11]
Этот процесс не фильтрует тимоциты, которые могут вызывать аутоиммунитет . Потенциально аутоиммунные клетки удаляются следующим процессом отрицательного отбора, который происходит в мозговом веществе тимуса.
Отрицательный отбор удаляет тимоциты, которые способны прочно связываться с «собственными» молекулами MHC. Тимоциты, которые выживают после положительного отбора, мигрируют к границе коркового и мозгового вещества в тимусе. Находясь в мозговом веществе, они снова сталкиваются с собственным антигеном, представленным на комплексе MHC мозговых эпителиальных клеток тимуса (mTEC). [12] mTEC должны быть положительными по аутоиммунным регуляторам (AIRE + ), чтобы должным образом экспрессировать тканеспецифические антигены на своих пептидах MHC класса I. Некоторые mTEC фагоцитируются тимическими дендритными клетками ; это делает их AIRE − антигенпрезентирующими клетками (APC), что позволяет представлять собственные антигены на молекулах MHC класса II (положительно отобранные клетки CD4 + должны взаимодействовать с этими молекулами MHC класса II, таким образом, APC, которые обладают MHC класса II, должны присутствовать для отрицательного отбора CD4 + T-клеток). Тимоциты, которые слишком сильно взаимодействуют с собственным антигеном, получают апоптотический сигнал, который приводит к гибели клетки. Однако некоторые из этих клеток отбираются, чтобы стать клетками Treg . Остальные клетки выходят из тимуса как зрелые наивные Т-клетки , также известные как недавние эмигранты тимуса. [13] Этот процесс является важным компонентом центральной толерантности и служит для предотвращения образования аутореактивных Т-клеток, которые способны вызывать аутоиммунные заболевания у хозяина.
β-селекция является первой контрольной точкой, где тимоцитам, способным формировать функциональный пре-TCR (с инвариантной альфа-цепью и функциональной бета-цепью), разрешается продолжить развитие в тимусе. Затем позитивный отбор проверяет, что тимоциты успешно перестроили свой локус TCRα и способны распознавать молекулы MHC с соответствующим сродством. Затем негативный отбор в мозговом веществе устраняет тимоциты, которые слишком сильно связываются с собственными антигенами, экспрессируемыми на молекулах MHC. Эти процессы отбора обеспечивают толерантность к себе со стороны иммунной системы. Типичные наивные Т-клетки, которые покидают тимус (через кортикомедуллярное соединение), являются самоограниченными, самотолерантными и единично положительными.
Около 98% тимоцитов погибают во время процессов развития в тимусе, не проходя ни позитивный, ни негативный отбор, тогда как остальные 2% выживают и покидают тимус, чтобы стать зрелыми иммунокомпетентными Т-клетками. [14] Тимус выделяет меньше клеток по мере старения человека. Поскольку тимус уменьшается примерно на 3% [15] в год в течение среднего возраста, происходит соответствующее падение продукции тимусом наивных Т-клеток, в результате чего расширение и регенерация периферических Т-клеток играют большую роль в защите пожилых людей.
Т-клетки группируются в ряд подгрупп на основе их функции. Т-клетки CD4 и CD8 отбираются в тимусе, но подвергаются дальнейшей дифференциации на периферии в специализированные клетки, которые имеют различные функции. Подгруппы Т-клеток изначально определялись по функции, но также имеют ассоциированные паттерны экспрессии генов или белков.

Т-хелперные клетки (Т - клетки) помогают другим лимфоцитам, включая созревание В-клеток в плазматические клетки и В-клетки памяти , а также активацию цитотоксических Т-клеток и макрофагов . Эти клетки также известны как Т-клетки CD4 + , поскольку они экспрессируют гликопротеин CD4 на своей поверхности. Т-хелперные клетки активируются, когда им представляют пептидные антигены молекулы МНС класса II , которые экспрессируются на поверхности антигенпрезентирующих клеток (АПК). После активации они быстро делятся и секретируют цитокины , которые регулируют или помогают иммунному ответу. Эти клетки могут дифференцироваться в один из нескольких подтипов, которые играют разные роли. Цитокины направляют Т-клетки в определенные подтипы. [16]
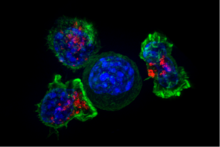
Цитотоксические Т-клетки (клетки Т -С , ЦТЛ, Т-киллерные клетки, Т-киллерные клетки) уничтожают инфицированные вирусом клетки и опухолевые клетки, а также участвуют в отторжении трансплантата . Эти клетки определяются экспрессией белка CD8 на их клеточной поверхности. Цитотоксические Т-клетки распознают свои мишени, связываясь с короткими пептидами ( длиной 8-11 аминокислот ), связанными с молекулами MHC класса I , присутствующими на поверхности всех ядросодержащих клеток. Цитотоксические Т-клетки также продуцируют ключевые цитокины IL-2 и IFNγ. Эти цитокины влияют на эффекторные функции других клеток, в частности макрофагов и NK-клеток.
Антиген-наивные Т-клетки расширяются и дифференцируются в Т-клетки памяти и эффекторные Т-клетки после того, как они сталкиваются со своим родственным антигеном в контексте молекулы MHC на поверхности профессиональной антигенпрезентирующей клетки (например, дендритной клетки). Соответствующая костимуляция должна присутствовать во время встречи с антигеном, чтобы этот процесс произошел. Исторически считалось, что Т-клетки памяти принадлежат либо к эффекторным, либо к центральным подтипам памяти, каждый из которых имеет свой собственный отличительный набор маркеров клеточной поверхности (см. ниже). [20] Впоследствии были обнаружены многочисленные новые популяции Т-клеток памяти, включая резидентные в тканях Т-клетки памяти (Trm), стволовые клетки памяти TSCM и виртуальные Т-клетки памяти. Единственной объединяющей темой для всех подтипов Т-клеток памяти является то, что они являются долгоживущими и могут быстро расширяться до большого количества эффекторных Т-клеток при повторном воздействии их родственного антигена. С помощью этого механизма они обеспечивают иммунную систему «памятью» против ранее встреченных патогенов. Т-клетки памяти могут быть либо CD4 + , либо CD8 + и обычно экспрессируют CD45RO . [21]
Подтипы Т-клеток памяти:
Регуляторные Т-клетки имеют решающее значение для поддержания иммунологической толерантности . Их основная роль заключается в отключении иммунитета, опосредованного Т-клетками, к концу иммунной реакции и подавлении аутореактивных Т-клеток , которые избежали процесса отрицательного отбора в тимусе.
Описаны два основных класса CD4 + T reg -клеток — FOXP3 + T reg- клетки и FOXP3 − T reg- клетки.
Регуляторные Т-клетки могут развиваться либо во время нормального развития в тимусе, и тогда они известны как тимические Treg-клетки, либо могут быть индуцированы периферически и называются периферически полученными Treg-клетками. Эти два подмножества ранее назывались «естественно возникающими» и «адаптивными» (или «индуцированными») соответственно. [27] Оба подмножества требуют экспрессии фактора транскрипции FOXP3 , который может быть использован для идентификации клеток. Мутации гена FOXP3 могут предотвратить развитие регуляторных Т-клеток, вызывая фатальное аутоиммунное заболевание IPEX .
Несколько других типов Т-клеток обладают подавляющей активностью, но не экспрессируют FOXP3 конститутивно. К ним относятся клетки Tr1 и Th3 , которые, как считается, возникают во время иммунного ответа и действуют, производя подавляющие молекулы. Клетки Tr1 связаны с IL-10, а клетки Th3 связаны с TGF-beta . Недавно к этому списку были добавлены клетки Th17 . [28]
Врожденные Т-клетки или нетрадиционные Т-клетки представляют собой некоторые подгруппы Т-клеток, которые ведут себя по-разному в иммунитете. Они вызывают быстрые иммунные реакции, независимо от экспрессии главного комплекса гистосовместимости (MHC), в отличие от их обычных аналогов (клеток-помощников CD4 T и цитотоксических Т-клеток CD8), которые зависят от распознавания пептидных антигенов в контексте молекулы MHC. В целом, существует три большие популяции нетрадиционных Т-клеток: клетки NKT, клетки MAIT и гамма-дельта Т-клетки. Теперь их функциональные роли уже хорошо известны в контексте инфекций и рака. [29] Более того, эти подгруппы Т-клеток транслируются во многие методы лечения злокачественных новообразований, таких как лейкемия, например. [30]
Естественные клетки-киллеры Т (NKT-клетки – не путать с естественными клетками-киллерами врожденной иммунной системы) связывают адаптивную иммунную систему с врожденной иммунной системой . В отличие от обычных Т-клеток, которые распознают белковые пептидные антигены, представленные молекулами главного комплекса гистосовместимости (MHC), NKT-клетки распознают гликолипидные антигены, представленные CD1d . После активации эти клетки могут выполнять функции, приписываемые как хелперным, так и цитотоксическим Т-клеткам: выработку цитокинов и высвобождение цитолитических/клеточно-убивающих молекул. Они также способны распознавать и устранять некоторые опухолевые клетки и клетки, инфицированные вирусами герпеса. [31]
Связанные со слизистой оболочкой инвариантные Т-клетки (MAIT) проявляют врожденные , эффекторные качества. [32] [33] У людей клетки MAIT находятся в крови, печени, легких и слизистой оболочке , защищая от микробной активности и инфекции. [32] Белок , подобный MHC класса I , MR1 , отвечает за представление бактериально-продуцируемых метаболитов витамина B клеткам MAIT. [34] [35] [36] После презентации чужеродного антигена MR1 клетки MAIT секретируют провоспалительные цитокины и способны лизировать бактериально-инфицированные клетки. [32] [36] Клетки MAIT также могут быть активированы посредством MR1-независимой сигнализации. [36] Помимо обладания врожденными функциями, эта подгруппа Т-клеток поддерживает адаптивный иммунный ответ и имеет фенотип, подобный памяти. [32] Кроме того, считается, что клетки MAIT играют роль в аутоиммунных заболеваниях , таких как рассеянный склероз , артрит и воспалительное заболевание кишечника , [37] [38] , хотя окончательные доказательства еще не опубликованы. [39] [40] [41] [42]
Гамма-дельта Т-клетки (γδ Т-клетки) представляют собой небольшую подгруппу Т-клеток, которые обладают γδ Т-клеточным рецептором, а не αβ Т-клеточным рецептором на поверхности клетки. Большинство Т-клеток экспрессируют цепи αβ Т-клеток. Эта группа Т-клеток гораздо реже встречается у людей и мышей (около 2% от общего числа Т-клеток) и в основном обнаруживается в слизистой оболочке кишечника в популяции интраэпителиальных лимфоцитов . У кроликов, овец и кур количество γδ Т-клеток может достигать 60% от общего числа Т-клеток. Антигенные молекулы, которые активируют γδ Т-клетки, до сих пор в основном неизвестны. Однако γδ Т-клетки не ограничены MHC и, по-видимому, способны распознавать целые белки, а не требовать, чтобы пептиды были представлены молекулами MHC на АПК . Некоторые мышиные γδ Т-клетки распознают молекулы MHC класса IB. Человеческие γδ T-клетки, которые используют фрагменты генов Vγ9 и Vδ2, составляют основную популяцию γδ T-клеток в периферической крови. Эти клетки уникальны тем, что они специфически и быстро реагируют на набор непептидных фосфорилированных изопреноидных предшественников, совместно называемых фосфоантигенами , которые вырабатываются практически всеми живыми клетками. Наиболее распространенными фосфоантигенами из животных и человеческих клеток (включая раковые клетки) являются изопентенилпирофосфат (IPP) и его изомер диметилаллилпирофосфат (DMPP). Многие микробы вырабатывают активное соединение гидрокси-DMAPP ( HMB-PP ) и соответствующие мононуклеотидные конъюгаты, в дополнение к IPP и DMAPP. Растительные клетки вырабатывают оба типа фосфоантигенов. Препараты, активирующие человеческие Vγ9/Vδ2 T-клетки, включают синтетические фосфоантигены и аминобисфосфонаты , которые повышают регуляцию эндогенных IPP/DMAPP.
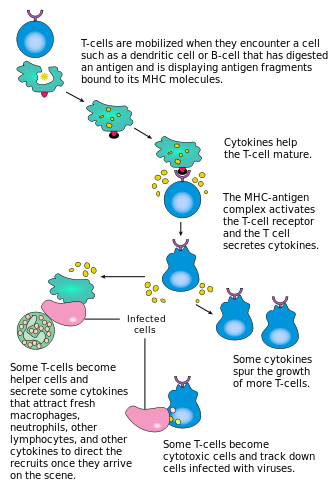
Активация CD4 + T-клеток происходит посредством одновременного взаимодействия рецептора T-клеток и костимулирующей молекулы (например, CD28 или ICOS ) на T-клетке с помощью пептида главного комплекса гистосовместимости (MHCII) и костимулирующих молекул на APC . Оба необходимы для выработки эффективного иммунного ответа; в отсутствие костимуляции сигнализация рецептора T-клеток сама по себе приводит к анергии . Сигнальные пути ниже по течению от костимулирующих молекул обычно задействуют путь PI3K, генерирующий PIP3 на плазматической мембране и рекрутирующий домен PH, содержащий сигнальные молекулы, такие как PDK1 , которые необходимы для активации PKC-θ и возможной продукции IL-2 . Оптимальный ответ CD8 + T-клеток зависит от сигнализации CD4 + . [44] CD4 + клетки полезны для начальной антигенной активации наивных CD8 T-клеток и поддержания памяти CD8 + T-клеток после острой инфекции. Следовательно, активация Т-клеток CD4 + может быть полезна для действия Т-клеток CD8 + . [45] [46] [47]
Первый сигнал обеспечивается связыванием рецептора Т-клеток с его родственным пептидом, представленным на MHCII на АПК. MHCII ограничен так называемыми профессиональными антигенпрезентирующими клетками , такими как дендритные клетки, В-клетки и макрофаги, и это лишь некоторые из них. Пептиды, представленные Т-клеткам CD8 + молекулами MHC класса I, имеют длину 8–13 аминокислот; пептиды, представленные клеткам CD4 + молекулами MHC класса II, длиннее, обычно 12–25 аминокислот в длину, [48], поскольку концы связывающей щели молекулы MHC класса II открыты.
Второй сигнал исходит от костимуляции, при которой поверхностные рецепторы на АПК индуцируются относительно небольшим количеством стимулов, обычно продуктами патогенов, но иногда продуктами распада клеток, такими как некротические тельца или белки теплового шока . Единственный костимулирующий рецептор, конститутивно экспрессируемый наивными Т-клетками, - это CD28, поэтому костимуляция для этих клеток исходит от белков CD80 и CD86 , которые вместе составляют белок B7 (B7.1 и B7.2 соответственно) на АПК. Другие рецепторы экспрессируются при активации Т-клетки, такие как OX40 и ICOS, но они в значительной степени зависят от CD28 для своей экспрессии. Второй сигнал лицензирует Т-клетку для ответа на антиген. Без него Т-клетка становится анергичной , и ей становится сложнее активироваться в будущем. Этот механизм предотвращает неадекватные ответы на себя, поскольку самопептиды обычно не будут представлены с подходящей костимуляцией. После того, как Т-клетка была соответствующим образом активирована (т.е. получила сигнал один и сигнал два), она изменяет экспрессию различных белков на своей клеточной поверхности. Маркеры активации Т-клеток включают CD69, CD71 и CD25 (также маркер для Treg-клеток) и HLA-DR (маркер активации человеческих Т-клеток). Экспрессия CTLA-4 также повышается на активированных Т-клетках, что, в свою очередь, вытесняет CD28 за связывание с белками B7. Это механизм контрольной точки для предотвращения чрезмерной активации Т-клетки. Активированные Т-клетки также изменяют свой профиль гликозилирования клеточной поверхности. [49]
Рецептор Т-клеток существует как комплекс из нескольких белков. Фактический рецептор Т-клеток состоит из двух отдельных пептидных цепей, которые производятся из независимых генов рецептора Т-клеток альфа и бета ( TCRα и TCRβ ). Другие белки в комплексе - это белки CD3 : гетеродимеры CD3εγ и CD3εδ и, что наиболее важно, гомодимер CD3ζ, который имеет в общей сложности шесть мотивов ITAM . Мотивы ITAM на CD3ζ могут фосфорилироваться Lck и, в свою очередь, привлекать ZAP-70 . Lck и/или ZAP-70 также могут фосфорилировать тирозины на многих других молекулах, не в последнюю очередь CD28, LAT и SLP-76 , что позволяет агрегировать сигнальные комплексы вокруг этих белков.
Фосфорилированный LAT привлекает SLP-76 к мембране, где он затем может принести PLC-γ , VAV1 , Itk и потенциально PI3K . PLC-γ расщепляет PI(4,5)P2 на внутреннем листке мембраны, чтобы создать активные посредники диацилглицерин ( DAG ), инозитол-1,4,5-трифосфат ( IP3 ); PI3K также действует на PIP2, фосфорилируя его для получения фосфатидилинозитол-3,4,5-трифосфата (PIP3). DAG связывает и активирует некоторые PKC. Наиболее важным в Т-клетках является PKC-θ, критически важный для активации факторов транскрипции NF-κB и AP-1. IP3 высвобождается из мембраны PLC-γ и быстро диффундирует, чтобы активировать рецепторы кальциевых каналов на ER , что вызывает высвобождение кальция в цитозоль. Низкий уровень кальция в эндоплазматическом ретикулуме вызывает кластеризацию STIM1 на мембране ER и приводит к активации каналов CRAC клеточной мембраны, что позволяет дополнительному кальцию поступать в цитозоль из внеклеточного пространства. Этот агрегированный цитозольный кальций связывает кальмодулин, который затем может активировать кальциневрин . Кальциневрин, в свою очередь, активирует NFAT , который затем перемещается в ядро. NFAT является фактором транскрипции , который активирует транскрипцию плейотропного набора генов, наиболее примечательным из которых является IL-2, цитокин, который способствует долговременной пролиферации активированных Т-клеток.
PLC-γ также может инициировать путь NF-κB . DAG активирует PKC-θ, который затем фосфорилирует CARMA1, заставляя его разворачиваться и функционировать как каркас. Цитозольные домены связывают адаптер BCL10 через домены CARD (Caspase activation and recruitment domains); который затем связывает TRAF6, который убиквитинируется в K63. : 513–523 [50] Эта форма убиквитинирования не приводит к деградации целевых белков. Вместо этого она служит для рекрутирования NEMO, IKKα и -β, и TAB1-2/TAK1. [51] TAK 1 фосфорилирует IKK-β, который затем фосфорилирует IκB, обеспечивая убиквитинирование K48: приводит к протеасомной деградации. Затем Rel A и p50 могут проникать в ядро и связывать элемент ответа NF-κB. Это в сочетании с сигнализацией NFAT позволяет полностью активировать ген IL-2. [50]
Хотя в большинстве случаев активация зависит от распознавания антигена TCR, были описаны альтернативные пути активации. Например, было показано, что цитотоксические Т-клетки активируются, когда на них нацелены другие Т-клетки CD8, что приводит к толерантности последних. [52]
Весной 2014 года на Международной космической станции был запущен эксперимент по активации Т-клеток в космосе (TCAS) в рамках миссии SpaceX CRS-3 для изучения того, как «недостатки иммунной системы человека зависят от условий микрогравитации» [53] .
Активация Т-клеток модулируется активными формами кислорода . [54]
Уникальной особенностью Т-клеток является их способность различать здоровые и аномальные (например, инфицированные или раковые) клетки в организме. [55] Здоровые клетки обычно экспрессируют большое количество собственных pMHC на своей клеточной поверхности, и хотя рецептор антигена Т-клетки может взаимодействовать по крайней мере с подмножеством этих собственных pMHC, Т-клетка обычно игнорирует эти здоровые клетки. Однако, когда эти самые клетки содержат даже незначительные количества патогенных pMHC, Т-клетки способны активироваться и инициировать иммунные реакции. Способность Т-клеток игнорировать здоровые клетки, но реагировать, когда эти же клетки содержат патогенные (или раковые) pMHC, известна как антигенная дискриминация. Молекулярные механизмы, лежащие в основе этого процесса, являются спорными. [55] [56]
.jpg/440px-HIV-infected_T_cell_(6813384933).jpg)
Причины дефицита Т-клеток включают лимфоцитопению Т-клеток и/или дефекты функции отдельных Т-клеток. Полная недостаточность функции Т-клеток может быть результатом наследственных состояний, таких как тяжелый комбинированный иммунодефицит (ТКИД), синдром Оменна и гипоплазия хряща и волос . [57] Причины частичной недостаточности функции Т-клеток включают синдром приобретенного иммунодефицита (СПИД) и наследственные состояния, такие как синдром ДиДжорджи (ДГС), синдромы хромосомных поломок (СХП) и комбинированные расстройства В-клеток и Т-клеток, такие как атаксия-телеангиэктазия (АТ) и синдром Вискотта-Олдрича (СВО). [57]
Основными патогенами, вызывающими беспокойство при дефиците Т-клеток, являются внутриклеточные патогены , включая вирус простого герпеса , микобактерии и листерии . [58] Кроме того, грибковые инфекции также более распространены и тяжелы при дефиците Т-клеток. [58]
Рак Т-клеток называется Т-клеточной лимфомой и составляет, возможно, один из десяти случаев неходжкинской лимфомы . [59] Основными формами Т-клеточной лимфомы являются:
Истощение Т-клеток — это плохо определенный или неоднозначный термин. [60] [61] Существует три подхода к его определению. [60] «Первый подход в первую очередь определяет как истощенные клетки, которые представляют одну и ту же клеточную дисфункцию (обычно, отсутствие ожидаемого ответа эффектора). Второй подход в первую очередь определяет как истощенные клетки, которые производятся по определенной причине (обычно, но не обязательно, хроническое воздействие антигена). Наконец, третий подход в первую очередь определяет как истощенные клетки, которые представляют одни и те же молекулярные маркеры (обычно, запрограммированный белок клеточной смерти 1 [PD-1])». [60]
Дисфункциональные Т-клетки характеризуются прогрессирующей потерей функции, изменениями в транскрипционных профилях и устойчивой экспрессией ингибирующих рецепторов. Сначала клетки теряют способность продуцировать ИЛ-2 и ФНОα , за чем следует потеря высокой пролиферативной способности и цитотоксического потенциала, что в конечном итоге приводит к их удалению. Истощенные Т-клетки обычно показывают более высокие уровни CD43 , CD69 и ингибирующих рецепторов в сочетании с более низкой экспрессией CD62L и CD127 . Истощение может развиться во время хронических инфекций, сепсиса и рака. [62] Истощенные Т-клетки сохраняют свое функциональное истощение даже после повторного воздействия антигена. [63]
Истощение Т-клеток может быть вызвано несколькими факторами, такими как постоянное воздействие антигена и отсутствие помощи Т-клеток CD4. [64] Воздействие антигена также влияет на ход истощения, поскольку более длительное время воздействия и более высокая вирусная нагрузка увеличивают тяжесть истощения Т-клеток. Для установления истощения требуется не менее 2–4 недель воздействия. [65] Другим фактором, способным вызвать истощение, являются ингибирующие рецепторы, включая белок программируемой смерти клеток 1 (PD1), CTLA-4 , белок мембраны Т-клеток-3 (TIM3) и белок гена активации лимфоцитов 3 (LAG3). [66] [67] Растворимые молекулы, такие как цитокины IL-10 или TGF-β, также способны вызывать истощение. [68] [69] Последние известные факторы, которые могут играть роль в истощении Т-клеток, — это регуляторные клетки. Клетки Treg могут быть источником IL-10 и TGF-β, и поэтому они могут играть роль в истощении Т-клеток. [70] Кроме того, истощение Т-клеток возвращается после истощения Treg-клеток и блокады PD1. [71] Истощение Т-клеток также может возникнуть во время сепсиса в результате цитокинового шторма. Позже, после первоначального септического столкновения, противовоспалительные цитокины и проапоптотические белки берут на себя защиту организма от повреждения. Сепсис также несет высокую антигенную нагрузку и воспаление. На этой стадии сепсиса истощение Т-клеток увеличивается. [72] [73] В настоящее время проводятся исследования, направленные на использование блокады ингибиторных рецепторов при лечении сепсиса. [74] [75] [76]
В то время как во время инфекции истощение Т-клеток может развиться после постоянного воздействия антигена после трансплантации трансплантата, аналогичная ситуация возникает и при наличии аллоантигена. [77] Было показано, что реакция Т-клеток со временем уменьшается после трансплантации почки. [78] Эти данные свидетельствуют о том, что истощение Т-клеток играет важную роль в толерантности трансплантата, главным образом за счет истощения аллореактивных CD8 Т-клеток. [73] [79] Несколько исследований показали положительное влияние хронической инфекции на принятие трансплантата и его долгосрочное выживание, частично опосредованное истощением Т-клеток. [80] [81] [82] Было также показано, что истощение Т-клеток реципиента обеспечивает достаточные условия для переноса NK-клеток . [83] Хотя есть данные, показывающие, что индукция истощения Т-клеток может быть полезной для трансплантации, она также несет в себе недостатки, среди которых можно назвать повышенное количество инфекций и риск развития опухолей. [84]
Во время рака истощение Т-клеток играет роль в защите от опухоли. Согласно исследованиям, некоторые раковые клетки, а также сами опухолевые клетки могут активно вызывать истощение Т-клеток в месте опухоли. [85] [86] [87] Истощение Т-клеток также может играть роль в рецидивах рака, как это было показано при лейкемии. [88] Некоторые исследования предполагают, что можно предсказать рецидив лейкемии на основе экспрессии ингибирующих рецепторов PD-1 и TIM-3 Т-клетками. [89] Многие эксперименты и клинические испытания были сосредоточены на блокаторах иммунных контрольных точек в терапии рака, причем некоторые из них были одобрены в качестве действительных методов лечения, которые в настоящее время используются в клинической практике. [90] Ингибирующие рецепторы, на которые нацелены эти медицинские процедуры, играют жизненно важную роль в истощении Т-клеток, и их блокирование может обратить эти изменения вспять. [91]
Т-клетки ... получают свое [название] от органов, в которых они развиваются. Т-клетки развиваются [созревают] в тимусе