Реакции Фриделя -Крафтса представляют собой набор реакций , разработанных Чарльзом Фриделем и Джеймсом Крафтсом в 1877 году для присоединения заместителей к ароматическому кольцу . [1] Реакции Фриделя-Крафтса делятся на два основных типа: реакции алкилирования и реакции ацилирования . Оба протекают путем электрофильного ароматического замещения . [2] [3] [4] [5]
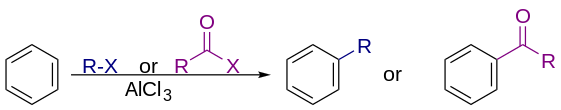
В коммерческих целях алкилирующими агентами обычно являются алкены — одни из самых крупномасштабных реакций, практикуемых в промышленности. Такие алкилирования имеют большое промышленное значение, например, для производства этилбензола , предшественника полистирола, из бензола и этилена, а также для производства кумола из бензола и пропена в кумоловом процессе :
В промышленном производстве в качестве катализатора обычно используются твердые кислоты , полученные из цеолита .
Алкилирование по Фриделю-Крафтсу включает алкилирование ароматического кольца . Традиционно алкилирующими агентами являются алкилгалогениды . Вместо алкилгалогенидов можно использовать многие алкилирующие агенты. Например, еноны и эпоксиды можно использовать в присутствии протонов. Традиционно в реакции также используется сильная кислота Льюиса , такая как хлорид алюминия, в качестве катализатора. [6]
Эта реакция имеет тот недостаток, что продукт более нуклеофильен , чем реагент, поскольку алкильные группы являются активаторами реакции Фриделя-Крафтса . Следовательно, может произойти сверхалкилирование. Стерические препятствия можно использовать для ограничения количества алкилирований, как при т -бутилировании 1,4-диметоксибензола. [7]
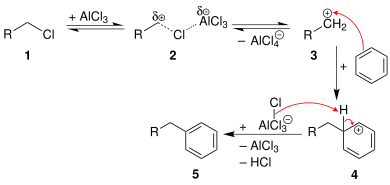
Более того, реакция полезна только для первичных алкилгалогенидов во внутримолекулярном смысле, когда образуется 5- или 6-членное кольцо. В межмолекулярном случае реакция ограничивается третичными алкилирующими агентами, некоторыми вторичными алкилирующими агентами (теми, для которых карбокатионная перегруппировка является вырожденной) или алкилирующими агентами, которые дают стабилизированные карбокатионы (например, бензильные или аллильные). В случае первичных алкилгалогенидов карбокатионоподобный комплекс (R (+) ---X---Al (-) Cl 3 ) будет подвергаться реакции карбокатионной перегруппировки с образованием почти исключительно перегруппированного продукта, полученного из вторичного или третичный карбокатион. [8]
Протонирование алкенов приводит к образованию карбокатионов – электрофилов. Лабораторный пример синтеза хлорида неофилла из бензола и хлорида металлила с использованием катализатора серной кислоты . [9]
Общий механизм первичных алкилгалогенидов показан ниже. [8]
Алкилирование Фриделя-Крафтса может быть обратимым , о чем свидетельствуют многие реакции трансалкилирования . [10]

Ацилирование Фриделя-Крафтса включает ацилирование ароматических колец. Типичными ацилирующими агентами являются ацилхлориды . Ангидриды кислот , а также карбоновые кислоты также являются жизнеспособными. Типичным кислотным катализатором Льюиса является трихлорид алюминия . Поскольку, однако, образующийся кетон образует довольно стабильный комплекс с кислотами Льюиса, такими как AlCl 3 , обычно необходимо использовать стехиометрическое или большее количество «катализатора», в отличие от случая алкилирования Фриделя-Крафтса, в котором катализатором является постоянно регенерировал. [11] Условия реакции аналогичны алкилированию Фриделя–Крафтса. Эта реакция имеет ряд преимуществ перед реакцией алкилирования. Из-за электроноакцепторного эффекта карбонильной группы кетоновый продукт всегда менее реакционноспособен, чем исходная молекула, поэтому множественного ацилирования не происходит. Также не происходит карбокатионных перегруппировок, поскольку ион ацилия стабилизируется резонансной структурой, в которой положительный заряд находится на кислороде.
Жизнеспособность ацилирования Фриделя-Крафтса зависит от стабильности реагента ацилхлорида. Например, формилхлорид слишком нестабилен, чтобы его можно было выделить. Таким образом, синтез бензальдегида по пути Фриделя-Крафтса требует синтеза формилхлорида in situ . Это достигается с помощью реакции Гаттермана-Коха , осуществляемой путем обработки бензола окисью углерода и хлористым водородом под высоким давлением, катализируемой смесью хлорида алюминия и хлорида меди . Простые кетоны, которые можно получить ацилированием Фриделя–Крафтса, в промышленности производят альтернативными методами, например окислением.
Реакция протекает через образование ацильного центра. Реакция завершается депротонированием иона арения AlCl 4 - , регенерируя катализатор AlCl 3 . Однако, в отличие от истинно каталитической реакции алкилирования, образующийся кетон представляет собой умеренное основание Льюиса, которое образует комплекс с сильным трихлоридом алюминия кислоты Льюиса. Образование этого комплекса обычно необратимо в условиях реакции. Таким образом, необходимо стехиометрическое количество AlCl 3 . Комплекс разрушается при водной обработке с образованием желаемого кетона. Например, классический синтез дезоксибензоина требует 1,1 эквивалента AlCl 3 по отношению к лимитирующему реагенту – фенилацетилхлориду. [12] В некоторых случаях, обычно когда бензольное кольцо активировано, ацилирование по Фриделю-Крафтсу также можно проводить с использованием каталитических количеств более мягкой кислоты Льюиса (например, солей Zn(II)) или катализатора кислоты Бренстеда, используя ангидрид или даже сама карбоновая кислота в качестве ацилирующего агента.
При желании полученный кетон можно впоследствии восстановить до соответствующего алканового заместителя путем восстановления Вольфа-Кишнера или восстановления Клемменсена . Конечный результат тот же, что и при алкилировании Фриделя-Крафтса, за исключением того, что перегруппировка невозможна. [13]
Арены реагируют с некоторыми альдегидами и кетонами с образованием гидроксиалкилированных продуктов, например, при реакции мезитильного производного глиоксаля с бензолом: [14]
Как обычно, альдегидная группа является более реакционноспособным электрофилом, чем феноновая .

Эта реакция связана с несколькими классическими именованными реакциями:
Реакции Фриделя-Крафтса использовались при синтезе нескольких триарилметановых и ксантеновых красителей . [24] Примерами являются синтез тимолфталеина (индикатора pH) из двух эквивалентов тимола и фталевого ангидрида :
Реакция фталевого ангидрида с резорцином в присутствии хлорида цинка дает флуорофор флуоресцеин . Замена резорцина на N,N-диэтиламинофенол в этой реакции дает родамин B :
Реакция Хаворта — классический метод синтеза 1-тетралона . [25] В этой реакции бензол реагирует с янтарным ангидридом , промежуточный продукт восстанавливается и происходит второе ацилирование FC с добавлением кислоты. [26]
В аналогичной реакции фенантрен синтезируется из нафталина и янтарного ангидрида в ряд стадий, которые начинаются с ацилирования FC.
Реакция хлороформа с ароматическими соединениями с использованием катализатора из хлорида алюминия дает триарилметаны, которые часто имеют яркую окраску, как в случае триарилметановых красителей. Это стендовый тест на ароматические соединения. [27]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка )