Хлорид железа(III) описывает неорганические соединения с формулой FeCl3 ( H2O ) x . Также называемые хлоридом железа , эти соединения являются одними из самых важных и распространенных соединений железа. Они доступны как в безводной, так и в гидратированной формах, которые обе гигроскопичны . Они содержат железо в степени окисления +3 . Безводное производное является кислотой Льюиса , в то время как все формы являются мягкими окислителями. Он используется в качестве очистителя воды и травителя для металлов.

Все формы хлорида железа являются парамагнитными из-за наличия неспаренных электронов, находящихся на 3d-орбиталях. Хотя хлорид Fe(III) может быть октаэдрическим или тетраэдрическим (или и тем, и другим, см. раздел структуры), все эти формы имеют пять неспаренных электронов, по одному на d-орбиталь . Высокоспиновая электронная конфигурация d 5 требует, чтобы электронные переходы dd были запрещены по спину , в дополнение к нарушению правила Лапорта . Этот двойной запрет приводит к тому, что его растворы имеют только бледную окраску. Или, выражаясь более технически, оптические переходы неинтенсивны. Водные сульфат железа и нитрат железа , которые содержат [Fe(H 2 O) 6 ] 3+ , почти бесцветны, тогда как хлоридные растворы желтые. Таким образом, хлоридные лиганды существенно влияют на оптические свойства железного центра. [8] [9]
Хлорид железа (III) может существовать в виде безводного вещества и ряда гидратов, что приводит к образованию различных структур.
Безводное соединение представляет собой гигроскопичное кристаллическое вещество с температурой плавления 307,6 °C. Цвет зависит от угла зрения: в отраженном свете кристаллы кажутся темно-зелеными, а в проходящем свете они кажутся пурпурно-красными. Безводный хлорид железа(III) имеет структуру BiI3 с октаэдрическими центрами Fe(III), соединенными двухкоординированными хлоридными лигандами . [7] [10]
Хлорид железа(III) имеет относительно низкую температуру плавления и кипит при температуре около 315 °C. Пар состоит из димера Fe2Cl6 , очень похожего на хлорид алюминия . Этот димер диссоциирует в мономерный FeCl3 (с точечной группой молекулярной симметрии D3h ) при более высоких температурах, конкурируя с его обратимым разложением , давая хлорид железа(II) и газообразный хлор . [11]
Хлорид железа образует гидраты при воздействии воды, что отражает его кислотность Льюиса. Все гидраты демонстрируют расплывание , что означает, что они становятся жидкими, поглощая влагу из воздуха. Гидратация неизменно дает производные аквакомплексов с формулой [FeCl 2 (H 2 O) 4 ] + . Этот катион может принимать либо транс- , либо цис -стереохимию , что отражает относительное расположение хлоридных лигандов на октаэдрическом центре Fe. Четыре гидрата были охарактеризованы с помощью рентгеновской кристаллографии : дигидрат FeCl 3 ·2H 2 O , дисесквигидрат FeCl 3 ·2,5H 2 O , трисесквигидрат FeCl 3 · 3,5H 2 O и, наконец, гексагидрат FeCl 3 ·6H 2 O. Эти виды различаются по стереохимии октаэдрического катиона железа, идентичности анионов и наличию или отсутствию кристаллизационной воды . [9] Структурные формулы: [ транс −FeCl 2 (H 2 O) 4 ][FeCl 4 ] , [ цис −FeCl 2 (H 2 O) 4 ][FeCl 4 ]· H 2 O , [ цис −FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O и [ транс −FeCl 2 (H 2 O) 4 ]Cl·2H 2 O. Первые три члена этой серии имеют тетраэдрический тетрахлороферратный ( [FeCl 4 ] − ) анион. [12]
_chloride_2.JPG/440px-Iron(III)_chloride_2.JPG)
Подобно твердым гидратам, водные растворы хлорида железа также состоят из октаэдрического [FeCl 2 (H 2 O) 4 ] + неопределенной стереохимии. [9] Детальное определение состава водных растворов хлорида железа является сложной задачей, поскольку отдельные компоненты не имеют отличительных спектроскопических сигнатур. Комплексы железа (III) с конфигурацией с высоким спином d 5 являются кинетически лабильными, что означает, что лиганды быстро диссоциируют и реассоциируют. Еще одним осложнением является то, что эти растворы являются сильнокислотными, как и ожидалось для аквакомплексов трикатионного металла. Аквакомплексы железа склонны к оляции , образованию полимерных оксопроизводных . Разбавленные растворы хлорида железа производят растворимые наночастицы с молекулярной массой 10 4 , которые проявляют свойство «старения», т. е. структура изменяется или эволюционирует в течение дней. [13] Полимерные соединения, образующиеся при гидролизе хлоридов железа, играют ключевую роль в использовании хлорида железа для очистки воды.
В отличие от сложного поведения его водных растворов, растворы хлорида железа(III) в диэтиловом эфире и тетрагидрофуране ведут себя хорошо. Оба эфира образуют 1:2 аддукты общей формулы FeCl 3 (эфир) 2 . В этих комплексах железо является пентакоординированным. [14]
Ежегодно производится несколько сотен тонн безводного хлорида железа(III). Основной метод, называемый прямым хлорированием , использует в качестве прекурсора железный лом: [10]
Реакция проводится при нескольких сотнях градусов, так что продукт становится газообразным. Использование избыточного хлора гарантирует, что промежуточный хлорид железа преобразуется в состояние железа. [10] Похожий, но лабораторный процесс также был описан. [15] [16]
Водные растворы хлорида железа (III) также производятся в промышленных масштабах из ряда прекурсоров железа, включая оксиды железа:
В дополнительном пути металлическое железо может быть окислено соляной кислотой с последующим хлорированием: [10]
К этим процессам применим ряд переменных, включая окисление железа хлоридом железа и гидратацию промежуточных продуктов. [10] Гидраты хлорида железа (III) нелегко дают безводный хлорид железа. Попытка термической дегидратации дает соляную кислоту и оксихлорид железа . В лаборатории гидратированный хлорид железа (III) может быть преобразован в безводную форму путем обработки тионилхлоридом [ 17] или триметилсилилхлоридом : [18]
Обладая электронной конфигурацией с высоким спином d5 , хлориды железа(III) являются лабильными , что означает, что их лиганды Cl- и H2O быстро обмениваются со свободным хлоридом и водой. [9] [19] В отличие от их кинетической лабильности, хлориды железа(III) являются термодинамически устойчивыми, что подтверждается энергичными методами, применяемыми для их синтеза, как описано выше.
Помимо лабильности, которая относится к безводным и гидратированным формам, реакционная способность безводного хлорида железа обнаруживает две тенденции: он является кислотой Льюиса и окислителем . [20]
Реакции безводного хлорида железа(III) отражают его описание как оксофильной и жесткой кислоты Льюиса . Доступно множество проявлений оксофильности хлорида железа(III). При нагревании с оксидом железа(III) при 350 °C он реагирует с образованием оксихлорида железа : [21]
Алкоксиды щелочных металлов реагируют с образованием комплексов алкоксида железа(III) . Эти продукты имеют более сложную структуру, чем безводный хлорид железа(III). [22] [23] В твердой фазе были описаны различные многоядерные комплексы для номинальной стехиометрической реакции между FeCl 3 и этилатом натрия :
Хлорид железа (III) образует аддукт 1:2 с основаниями Льюиса , такими как оксид трифенилфосфина ; например, FeCl 3 (OP(C 6 H 5 ) 3 ) 2 . Родственный комплекс 1:2 FeCl 3 (OEt 2 ) 2 , где Et = C 2 H 5 ) , был кристаллизован из эфирного раствора. [14]
Хлорид железа (III) также реагирует с хлоридом тетраэтиламмония , образуя желтую соль тетрахлорферрат- иона ( (Et 4 N)[FeCl 4 ] ). Аналогично, сочетание FeCl 3 с NaCl и KCl дает Na[FeCl 4 ] и K[FeCl 4 ] , соответственно. [24]
В дополнение к этим простым стехиометрическим реакциям, кислотность Льюиса хлорида железа позволяет использовать его в различных реакциях, катализируемых кислотами , как описано ниже в разделе, посвященном органической химии. [10]
Будучи окислителем, хлорид железа (III) окисляет железный порошок с образованием хлорида железа (II) посредством реакции пропорционального пропорционирования : [10]
Традиционный синтез безводного хлорида железа – восстановление FeCl 3 хлорбензолом : [25]
Хлорид железа (III) выделяет газообразный хлор при нагревании выше 160 °C, образуя хлорид железа : [16]
Для подавления этой реакции при получении хлорида железа (III) требуется избыток хлорирующего агента, как обсуждалось выше. [16] [10]
В отличие от безводного материала, гидратированный хлорид железа не является особенно сильной кислотой Льюиса, поскольку водные лиганды погасили кислотность Льюиса, связавшись с Fe(III).
Подобно безводному материалу, гидратированный хлорид железа является оксофильным. Например, соли оксалата быстро реагируют с водным хлоридом железа(III) , образуя [Fe( C2O4 ) 3 ] 3− , известный как ферриоксалат . Другие источники карбоксилата , например, цитрат и тартрат , также связываются, образуя карбоксилатные комплексы . Сродство железа(III) к кислородным лигандам было основой качественных тестов на фенолы. Хотя он был заменен спектроскопическими методами, тест с хлоридом железа является традиционным колориметрическим тестом. [26] Сродство железа(III) к фенолам используется в тесте пятна Триндера . [27]
Водный раствор хлорида железа (III) служит одноэлектронным окислителем, что иллюстрируется его реакцией с хлоридом меди (I) с образованием хлорида меди (II) и хлорида железа (II).
Эта фундаментальная реакция имеет отношение к использованию растворов хлорида железа при травлении меди.
Взаимодействие безводного хлорида железа(III) с литийорганическими и магнийорганическими соединениями часто изучалось. Эти исследования стали возможны благодаря растворимости FeCl 3 в эфирных растворителях, что исключает возможность гидролиза нуклеофильных алкилирующих агентов . Такие исследования могут быть актуальны для механизма реакций кросс-сочетания, катализируемых FeCl 3 . [28] Выделение промежуточных соединений органического железа(III) требует низкотемпературных реакций, чтобы промежуточные соединения [FeR 4 ] − не деградировали. Используя бромистый метилмагний в качестве алкилирующего агента, были выделены соли Fe(CH 3 ) 4 ] − . [29] Иллюстрируя чувствительность этих реакций, метиллитий LiCH 3 реагирует с хлоридом железа(III) с образованием тетрахлорферрата лития (II) Li 2 [FeCl 4 ] : [30]
В значительной степени ацетилацетонат железа (III) и родственные ему бета-дикетонатные комплексы более широко используются, чем FeCl 3 , в качестве растворимых в эфире источников ионов железа. [20] Эти дикетонатные комплексы имеют то преимущество, что они не образуют гидратов, в отличие от хлорида железа (III), и они более растворимы в соответствующих растворителях. [28] Циклопентадиенилмагнийбромид вступает в сложную реакцию с хлоридом железа (III), в результате чего образуется ферроцен : [31]
Это преобразование, хотя и не имело практического значения, имело важное значение в истории металлоорганической химии , символом которой является ферроцен. [32]
Наибольшее применение хлорида железа (III) — очистка сточных вод и производство питьевой воды . Образуя высокодисперсные сети из материалов, содержащих Fe-O-Fe, хлориды железа служат коагулянтами и флокулянтами. [33] В этом применении водный раствор FeCl 3 обрабатывается основанием для образования хлопьев гидроксида железа (III) ( Fe(OH) 3 ), также называемого FeO(OH) ( ферригидрит ). Эти хлопья облегчают разделение взвешенных веществ, осветляя воду. [10]
Хлорид железа (III) также используется для удаления растворимого фосфата из сточных вод. Фосфат железа (III) нерастворим и, таким образом , выпадает в осадок в виде твердого вещества. [34] Одним из потенциальных преимуществ его использования в очистке воды является то, что ион железа окисляет (дезодорирует) сероводород . [35]
Он также используется в качестве выщелачивающего агента в хлоридной гидрометаллургии, [36] например, при производстве Si из FeSi (процесс Silgrain компании Elkem ). [37]
В другом коммерческом применении раствор хлорида железа (III) используется для травления меди в соответствии со следующим уравнением:
Растворимый хлорид меди(II) смывается, оставляя медный рисунок. Эта химия используется в производстве печатных плат (ПП). [19]
Хлорид железа (III) используется во многих других хобби, связанных с металлическими предметами. [38] [39] [40] [41] [42]

В промышленности хлорид железа(III) используется как катализатор реакции этилена с хлором , образуя этилендихлорид ( 1,2-дихлорэтан ): [43]
Этилендихлорид — это товарный химикат , который в основном используется для промышленного производства винилхлорида , мономера для изготовления ПВХ . [44]
Иллюстрируя его использование в качестве кислоты Льюиса , хлорид железа (III) катализирует электрофильное ароматическое замещение и хлорирование . В этой роли его функция аналогична функции хлорида алюминия . В некоторых случаях используются смеси этих двух веществ. [45]
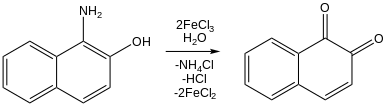
Хотя хлориды железа (III) редко используются в практическом органическом синтезе , они привлекли значительное внимание в качестве реагентов, поскольку они недороги, широко распространены на Земле и относительно нетоксичны. Во многих экспериментах исследуются как его окислительно-восстановительная активность, так и его кислотность Льюиса. [20] Например, хлорид железа (III) окисляет нафтолы до нафтохинонов: [20] [46] 3- алкилтиофены полимеризуются до политиофена при обработке хлоридом железа. [47] Было показано, что хлорид железа (III) способствует реакции сочетания CC . [48]
Было разработано несколько реагентов на основе хлорида железа (III) на подложке . На силикагеле безводная соль применялась к некоторым реакциям дегидратации и перегруппировки пинакольного типа . Похожий реагент, но увлажненный, вызывает реакции гидролиза или эпимеризации . [49] На оксиде алюминия было показано, что хлорид железа ускоряет реакции ена . [50]
При предварительной обработке гидридом натрия хлорид железа (III) дает гидридный восстановитель , который превращает алкены и кетоны в алканы и спирты соответственно. [51]
Хлорид железа (III) является компонентом полезных красителей, таких как раствор Карнуа , гистологический фиксатор с множеством применений. Также он используется для приготовления окраски Верхоффа . [52]
Как и многие галогениды металлов, FeCl 3 встречается в природе в виде следового минерала. Редкий минерал молизит обычно ассоциируется с вулканами и фумаролами . [53] [54]
Аэрозоль на основе FeCl 3 образуется в результате реакции между пылью, богатой железом, и соляной кислотой из морской соли. Этот аэрозоль на основе железной соли вызывает около 1-5% естественного окисления метана и, как полагают, имеет ряд охлаждающих эффектов; таким образом, он был предложен в качестве катализатора для удаления атмосферного метана . [55]
Предполагается, что облака Венеры содержат приблизительно 1% FeCl 3 , растворенного в серной кислоте . [56] [57]
Хлориды железа (III) широко используются при очистке питьевой воды , [10] поэтому они не представляют большой проблемы как яды при низких концентрациях. [неправильный синтез?] Тем не менее, безводный хлорид железа (III), а также концентрированный водный раствор FeCl3 , являются очень едкими и должны обрабатываться с использованием надлежащих защитных средств. [20]