Холин — это катион с химической формулой [(CH 3 ) 3 NCH 2 CH 2 OH] + . [1] [4] [5] Холин образует различные соли , такие как хлорид холина и битартрат холина . Он является важным питательным веществом для людей и многих других животных и является структурной частью фосфолипидов и клеточных мембран . [4] [5]
Холин используется для синтеза ацетилхолина , нейромедиатора , участвующего в контроле мышц и многочисленных функциях нервной системы. [4] [5] Холин участвует в раннем развитии мозга, экспрессии генов , сигнализации клеточной мембраны и метаболизме мозга. [5]
Хотя люди синтезируют холин в печени , его естественного количества недостаточно для выполнения клеточных функций, поэтому часть холина необходимо получать из продуктов питания или пищевых добавок . [5] Продукты, богатые холином, включают мясо, птицу, яйца и другие продукты животного происхождения, крестоцветные овощи , бобы, орехи и цельные зерна . [5] Холин присутствует в грудном молоке и обычно добавляется в качестве ингредиента в детское питание . [5]
Холин — это четвертичный катион аммония . Холины — это семейство водорастворимых четвертичных аммониевых соединений . [4] Холин — это родительское соединение класса холинов, состоящее из остатка этаноламина , имеющего три метильные группы, присоединенные к одному и тому же атому азота . [1] [4] Гидроксид холина известен как холиновое основание. Он гигроскопичен и поэтому часто встречается в виде бесцветного вязкого гидратированного сиропа, который пахнет триметиламином (ТМА). Водные растворы холина стабильны, но соединение медленно распадается на этиленгликоль , полиэтиленгликоли и ТМА. [2]
Холинхлорид можно получить путем обработки ТМА 2-хлорэтанолом : [2]
Холин исторически производился из природных источников, например, путем гидролиза лецитина . [ 2 ]
Холин широко распространен в живых существах. У большинства животных холиновые фосфолипиды являются необходимыми компонентами в клеточных мембранах , в мембранах клеточных органелл и в липопротеинах очень низкой плотности . [4]
Холин является необходимым питательным веществом для людей и многих других животных. [4] Люди способны к некоторому синтезу холина de novo , но для поддержания здоровья им требуется дополнительный холин в рационе. Диетические потребности могут быть удовлетворены самим холином или в форме холиновых фосфолипидов , таких как фосфатидилхолин . [4] Холин формально не классифицируется как витамин, несмотря на то, что является необходимым питательным веществом со структурой и метаболизмом, подобными аминокислотам . [3]
Холин необходим для производства ацетилхолина – нейротрансмиттера – и S- аденозилметионина (SAM), универсального донора метильной группы . При метилировании SAM трансформируется в S-аденозилгомоцистеин . [4]
Симптоматический дефицит холина вызывает неалкогольную жировую болезнь печени и повреждение мышц. [4] Чрезмерное потребление холина (более 7,5 граммов в день) может вызвать низкое кровяное давление , потоотделение , диарею и запах тела, похожий на рыбный, из-за триметиламина , который образуется в процессе метаболизма холина. [4] [6] Богатые пищевые источники холина и холиновых фосфолипидов включают субпродукты , яичные желтки , молочные продукты , арахис , некоторые бобы , орехи и семена . Овощи с макаронами и рисом также способствуют потреблению холина в американской диете . [4] [5]
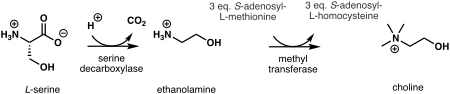
В растениях первым шагом в биосинтезе холина de novo является декарбоксилирование серина в этаноламин , которое катализируется сериндекарбоксилазой . [ 7] Синтез холина из этаноламина может происходить тремя параллельными путями, где три последовательных этапа N -метилирования, катализируемых метилтрансферазой , осуществляются либо на свободном основании, [ 8] фосфооснованиях, [9] либо на фосфатидиловых основаниях. [10] Источником метильной группы является S -аденозил- L -метионин , а S -аденозил- L -гомоцистеин образуется как побочный продукт. [11]

У людей и большинства других животных синтез холина de novo происходит через путь фосфатидилэтаноламин N-метилтрансферазы (PEMT) [6] , но биосинтез недостаточен для удовлетворения потребностей человека. [12] В печеночном пути PEMT 3-фосфоглицерат (3PG) получает 2 ацильные группы от ацил-КоА , образуя фосфатидную кислоту . Он реагирует с цитидинтрифосфатом с образованием цитидиндифосфатдиацилглицерина. Его гидроксильная группа реагирует с серином с образованием фосфатидилсерина , который декарбоксилируется до этаноламина и образуется фосфатидилэтаноламин (PE). Фермент PEMT перемещает три метильные группы от трех доноров S -аденозилметионинов (SAM) к этаноламиногруппе фосфатидилэтаноламина с образованием холина в форме фосфатидилхолина. В качестве побочного продукта образуются три S -аденозилгомоцистеина (SAH). [6]
Холин также может высвобождаться из более сложных предшественников. Например, фосфатидилхолины (PC) могут гидролизоваться до холина (Chol) в большинстве типов клеток. Холин также может вырабатываться по пути CDP-холина, цитозольные холинкиназы (CK) фосфорилируют холин с АТФ до фосфохолина (PChol). [3] Это происходит в некоторых типах клеток, таких как печень и почки. Холин-фосфатцитидилилтрансферазы (CPCT) преобразуют PChol в CDP-холин (CDP-Chol) с цитидинтрифосфатом (CTP). CDP-холин и диглицерид преобразуются в PC с помощью диацилглицеролхолинфосфотрансферазы (CPT). [6]
У людей определенные мутации фермента PEMT и дефицит эстрогена (часто из-за менопаузы ) увеличивают потребность в холине в пище. У грызунов 70% фосфатидилхолинов образуются через путь PEMT и только 30% через путь CDP-холина. [6] У нокаутных мышей инактивация PEMT делает их полностью зависимыми от пищевого холина. [3]
У людей холин всасывается из кишечника через мембранный белок SLC44A1 (CTL1) посредством облегченной диффузии , регулируемой градиентом концентрации холина и электрическим потенциалом через мембраны энтероцитов . SLC44A1 имеет ограниченную способность транспортировать холин: при высоких концентрациях часть его остается невсосавшейся. Всосавшийся холин покидает энтероциты через воротную вену , проходит через печень и попадает в системный кровоток . Кишечные микробы расщепляют невсосавшийся холин до триметиламина, который окисляется в печени до триметиламин N -оксида . [6]
Фосфохолин и глицерофосфохолины гидролизуются фосфолипазами до холина, который поступает в воротную вену. Благодаря своей водорастворимости некоторые из них попадают в воротную вену в неизмененном виде. Жирорастворимые холинсодержащие соединения (фосфатидилхолины и сфингомиелины ) либо гидролизуются фосфолипазами, либо поступают в лимфу , будучи включенными в хиломикроны . [6]
У людей холин транспортируется в виде свободного иона в крови. Фосфолипиды , содержащие холин , и другие вещества, такие как глицерофосфохолины, транспортируются в липопротеинах крови . Уровень холина в плазме крови у здоровых голодающих взрослых составляет 7–20 микромоль на литр (мкмоль/л) и в среднем 10 мкмоль/л. Уровни регулируются, но потребление и дефицит холина изменяют эти уровни. Уровни повышаются примерно в течение 3 часов после потребления холина. Уровень фосфатидилхолина в плазме голодающих взрослых составляет 1,5–2,5 ммоль/л. Его потребление повышает уровень свободного холина примерно в течение 8–12 часов, но не влияет существенно на уровень фосфатидилхолина. [6]
Холин является водорастворимым ионом и поэтому требует транспортеров для прохождения через жирорастворимые клеточные мембраны . Известно три типа транспортеров холина: [13]
SLC5A7 являются натрий- (Na + ) и АТФ-зависимыми транспортерами. [13] [6] Они обладают высокой связывающей способностью к холину, транспортируют его в первую очередь к нейронам и косвенно связаны с выработкой ацетилхолина . [6] Их недостаточная функция вызывает наследственную слабость легочных и других мышц у людей через дефицит ацетилхолина. У нокаутированных мышей их дисфункция легко приводит к смерти с цианозом и параличом . [14]
CTL1 имеют умеренное сродство к холину и транспортируют его почти во все ткани, включая кишечник, печень, почки, плаценту и митохондрии . CTL1 поставляют холин для производства фосфатидилхолина и триметилглицина . [6] CTL2 встречаются особенно в митохондриях языка, почек, мышц и сердца. Они связаны с митохондриальным окислением холина до триметилглицина. CTL1 и CTL2 не связаны с производством ацетилхолина, но транспортируют холин вместе через гематоэнцефалический барьер . Только CTL2 встречаются на мозговой стороне барьера. Они также удаляют избыток холина из нейронов обратно в кровь. CTL1 встречаются только на кровяной стороне барьера, но также на мембранах астроцитов и нейронов. [13]
OCT1 и OCT2 не связаны с выработкой ацетилхолина. [6] Они транспортируют холин с низким сродством. OCT1 транспортируют холин в основном в печень и почки; OCT2 — в почки и мозг. [13]
Холин хранится в клеточных мембранах и органеллах в виде фосфолипидов, а внутри клеток — в виде фосфатидилхолинов и глицерофосфохолинов. [6]
Даже при дозах холина 2–8 г, мало холина выделяется в мочу у людей. Выделение происходит через транспортеры, которые встречаются в почках (см. транспорт). Триметилглицин деметилируется в печени и почках до диметилглицина ( тетрагидрофолат получает одну из метильных групп). Метилглицин образуется, выделяется в мочу или деметилируется до глицина . [6]
Холин и его производные имеют множество биологических функций. В частности, холин служит предшественником других важных клеточных компонентов и сигнальных молекул, таких как фосфолипиды, которые образуют клеточные мембраны, нейротрансмиттер ацетилхолин и осморегулятор триметилглицин ( бетаин ). Триметилглицин, в свою очередь, служит источником метильных групп , участвуя в биосинтезе S -аденозилметионина . [15] [16]
Холин трансформируется в различные фосфолипиды, такие как фосфатидилхолины и сфингомиелины. [4] [5] Они обнаружены во всех клеточных мембранах и мембранах большинства клеточных органелл. [3] Фосфатидилхолины являются структурно важной частью клеточных мембран. У людей 40–50% их фосфолипидов являются фосфатидилхолинами. [6]
Холиновые фосфолипиды также образуют липидные плоты в клеточных мембранах вместе с холестерином . [4] Плоты являются центрами, например, для холинергических рецепторов и ферментов передачи сигнала рецептора . [4] [3]
Фосфатидилхолины необходимы для синтеза ЛПОНП : 70–95% их фосфолипидов у людей представляют собой фосфатидилхолины. [6]
Холин также необходим для синтеза легочного сурфактанта , который представляет собой смесь, состоящую в основном из фосфатидилхолинов. Сурфактант отвечает за эластичность легких, то есть за способность легочной ткани сокращаться и расширяться. Например, дефицит фосфатидилхолинов в легочных тканях был связан с острым респираторным дистресс-синдромом . [17]
Фосфатидилхолины выделяются в желчь и действуют вместе с солями желчных кислот как поверхностно-активные вещества , тем самым способствуя всасыванию липидов в кишечнике . [3]
Холин является предшественником ацетилхолина , нейромедиатора, который играет необходимую роль в сокращении мышц , памяти и развитии нервной системы . [4] [5] [6] Тем не менее, в организме человека содержится мало ацетилхолина по сравнению с другими формами холина. [3] Нейроны также хранят холин в форме фосфолипидов в своих клеточных мембранах для производства ацетилхолина. [6]
У людей холин необратимо окисляется в митохондриях печени до глицинбетаинальдегида холиноксидазами . Он окисляется митохондриальными или цитозольными бетаин-альдегиддегидрогеназами до триметилглицина. [6] Триметилглицин является необходимым осморегулятором. Он также работает как субстрат для фермента BHMT , который метилирует гомоцистеин в метионин . Это предшественник S -аденозилметионина (SAM). SAM является распространенным реагентом в реакциях биологического метилирования . Например, он метилирует гуанидины ДНК и некоторые лизины гистонов . Таким образом, он является частью экспрессии генов и эпигенетической регуляции . Таким образом , дефицит холина приводит к повышению уровня гомоцистеина и снижению уровня SAM в крови. [6]
Холин встречается в пищевых продуктах в виде свободного катиона и в форме фосфолипидов, особенно в виде фосфатидилхолинов. Больше всего холина содержится в субпродуктах и яичных желтках, хотя в меньшей степени он содержится в мясе, не являющемся субпродуктами, зерновых, овощах, фруктах и молочных продуктах . [5] Кулинарные масла и другие пищевые жиры содержат около 5 мг/100 г общего холина. [6] В Соединенных Штатах на этикетках продуктов питания количество холина в порции указывается в процентах от суточной нормы (%DV) на основе адекватного потребления 550 мг/день. 100% суточной нормы означает, что порция пищи содержит 550 мг холина. [5] «Общий холин» определяется как сумма свободного холина и фосфолипидов, содержащих холин, без учета массовой доли. [5] [18]
Грудное молоко человека богато холином. [4] [5] Исключительное грудное вскармливание соответствует примерно 120 мг холина в день для ребенка. Увеличение потребления холина матерью увеличивает содержание холина в грудном молоке, а низкое потребление уменьшает его. [6] Детские смеси могут содержать или не содержать достаточно холина. В ЕС и США обязательно добавлять не менее 7 мг холина на 100 килокалорий (ккал) в каждую детскую смесь. В ЕС уровни выше 50 мг/100 ккал не допускаются. [6] [19]
Триметилглицин является функциональным метаболитом холина. Он заменяет холин в питании, но только частично. [3] Высокое количество триметилглицина содержится, например, в пшеничных отрубях (1339 мг/100 г), поджаренных зародышах пшеницы (1240 мг/100 г) и шпинате (600–645 мг/100 г). [18]
В следующей таблице приведены обновленные источники холина, отражающие новую дневную норму и новые этикетки с данными о пищевой ценности и добавках. [5] Она отражает данные Министерства сельского хозяйства США, Службы сельскохозяйственных исследований. FoodData Central, 2019. [5]
DV = дневная норма. Управление по контролю за продуктами и лекарствами США (FDA) разработало DV, чтобы помочь потребителям сравнивать содержание питательных веществ в продуктах питания и диетических добавках в контексте общей диеты. DV для холина составляет 550 мг для взрослых и детей в возрасте от 4 лет и старше. [20] FDA не требует, чтобы на этикетках продуктов питания указывалось содержание холина, если только холин не был добавлен в пищу. Продукты, обеспечивающие 20% или более от DV, считаются источниками большого количества питательных веществ, но продукты, обеспечивающие более низкие проценты DV, также способствуют здоровому питанию. [5]
В базе данных FoodData Central Министерства сельского хозяйства США (USDA) приводится список питательных веществ во многих продуктах питания и приводится полный список продуктов, содержащих холин, отсортированный по содержанию питательных веществ. [5]
Недостаточно данных для установления предполагаемой средней потребности (EAR) в холине, поэтому Совет по продовольствию и питанию установил адекватные нормы потребления (AI). [5] [21] Для взрослых AI для холина был установлен на уровне 550 мг/день для мужчин и 425 мг/день для женщин. [5] Было показано, что эти значения предотвращают печеночные изменения у мужчин. Однако исследование, использованное для получения этих значений, не оценивало, будет ли эффективным меньшее количество холина, поскольку исследователи сравнивали только диету без холина с диетой, содержащей 550 мг холина в день. Из этого были экстраполированы AI для детей и подростков. [22] [23]
Рекомендации указаны в миллиграммах в день (мг/день). Рекомендации Европейского агентства по безопасности пищевых продуктов (EFSA) являются общими рекомендациями для стран ЕС . EFSA не установила никаких верхних пределов потребления. [6] Отдельные страны ЕС могут иметь более конкретные рекомендации. Рекомендации Национальной академии медицины (NAM) применяются в Соединенных Штатах, [5] Австралии и Новой Зеландии. [24]
Двенадцать исследований, проведенных в 9 странах ЕС в период с 2000 по 2011 год, оценили потребление холина взрослыми в этих странах в 269–468 миллиграммов в день. Потребление составило 269–444 мг/день у взрослых женщин и 332–468 мг/день у взрослых мужчин. Потребление составило 75–127 мг/день у младенцев, 151–210 мг/день у детей в возрасте от 1 до 3 лет, 177–304 мг/день у детей в возрасте от 3 до 10 лет и 244–373 мг/день у детей в возрасте от 10 до 18 лет. Общая оценка потребления холина составила 336 мг/день у беременных подростков и 356 мг/день у беременных женщин. [6]
Исследование, основанное на опросе NHANES 2009–2012, оценило потребление холина как слишком низкое в некоторых субпопуляциях США. Потребление составляло 315,2–318,8 мг/день у детей в возрасте 2+ лет в этот период времени. Из детей в возрасте 2+ лет только15,6 ± 0,8 % мужчин и6,1 ± 0,6 % женщин превысили адекватное потребление (АП). АП был превышен62,9 ± 3,1 % детей в возрасте от 2 до 3 лет,45,4 ± 1,6 % детей в возрасте от 4 до 8 лет,9,0 ± 1,0 % детей в возрасте от 9 до 13 лет,1,8 ± 0,4 % от 14–18 и6,6 ± 0,5 % от 19+ лет. Верхний уровень потребления не был превышен ни в одной субпопуляции. [25]
Исследование NHANES, проведенное в 2013–2014 годах среди населения США, показало, что потребление холина среди детей в возрасте от 2 до 19 лет составляет256 ± 3,8 мг/день и339 ± 3,9 мг/день у взрослых 20 лет и старше. Прием был402 ± 6,1 мг/день у мужчин 20 лет и старше и 278 мг/день у женщин 20 лет и старше. [26]
Симптоматический дефицит холина у людей встречается редко. Большинство людей получают достаточное его количество из пищи и способны биосинтезировать ограниченное его количество через PEMT . [3] Симптоматический дефицит часто вызывается определенными заболеваниями или другими косвенными причинами. Тяжелый дефицит вызывает повреждение мышц и неалкогольную жировую болезнь печени , которая может перерасти в цирроз . [27]
Помимо людей, жировая дистрофия печени также является типичным признаком дефицита холина у других животных. Кровотечение в почках также может наблюдаться у некоторых видов. Предполагается, что это связано с дефицитом триметилглицина, полученного из холина, который действует как осморегулятор. [3]
Выработка эстрогена является важным фактором, который предрасполагает людей к дефициту наряду с низким потреблением холина с пищей. Эстрогены активируют ферменты PEMT, вырабатывающие фосфатидилхолин. Женщины до менопаузы имеют меньшую потребность в холине с пищей, чем мужчины, из-за более высокой выработки эстрогена у женщин. Без терапии эстрогеном потребности в холине у женщин в постменопаузе аналогичны потребностям мужчин. Некоторые однонуклеотидные полиморфизмы (генетические факторы), влияющие на метаболизм холина и фолиевой кислоты , также имеют значение. Некоторые кишечные микробы также расщепляют холин более эффективно, чем другие, поэтому они также имеют значение. [27]
При дефиците снижается доступность фосфатидилхолинов в печени – они необходимы для образования ЛПОНП. Таким образом, транспорт жирных кислот , опосредованный ЛПОНП, из печени снижается, что приводит к накоплению жира в печени. [6] Также были предложены другие одновременно происходящие механизмы, объясняющие наблюдаемое повреждение печени. Например, холиновые фосфолипиды также необходимы в митохондриальных мембранах. Их отсутствие приводит к неспособности митохондриальных мембран поддерживать надлежащий электрохимический градиент , который, среди прочего, необходим для деградации жирных кислот посредством β-окисления . Таким образом, метаболизм жира в печени снижается. [27]
Чрезмерные дозы холина могут иметь неблагоприятные последствия. Например, было обнаружено, что ежедневные дозы холина в 8–20 г вызывают пониженное кровяное давление , тошноту , диарею и рыбный запах тела . Запах обусловлен триметиламином (ТМА), который образуется кишечными микробами из неабсорбированного холина (см. триметиламинурия ). [6]
Печень окисляет ТМА до триметиламин N -оксида (ТМАО). Повышенные уровни ТМА и ТМАО в организме связаны с повышенным риском атеросклероза и смертности. Таким образом, было высказано предположение, что чрезмерное потребление холина увеличивает эти риски в дополнение к карнитину , который также превращается в ТМА и ТМАО кишечными бактериями. Однако не было показано, что потребление холина увеличивает риск смерти от сердечно -сосудистых заболеваний . [28] Вполне вероятно, что повышенные уровни ТМА и ТМАО являются всего лишь симптомом других основных заболеваний или генетических факторов, которые предрасполагают людей к повышенной смертности. Такие факторы могли быть неправильно учтены в некоторых исследованиях, наблюдающих за смертностью, связанной с уровнем ТМА и ТМАО. Причинно-следственная связь может быть обратной или запутанной, и большое потребление холина может не увеличивать смертность у людей. Например, дисфункция почек предрасполагает к сердечно-сосудистым заболеваниям, но также может снижать выведение ТМА и ТМАО. [29]
Низкое потребление холина матерью связано с повышенным риском дефектов нервной трубки . Более высокое потребление холина матерью, вероятно, связано с лучшим нейрокогнитивным развитием/нейроразвитием у детей. [30] [4] Холин и фолат, взаимодействуя с витамином B12 , действуют как доноры метильной группы для гомоцистеина, образуя метионин, который затем может перейти к образованию SAM ( S -аденозилметионина). [4] SAM является субстратом почти для всех реакций метилирования у млекопитающих. Было высказано предположение, что нарушенное метилирование через SAM может быть ответственно за связь между фолатом и NTD. [31] Это может также относиться к холину. [ необходима цитата ] Некоторые мутации , которые нарушают метаболизм холина, увеличивают распространенность NTD у новорожденных, но роль дефицита холина в рационе остается неясной по состоянию на 2015 год. [4][обновлять]
Дефицит холина может вызвать жировую дистрофию печени , что увеличивает риск рака и сердечно-сосудистых заболеваний. Дефицит холина также снижает выработку SAM, который участвует в метилировании ДНК – это снижение также может способствовать канцерогенезу . Таким образом, дефицит и его связь с такими заболеваниями были изучены. [6] Однако наблюдательные исследования свободных популяций не убедительно показали связь между низким потреблением холина и сердечно-сосудистыми заболеваниями или большинством видов рака. [4] [6] Исследования рака предстательной железы были противоречивыми. [32] [33]
Исследования, изучающие влияние более высокого потребления холина на когнитивные способности , проводились на взрослых людях и дали противоречивые результаты. [4] [34] Аналогичные исследования на младенцах и детях были противоречивыми и также ограниченными. [4]
И беременность, и лактация резко увеличивают потребность в холине. Эта потребность может быть удовлетворена путем повышения регуляции PEMT посредством повышения уровня эстрогена для производства большего количества холина de novo , но даже при повышенной активности PEMT потребность в холине все еще настолько высока, что запасы организма обычно истощаются. Это подтверждается наблюдением, что у мышей Pemt −/− (мышей с отсутствием функционального PEMT) происходит выкидыш на 9–10 день, если их не кормить дополнительным холином. [35]
В то время как материнские запасы холина истощаются во время беременности и лактации, плацента накапливает холин, перекачивая холин против градиента концентрации в ткани, где он затем хранится в различных формах, в основном в виде ацетилхолина. Концентрация холина в амниотической жидкости может быть в десять раз выше, чем в материнской крови. [35]
Холин пользуется большим спросом во время беременности как субстрат для построения клеточных мембран (быстрое расширение тканей плода и матери), повышенная потребность в одноуглеродных фрагментах (субстрат для метилирования ДНК и других функций), увеличение запасов холина в тканях плода и плаценты и для увеличения производства липопротеинов (белков, содержащих «жировые» части). [36] [37] [38] В частности, существует интерес к влиянию потребления холина на мозг. Это связано с использованием холина в качестве материала для создания клеточных мембран (в частности, для создания фосфатидилхолина). Рост человеческого мозга наиболее быстр в течение третьего триместра беременности и продолжает быть быстрым примерно до пятилетнего возраста. [39] В это время высок спрос на сфингомиелин, который производится из фосфатидилхолина (и, следовательно, из холина), поскольку этот материал используется для миелинизации (изоляции) нервных волокон . [40] Холин также необходим для производства нейротрансмиттера ацетилхолина, который может влиять на структуру и организацию областей мозга, нейрогенез , миелинизацию и формирование синапсов . Ацетилхолин присутствует даже в плаценте и может помочь контролировать пролиферацию и дифференциацию клеток (увеличение числа клеток и изменение многофункциональных клеток в специализированные клеточные функции) и роды . [41] [42]
Поглощение холина в мозг контролируется низкоаффинным транспортером, расположенным на гематоэнцефалическом барьере. [43] Транспорт происходит, когда концентрация холина в плазме артериальной крови увеличивается выше 14 мкмоль/л, что может произойти во время всплеска концентрации холина после употребления богатой холином пищи. Нейроны, наоборот, получают холин как высокоаффинными, так и низкоаффинными транспортерами. Холин хранится в виде мембраносвязанного фосфатидилхолина, который затем может быть использован для синтеза нейротрансмиттера ацетилхолина позже. Ацетилхолин образуется по мере необходимости, проходит через синапс и передает сигнал следующему нейрону. После этого ацетилхолинэстераза расщепляет его, и свободный холин снова поглощается высокоаффинным транспортером в нейрон. [44]
Холинхлорид и холин битартрат используются в пищевых добавках . Битартрат используется чаще из-за его меньшей гигроскопичности. [3] Некоторые соли холина используются в качестве добавки к кормам для кур, индеек и некоторых других животных . Некоторые соли также используются в качестве промышленных химикатов: например, в фотолитографии для удаления фоторезиста . [2] Холин теофиллинат и холин салицилат используются в качестве лекарств, [2] [45] а также структурных аналогов , таких как метахолин и карбахол . [46] Радиоактивно меченые холины, такие как 11 C-холин , используются в медицинской визуализации . [47] Другие коммерчески используемые соли включают трихолин цитрат и холин бикарбонат . [2]
В 1849 году Адольф Штреккер был первым, кто выделил холин из свиной желчи. [48] [49] В 1852 году Л. Бабо и М. Хиршбрунн извлекли холин из семян белой горчицы и назвали его синкалином . [49] В 1862 году Штреккер повторил свой эксперимент со свиной и бычьей желчью, впервые назвав вещество холином по греческому слову , обозначающему желчь, chole , и определив его с химической формулой C5H13NO . [50] [12] В 1850 году Теодор Николас Гобли извлек из мозгов и икры карпов вещество, которое он назвал лецитином по греческому слову, обозначающему яичный желток , lekithos , показав в 1874 году, что это была смесь фосфатидилхолинов . [51] [52]
В 1865 году Оскар Либрайх выделил « нейрин » из мозга животных. [53] [12] Структурные формулы ацетилхолина и «нейрина» Либрайха были определены Адольфом фон Байером в 1867 году. [54] [49] Позже в том же году было показано, что «нейрин» и синкалин являются теми же веществами, что и холин Штрекера. Таким образом, Байер был первым, кто определил структуру холина. [55] [56] [49] Соединение, которое теперь известно как нейрин, не имеет отношения к холину. [12]
В начале 1930-х годов Чарльз Бест и его коллеги отметили, что жировую дистрофию печени у крыс на специальной диете и собак, больных диабетом, можно предотвратить, кормя их лецитином [12], доказав в 1932 году, что холин в лецитине был единственным, кто отвечал за этот профилактический эффект. [57] В 1998 году Национальная академия медицины США опубликовала свои первые рекомендации по холину в рационе человека. [58]
В этом Мнении Группа рассматривает пищевой холин, включая соединения холина (например, глицерофосфохолин, фосфохолин, фосфатидилхолин, сфингомиелин).
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )