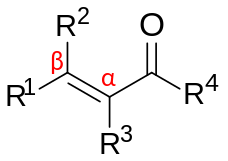
α,β-Ненасыщенные карбонильные соединения представляют собой органические соединения общего строения (O=CR)−Cα = Cβ - R. [1] [2] К таким соединениям относятся еноны и энали , а также карбоновые кислоты и соответствующие сложные эфиры и амиды. В этих соединениях карбонильная группа сопряжена с алкеном (отсюда и прилагательное ненасыщенный ). В отличие от карбонилов без фланкирующей алкеновой группы, α,β-ненасыщенные карбонильные соединения подвержены атаке нуклеофилов по β-углероду. Такая модель реактивности называется винилологической . Примерами ненасыщенных карбонилов являются акролеин (пропеналь), оксид мезитила , акриловая кислота и малеиновая кислота . Ненасыщенные карбонилы можно получить в лаборатории с помощью альдольной реакции и реакции Перкина .
α,β-Ненасыщенные карбонильные соединения можно разделить на подклассы в зависимости от природы карбонильных и алкеновых групп.

α,β-Ненасыщенные карбонильные соединения, содержащие карбонил, сопряженный с концевым или виниловым алкеном , содержат акрилоильную группу ( H 2 C =CH-C(= O )-); это ацильная группа, полученная из акриловой кислоты . Предпочтительное название группы по ИЮПАК — проп-2-еноил , оно также известно как акрилил или просто (и неправильно) как акрил . Соединения, содержащие акрилоильную группу, можно назвать «акриловыми соединениями».
α ,β-ненасыщенная кислота — это тип α,β-ненасыщенного карбонильного соединения, которое состоит из алкена , сопряженного с карбоновой кислотой . [3] Самый простой пример – акриловая кислота (CH 2 =CHCO 2 H). Эти соединения склонны к полимеризации, что приводит к образованию полиакрилатных пластиков большой площади. Акрилатные полимеры происходят из акрилатной группы, но не содержат ее. [4] Карбоксильная группа акриловой кислоты может реагировать с аммиаком с образованием акриламида или со спиртом с образованием сложного эфира акрилата . Акриламид и метилакрилат являются коммерчески важными примерами α,β-ненасыщенных амидов и α,β-ненасыщенных сложных эфиров соответственно. Они также легко полимеризуются. Акриловая кислота, ее эфиры и ее амидные производные содержат акрилоильную группу.
Также распространены α,β-ненасыщенные дикарбонилы . Исходными соединениями являются малеиновая кислота и изомерная фумаровая кислота . Малеиновая кислота образует сложные эфиры, имид и ангидрид, то есть диэтилмалеат , малеимид и малеиновый ангидрид . Фумаровая кислота, как и фумарат, является промежуточным продуктом цикла лимонной кислоты Кребса , который имеет большое значение в биоэнергетике.
Енон (или алкенон ) представляет собой органическое соединение, содержащее как алкеновые , так и кетоновые функциональные группы. В α,β-ненасыщенном еноне алкен сопряжен с карбонильной группой кетона. [3] Самый простой енон – метилвинилкетон (бутенон, CH 2 =CHCOCH 3 ). Еноны обычно получают с помощью альдольной конденсации или конденсации Кнёвенагеля . Некоторые коммерчески значимые еноны, полученные конденсацией ацетона , представляют собой оксид мезитила ( димер ацетона), а также форон и изофорон ( тримеры ). [5] В перегруппировке Мейера-Шустера исходным соединением является пропаргиловый спирт . Другой метод доступа к α,β-ненасыщенным карбонилам — удаление селеноксида . Циклические еноны можно получить по реакции Паусона-Ханда .

Циклические еноны включают циклопропенон , циклобутенон, [6] циклопентенон , циклогексенон и циклогептенон. [7]
Эналь (или алкеналь ) представляет собой органическое соединение, содержащее как алкеновые , так и альдегидные функциональные группы. В α,β-ненасыщенном енале алкен сопряжен с карбонильной группой альдегида (формильной группой). [3] Простейшим эналем является акролеин (CH 2 =CHCHO). Другие примеры включают цис -3-гексеналь (эссенция скошенных газонов) и коричный альдегид (эссенция корицы).
α,β-Ненасыщенные карбонилы электрофильны как по карбонильному углероду, так и по β-углероду. В зависимости от условий любой сайт подвергается атаке нуклеофилов . Присоединения к алкену называются сопряженными присоединениями . Одним из типов конъюгатного присоединения является присоединение по Михаэлю , которое коммерчески используется при превращении мезитилоксида в изофорон . Благодаря расширенному сопряжению α,β-ненасыщенные карбонилы склонны к полимеризации. В промышленных масштабах в полимеризации преобладает использование α,β-ненасыщенных карбонилов. Опять же из-за своего электрофильного характера алкеновая часть α,β-ненасыщенных карбонилов является хорошими диенофилами в реакциях Дильса-Альдера . В дальнейшем они могут быть активированы кислотами Льюиса, которые связывают карбонильный кислород. α,β-Ненасыщенные карбонилы являются хорошими лигандами для комплексов низковалентных металлов, примерами которых являются Fe(bda)(CO) 3 и трис(дибензилиденацетон)дипалладий(0) .
α,β-Ненасыщенные карбонилы легко гидрируются. Гидрирование может избирательно воздействовать на карбонил или алкен ( восстановление конъюгата ) или на обе функциональные группы.
Еноны подвергаются реакции циклизации Назарова и реакции Раухута – Карриера (димеризации).
α,β-Ненасыщенные тиоэфиры являются промежуточными продуктами в нескольких ферментативных процессах. Двумя яркими примерами являются кумароил-кофермент А и кротонил-кофермент А. Они возникают под действием ацил-КоА-дегидрогеназ . [8] Флавинадениндинуклеотид (ФАД) является обязательным кофактором.

Поскольку α,β-ненасыщенные соединения являются электрофилами и алкилирующими агентами, многие α,β-ненасыщенные карбонильные соединения токсичны. Эндогенное соединение-поглотитель глутатион естественным образом защищает организм от токсичных электрофилов. Некоторые препараты (амифостин, N -ацетилцистеин ), содержащие тиоловые группы, могут защищать от такого вредного алкилирования.