
Альтернативный сплайсинг , или альтернативный сплайсинг РНК , или дифференциальный сплайсинг , — это альтернативный процесс сплайсинга во время экспрессии гена, который позволяет одному гену производить различные варианты сплайсинга. Например, некоторые экзоны гена могут быть включены в конечный продукт РНК гена или исключены из него. [1] Это означает, что экзоны соединяются в различных комбинациях, что приводит к различным вариантам сплайсинга. В случае генов, кодирующих белки, белки, транслируемые с этих вариантов сплайсинга, могут содержать различия в своей аминокислотной последовательности и в своих биологических функциях (см. рисунок).
Биологически значимый альтернативный сплайсинг происходит как нормальное явление у эукариот , где он увеличивает количество белков, которые могут быть закодированы геномом. [1] У людей широко распространено мнение, что ~95% многоэкзонных генов подвергаются альтернативному сплайсингу для получения функциональных альтернативных продуктов из того же гена [2], но многие ученые полагают, что большинство наблюдаемых вариантов сплайсинга обусловлены ошибками сплайсинга, а фактическое количество биологически значимых альтернативно сплайсированных генов намного ниже. [3] [4]
Альтернативный сплайсинг был впервые обнаружен в 1977 году. [ 5] [6] Аденовирус производит пять первичных транскриптов в начале своего инфекционного цикла, до репликации вирусной ДНК, и еще один позже, после начала репликации ДНК. Ранние первичные транскрипты продолжают производиться после начала репликации ДНК. Дополнительный первичный транскрипт, произведенный на поздней стадии инфекции, является большим и происходит из 5/6 генома аденовируса размером 32 кб. Это намного больше, чем любая из отдельных мРНК аденовируса, присутствующих в инфицированных клетках. Исследователи обнаружили, что первичный транскрипт РНК, произведенный аденовирусом типа 2 в поздней фазе, был сплайсирован многими различными способами, в результате чего мРНК кодировали различные вирусные белки. Кроме того, первичный транскрипт содержал несколько сайтов полиаденилирования , что давало различные 3'-концы для обработанных мРНК. [7] [8] [9]
В 1981 году был охарактеризован первый пример альтернативного сплайсинга в транскрипте нормального эндогенного гена. [7] Было обнаружено, что ген, кодирующий гормон щитовидной железы кальцитонин, подвергается альтернативному сплайсингу в клетках млекопитающих. Первичный транскрипт этого гена содержит 6 экзонов; мРНК кальцитонина содержит экзоны 1–4 и заканчивается после сайта полиаденилирования в экзоне 4. Другая мРНК образуется из этой пре-мРНК путем пропуска экзона 4 и включает экзоны 1–3, 5 и 6. Она кодирует белок, известный как CGRP ( пептид, связанный с геном кальцитонина ). [10] [11] Примеры альтернативного сплайсинга в транскриптах генов иммуноглобулина у млекопитающих также наблюдались в начале 1980-х годов. [7] [12]
С тех пор у эукариот было обнаружено множество других примеров биологически значимого альтернативного сплайсинга. [1] «Рекордсменом» по альтернативному сплайсингу является ген D. melanogaster , называемый Dscam , который потенциально может иметь 38 016 вариантов сплайсинга. [13]
В 2021 году было обнаружено, что геном аденовируса типа 2, аденовируса, в котором впервые был идентифицирован альтернативный сплайсинг, способен производить гораздо большее разнообразие вариантов сплайсинга, чем считалось ранее. [14] Используя технологию секвенирования следующего поколения, исследователи смогли обновить транскриптом человеческого аденовируса типа 2 и задокументировать наличие 904 вариантов сплайсинга, произведенных вирусом через сложную схему альтернативного сплайсинга. Было показано, что очень немногие из этих вариантов сплайсинга являются функциональными, и авторы поднимают этот вопрос в своей статье.


Обычно признают пять основных режимов альтернативного сплайсинга. [1] [2] [16] [15]
В дополнение к этим основным способам альтернативного сплайсинга, существуют два других основных механизма, с помощью которых различные мРНК могут быть получены из одного и того же гена: множественные промоторы и множественные сайты полиаденилирования . Использование множественных промоутеров правильно описывается как механизм регуляции транскрипции, а не альтернативный сплайсинг; начиная транскрипцию в разных точках, можно получить транскрипты с разными 5'-большинством экзонов. С другой стороны, множественные сайты полиаденилирования обеспечивают различные 3'-концевые точки для транскрипта. Оба эти механизма встречаются в сочетании с альтернативным сплайсингом и обеспечивают дополнительное разнообразие в мРНК, полученных из гена. [1] [16]

Эти режимы описывают основные механизмы сплайсинга, но могут быть неадекватны для описания сложных событий сплайсинга. Например, на рисунке справа показаны 3 формы сплайсинга из гена мышиной гиалуронидазы 3. Сравнение экзонной структуры, показанной в первой строке (зеленая), со структурой во второй строке (желтая) показывает сохранение интрона, тогда как сравнение между второй и третьей формой сплайсинга (желтая против синей) показывает пропуск экзона. Недавно была предложена модельная номенклатура для уникального обозначения всех возможных схем сплайсинга. [15]

Когда пре-мРНК транскрибируется с ДНК , она включает несколько интронов и экзонов . (У нематод среднее значение составляет 4–5 экзонов и интронов; у плодовой мушки дрозофилы может быть более 100 интронов и экзонов в одной транскрибированной пре-мРНК.) Экзоны, которые должны быть сохранены в мРНК, определяются в процессе сплайсинга. Регулирование и выбор участков сплайсинга осуществляются транс-действующими белками-активаторами сплайсинга и репрессорами сплайсинга, а также цис-действующими элементами внутри самой пре-мРНК, такими как экзонные усилители сплайсинга и экзонные сайленсеры сплайсинга.
Типичный эукариотический ядерный интрон имеет консенсусные последовательности, определяющие важные регионы. Каждый интрон имеет последовательность GU на своем 5'-конце. Около 3'-конца находится сайт разветвления. Нуклеотид в точке разветвления всегда представляет собой A; консенсус вокруг этой последовательности несколько варьируется. У людей консенсусная последовательность сайта разветвления представляет собой yUnAy. [18] За сайтом разветвления следует ряд пиримидинов – полипиримидиновый тракт – затем AG на 3'-конце. [16]
Сплайсинг мРНК выполняется комплексом РНК и белка, известным как сплайсосома , содержащим snRNP , обозначенные U1, U2 , U4, U5 и U6 (U3 не участвует в сплайсинге мРНК). [19] U1 связывается с 5' GU, а U2, с помощью белковых факторов U2AF , связывается с точкой ветвления A в пределах участка ветвления. Комплекс на этой стадии известен как комплекс сплайсосомы A. Формирование комплекса A обычно является ключевым шагом в определении концов интрона, который должен быть сплайсингован, и определении концов экзона, который должен быть сохранен. [16] (Номенклатура U происходит от их высокого содержания уридина).
Комплекс U4,U5,U6 связывается, и U6 заменяет позицию U1. U1 и U4 уходят. Оставшийся комплекс затем выполняет две реакции трансэтерификации . В первой трансэтерификации 5'-конец интрона отщепляется от экзона выше по течению и присоединяется к сайту ответвления A с помощью 2',5'- фосфодиэфирной связи. Во второй трансэтерификации 3'-конец интрона отщепляется от экзона ниже по течению, и два экзона соединяются фосфодиэфирной связью. Затем интрон высвобождается в форме лариата и деградирует. [1]

Сплайсинг регулируется транс-действующими белками (репрессорами и активаторами) и соответствующими цис-действующими регуляторными сайтами (глушителями и энхансерами) на пре-мРНК. Однако, как часть сложности альтернативного сплайсинга, отмечается, что эффекты фактора сплайсинга часто зависят от положения. То есть, фактор сплайсинга, который служит активатором сплайсинга при связывании с элементом интронного энхансера, может служить репрессором при связывании со своим элементом сплайсинга в контексте экзона, и наоборот. [20] Вторичная структура транскрипта пре-мРНК также играет роль в регуляции сплайсинга, например, путем объединения элементов сплайсинга или путем маскировки последовательности, которая в противном случае служила бы элементом связывания для фактора сплайсинга. [21] [22] Вместе эти элементы образуют «код сплайсинга», который управляет тем, как будет происходить сплайсинг в различных клеточных условиях. [23] [24]
Существует два основных типа цис-действующих элементов последовательности РНК, присутствующих в пре-мРНК, и им соответствуют транс-действующие РНК-связывающие белки . Сплайсинговые сайленсеры — это сайты, с которыми связываются белки-репрессоры сплайсинга, что снижает вероятность того, что соседний сайт будет использоваться в качестве сплайс-соединения. Они могут быть расположены в самом интроне (интронные сайленсеры сплайсинга, ISS) или в соседнем экзоне ( экзонные сайленсеры сплайсинга , ESS). Они различаются по последовательности, а также по типам белков, которые с ними связываются. Большинство сплайс-репрессоров представляют собой гетерогенные ядерные рибонуклеопротеины (hnRNP), такие как hnRNPA1 и белок, связывающий полипиримидиновый тракт (PTB). [16] [23] Сплайсинговые энхансеры — это сайты, с которыми связываются белки-активаторы сплайсинга, что увеличивает вероятность того, что соседний сайт будет использоваться в качестве сплайс-соединения. Они также могут встречаться в интроне (интронные усилители сплайсинга, ISE) или экзоне ( экзонные усилители сплайсинга , ESE). Большинство белков-активаторов, которые связываются с ISE и ESE, являются членами семейства белков SR . Такие белки содержат мотивы распознавания РНК и домены, богатые аргинином и серином (RS). [16] [23]

В целом, детерминанты сплайсинга работают взаимозависимым образом, который зависит от контекста, так что правила, управляющие тем, как регулируется сплайсинг, формируют код сплайсинга. [24] Наличие определенного цис-действующего элемента последовательности РНК может увеличить вероятность того, что соседний сайт будет сплайсирован в некоторых случаях, но уменьшить вероятность в других случаях, в зависимости от контекста. Контекст, в котором действуют регуляторные элементы, включает цис-действующий контекст, который устанавливается присутствием других особенностей последовательности РНК, и транс-действующий контекст, который устанавливается клеточными условиями. Например, некоторые цис-действующие элементы последовательности РНК влияют на сплайсинг, только если в одном и том же регионе присутствует несколько элементов, чтобы установить контекст. В качестве другого примера, цис-действующий элемент может иметь противоположные эффекты на сплайсинг, в зависимости от того, какие белки экспрессируются в клетке (например, нейрональный или не нейрональный PTB). Адаптивное значение сайленсеров и энхансеров сплайсинга подтверждается исследованиями, показывающими, что в генах человека существует сильный отбор против мутаций, которые производят новые сайленсеры или разрушают существующие энхансеры. [25] [26]

Пре-мРНК из гена dsx D. melanogaster содержат 6 экзонов. У самцов экзоны 1, 2, 3, 5 и 6 соединяются, образуя мРНК, которая кодирует транскрипционный регуляторный белок, необходимый для развития самцов. У самок экзоны 1, 2, 3 и 4 соединяются, и сигнал полиаденилирования в экзоне 4 вызывает расщепление мРНК в этой точке. Полученная мРНК является транскрипционным регуляторным белком, необходимым для развития самок. [27]
Это пример пропуска экзона. Интрон выше экзона 4 имеет полипиримидиновый тракт , который не очень хорошо соответствует консенсусной последовательности , поэтому белки U2AF плохо связываются с ним без помощи активаторов сплайсинга. Этот 3'-акцепторный сайт сплайсинга, следовательно, не используется у самцов. Самки, однако, производят активатор сплайсинга Transformer (Tra) (см. ниже). Белок SR Tra2 вырабатывается у обоих полов и связывается с ESE в экзоне 4; если Tra присутствует, он связывается с Tra2 и вместе с другим белком SR образует комплекс, который помогает белкам U2AF связываться со слабым полипиримидиновым трактом. U2 привлекается к связанной точке ветвления, и это приводит к включению экзона 4 в мРНК. [27] [28]
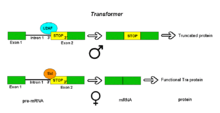
Пре-мРНК гена Transformer (Tra) Drosophila melanogaster подвергаются альтернативному сплайсингу через режим альтернативного акцепторного сайта. Ген Tra кодирует белок, который экспрессируется только у самок. Первичный транскрипт этого гена содержит интрон с двумя возможными акцепторными сайтами. У самцов используется восходящий акцепторный сайт. Это приводит к включению в обработанный транскрипт более длинной версии экзона 2, включая ранний стоп-кодон . Полученная мРНК кодирует укороченный белковый продукт, который неактивен. Самки вырабатывают главный белок определения пола Sex lethal (Sxl). Белок Sxl является репрессором сплайсинга, который связывается с ISS в РНК транскрипта Tra вблизи восходящего акцепторного сайта, предотвращая связывание белка U2AF с полипиримидиновым трактом. Это предотвращает использование этого соединения, сдвигая связывание сплайсосомы на нисходящий акцепторный сайт. Сплайсинг в этой точке обходит стоп-кодон, который вырезается как часть интрона. Полученная мРНК кодирует активный белок Tra, который сам по себе является регулятором альтернативного сплайсинга других генов, связанных с полом (см. dsx выше). [1]

Множественные изоформы белка рецептора Fas производятся путем альтернативного сплайсинга. Две обычно встречающиеся у людей изоформы производятся с помощью механизма пропуска экзона. мРНК, включающая экзон 6, кодирует связанную с мембраной форму рецептора Fas, которая способствует апоптозу или запрограммированной гибели клеток. Повышенная экспрессия рецептора Fas в клетках кожи, хронически подвергающихся воздействию солнца, и отсутствие экспрессии в клетках рака кожи предполагает, что этот механизм может быть важен для устранения предраковых клеток у людей. [29] Если экзон 6 пропускается, полученная мРНК кодирует растворимый белок Fas, который не способствует апоптозу. Включение или пропуск экзона зависит от двух антагонистических белков, TIA-1 и белка, связывающего полипиримидиновый тракт (PTB).
Этот механизм является примером определения экзона в сплайсинге. Сплайсосома собирается на интроне, а субъединицы snRNP сворачивают РНК так, что 5' и 3' концы интрона соединяются. Однако недавно изученные примеры, такие как этот, показывают, что существуют также взаимодействия между концами экзона. В этом конкретном случае эти взаимодействия определения экзона необходимы для того, чтобы обеспечить связывание основных факторов сплайсинга до сборки сплайсосом на двух фланговых интронах. [30]

ВИЧ , ретровирус , вызывающий СПИД у людей, производит один первичный транскрипт РНК, который альтернативно сплайсируется несколькими способами, чтобы произвести более 40 различных мРНК. [31] Равновесие среди дифференциально сплайсированных транскриптов обеспечивает множественные мРНК, кодирующие различные продукты, которые необходимы для размножения вируса. [32] Один из дифференциально сплайсированных транскриптов содержит ген tat , в котором экзон 2 является кассетным экзоном, который может быть пропущен или включен. Включение экзона tat 2 в РНК регулируется конкуренцией между репрессором сплайсинга hnRNP A1 и белком SR SC35. Внутри экзона 2 перекрываются последовательность экзонного сайленсера сплайсинга (ESS) и последовательность экзонного энхансера сплайсинга (ESE). Если белок-репрессор A1 связывается с ESS, он инициирует кооперативное связывание нескольких молекул A1, распространяясь в 5'-донорный сайт выше экзона 2 и предотвращая связывание основного фактора сплайсинга U2AF35 с полипиримидиновым трактом. Если SC35 связывается с ESE, он предотвращает связывание A1 и поддерживает 5'-донорный сайт в доступном состоянии для сборки сплайсосомы. Конкуренция между активатором и репрессором гарантирует, что будут произведены оба типа мРНК (с экзоном 2 и без него). [31]
Настоящий альтернативный сплайсинг происходит как в генах, кодирующих белок, так и в некодирующих генах для производства множественных продуктов (белков или некодирующих РНК). Для того, чтобы решить, какой продукт производить, необходима внешняя информация, учитывая последовательность ДНК и начальный транскрипт. Поскольку методы регуляции наследуются, это дает мутациям новые способы влиять на экспрессию генов. [33]
Альтернативный сплайсинг может обеспечить эволюционную гибкость. Одна точечная мутация может привести к тому, что данный экзон будет иногда исключен или включен в транскрипт во время сплайсинга, что позволит производить новую изоформу белка без потери исходного белка. [1] Исследования выявили внутренне неупорядоченные регионы (см. Внутренне неструктурированные белки ), обогащенные неконститутивными экзонами [34], что предполагает, что изоформы белка могут демонстрировать функциональное разнообразие из-за изменения функциональных модулей в этих регионах. Такое функциональное разнообразие, достигаемое изоформами, отражается в их паттернах экспрессии и может быть предсказано с помощью подходов машинного обучения. [35] [36] Сравнительные исследования показывают, что альтернативный сплайсинг предшествовал многоклеточности в эволюции, и предполагают, что этот механизм мог быть кооптирован для содействия развитию многоклеточных организмов. [37]
Исследования, основанные на проекте «Геном человека» и других методах секвенирования генома, показали, что у людей всего на 30% больше генов, чем у круглого червя Caenorhabditis elegans , и всего в два раза больше, чем у мухи Drosophila melanogaster . Это открытие привело к предположению, что воспринимаемая большая сложность людей или позвоночных в целом может быть связана с более высокими показателями альтернативного сплайсинга у людей, чем у беспозвоночных. [38] [39] Однако исследование образцов из 100 000 экспрессированных последовательностей (EST) каждого из человека, мыши, крысы, коровы, мухи ( D. melanogaster ), червя ( C. elegans ) и растения Arabidopsis thaliana не обнаружило больших различий в частоте альтернативно сплайсированных генов среди людей и любых других протестированных животных. [40] Однако другое исследование предположило, что эти результаты были артефактом различного количества EST, доступных для различных организмов. Сравнив альтернативные частоты сплайсинга в случайных подмножествах генов каждого организма, авторы пришли к выводу, что у позвоночных действительно более высокие показатели альтернативного сплайсинга, чем у беспозвоночных. [41]
Изменения в механизме обработки РНК могут привести к неправильному сплайсингу нескольких транскриптов, в то время как изменения одного нуклеотида в сайтах сплайсинга или цис-действующих регуляторных сайтах сплайсинга могут привести к различиям в сплайсинге одного гена и, таким образом, в мРНК, полученной из транскриптов мутантного гена. Исследование 2005 года, включающее вероятностный анализ, показало, что более 60% мутаций, вызывающих заболевания человека, влияют на сплайсинг, а не напрямую влияют на кодирующие последовательности. [42] Более недавнее исследование показывает, что треть всех наследственных заболеваний, вероятно, имеют компонент сплайсинга. [20] Независимо от точного процента, существует ряд заболеваний, связанных со сплайсингом. [43] Как описано ниже, ярким примером заболеваний, связанных со сплайсингом, является рак.
Аномально сплайсированные мРНК также обнаружены в большой доле раковых клеток. [44] [45] [46] Объединенные анализы РНК-Seq и протеомики выявили поразительную дифференциальную экспрессию изоформ сплайсинга ключевых белков в важных путях рака. [47] Не всегда ясно, способствуют ли такие аберрантные модели сплайсинга раковому росту или являются просто следствием клеточных аномалий, связанных с раком. Для некоторых типов рака, таких как колоректальный и простатический, было показано, что количество ошибок сплайсинга на рак сильно различается между отдельными видами рака, явление, называемое нестабильностью транскриптома . [48] [49] Кроме того, было показано, что нестабильность транскриптома сильно коррелирует со сниженным уровнем экспрессии генов факторов сплайсинга. Было показано, что мутация DNMT3A способствует гематологическим злокачественным новообразованиям , и что клеточные линии с мутацией DNMT3A демонстрируют нестабильность транскриптома по сравнению с их изогенными аналогами дикого типа. [50]
На самом деле, в раковых клетках наблюдается снижение альтернативного сплайсинга по сравнению с нормальными, и типы сплайсинга различаются; например, раковые клетки демонстрируют более высокий уровень удержания интронов, чем нормальные клетки, но более низкий уровень пропуска экзонов. [51] Некоторые из различий в сплайсинге в раковых клетках могут быть связаны с высокой частотой соматических мутаций в генах факторов сплайсинга, [46] а некоторые могут быть результатом изменений в фосфорилировании транс-действующих факторов сплайсинга. [33] Другие могут быть вызваны изменениями в относительном количестве продуцируемых факторов сплайсинга; например, было показано, что клетки рака молочной железы имеют повышенные уровни фактора сплайсинга SF2/ASF . [52] Одно исследование показало, что относительно небольшой процент (383 из более чем 26000) вариантов альтернативного сплайсинга были значительно выше по частоте в опухолевых клетках, чем в нормальных клетках, что позволяет предположить, что существует ограниченный набор генов, которые при неправильном сплайсинге способствуют развитию опухоли. [53] Однако считается, что пагубные эффекты неправильно сплайсированных транскриптов обычно защищаются и устраняются клеточным посттранскрипционным механизмом контроля качества, называемым бессмысленно-опосредованным распадом мРНК [NMD]. [54]
Один из примеров специфического варианта сплайсинга, связанного с раком, находится в одном из генов DNMT человека . Три гена DNMT кодируют ферменты, которые добавляют метильные группы к ДНК, модификация, которая часто имеет регуляторные эффекты. Несколько аномально сплайсированных мРНК DNMT3B обнаружены в опухолях и линиях раковых клеток. В двух отдельных исследованиях экспрессия двух из этих аномально сплайсированных мРНК в клетках млекопитающих вызвала изменения в паттернах метилирования ДНК в этих клетках. Клетки с одной из аномальных мРНК также росли в два раза быстрее контрольных клеток, что указывает на прямой вклад этого продукта в развитие опухоли. [33]
Другим примером является протоонкоген Ron ( MST1R ) . Важным свойством раковых клеток является их способность двигаться и проникать в нормальную ткань. Было обнаружено, что производство аномально сплайсированного транскрипта Ron связано с повышенными уровнями SF2/ASF в клетках рака груди. Аномальная изоформа белка Ron, кодируемая этой мРНК, приводит к подвижности клеток . [52]
Повышенная экспрессия укороченного варианта сплайсинга гена FOSB – ΔFosB – в определенной популяции нейронов в прилежащем ядре была идентифицирована как причинный механизм, участвующий в индукции и поддержании зависимости от наркотиков и естественных вознаграждений . [55] [56] [57] [58]
Недавние провокационные исследования указывают на ключевую функцию структуры хроматина и модификаций гистонов в альтернативной регуляции сплайсинга. Эти идеи предполагают, что эпигенетическая регуляция определяет не только то, какие части генома экспрессируются, но и то, как они сплайсируются. [59]
Анализ транскриптома альтернативного сплайсинга обычно выполняется с помощью высокопроизводительного секвенирования РНК. Чаще всего с помощью секвенирования с коротким считыванием, например, с помощью инструментария Illumina. Но еще более информативным является секвенирование с длинным считыванием, например, с помощью инструментария Nanopore или PacBio. Анализ транскриптома может, например, использоваться для измерения количества отклоняющегося альтернативного сплайсинга, например, в когорте раковых больных. [60]
Технологии глубокого секвенирования использовались для проведения геномного анализа как необработанных, так и обработанных мРНК; таким образом, обеспечивая понимание альтернативного сплайсинга. Например, результаты использования глубокого секвенирования показывают, что у людей, по оценкам, 95% транскриптов из многоэкзонных генов подвергаются альтернативному сплайсингу, при этом ряд пре-мРНК транскриптов сплайсируются тканеспецифичным образом. [2] Функциональная геномика и вычислительные подходы, основанные на множественном обучении , также были разработаны для интеграции данных РНК-секвенирования для прогнозирования функций для альтернативно сплайсированных изоформ. [36] Глубокое секвенирование также помогло в in vivo обнаружении транзитных лариатов , которые высвобождаются во время сплайсинга, определении последовательностей участков ветвления и крупномасштабном картировании точек ветвления в пре-мРНК транскриптах человека. [61]
Исторически альтернативно сплайсированные транскрипты были обнаружены путем сравнения последовательностей EST , но для этого требуется секвенирование очень большого количества EST. Большинство библиотек EST поступают из очень ограниченного числа тканей, поэтому тканеспецифичные варианты сплайсинга, вероятно, будут пропущены в любом случае. Однако были разработаны высокопроизводительные подходы к исследованию сплайсинга, такие как: анализы на основе микрочипов ДНК , анализы связывания РНК и глубокое секвенирование . Эти методы можно использовать для скрининга полиморфизмов или мутаций в элементах сплайсинга или вокруг них, которые влияют на связывание белков. В сочетании с анализами сплайсинга, включая анализы генов-репортеров in vivo , можно проанализировать функциональные эффекты полиморфизмов или мутаций на сплайсинг пре-мРНК транскриптов. [20] [23] [62]
При анализе микрочипов использовались массивы фрагментов ДНК, представляющих отдельные экзоны ( например, микрочип экзонов Affymetrix ) или границы экзон/экзон ( например, массивы от ExonHit или Jivan ). Затем массив зондируется меченой кДНК из интересующих тканей. Зондовые кДНК связываются с ДНК из экзонов, которые включены в мРНК в их исходной ткани, или с ДНК из границы, где были соединены два экзона. Это может выявить присутствие определенных альтернативно сплайсированных мРНК. [63]
CLIP ( перекрестное связывание и иммунопреципитация ) использует УФ-излучение для связывания белков с молекулами РНК в ткани во время сплайсинга. Затем транс-действующий регуляторный белок сплайсинга, представляющий интерес, осаждается с использованием специфических антител. Когда РНК, прикрепленная к этому белку, выделяется и клонируется, она выявляет целевые последовательности для этого белка. [64] Другим методом идентификации РНК-связывающих белков и картирования их связывания с пре-мРНК-транскриптами является «Оценка геномных аптамеров с помощью микроматрицы с помощью сдвига (MEGAshift)».net [65] Этот метод включает адаптацию метода «Систематическая эволюция лигандов путем экспоненциального обогащения (SELEX)» [66] вместе со считыванием на основе микроматрицы. Использование метода MEGAshift позволило лучше понять регуляцию альтернативного сплайсинга, позволяя идентифицировать последовательности в пре-мРНК-транскриптах, окружающих альтернативно сплайсированные экзоны, которые опосредуют связывание с различными факторами сплайсинга, такими как ASF/SF2 и PTB. [67] Этот подход также использовался для определения взаимосвязи между вторичной структурой РНК и связыванием факторов сплайсинга. [22]
Использование репортерных анализов позволяет обнаружить белки сплайсинга, вовлеченные в определенное альтернативное событие сплайсинга, путем конструирования репортерных генов, которые будут экспрессировать один из двух различных флуоресцентных белков в зависимости от происходящей реакции сплайсинга. Этот метод использовался для выделения мутантов, влияющих на сплайсинг, и, таким образом, для идентификации новых регуляторных белков сплайсинга, инактивированных в этих мутантах. [64]
Недавние достижения в области предсказания структуры белка способствовали разработке новых инструментов для аннотации генома и анализа альтернативного сплайсинга. Например, isoform.io, платформа, ориентированная на предсказания структуры белка, оценила сотни тысяч изоформ генов, кодирующих белок человека, собранных из многочисленных экспериментов по секвенированию РНК в различных тканях человека. Этот всесторонний анализ привел к идентификации многочисленных изоформ с более уверенно предсказанной структурой и потенциально превосходящей функцией по сравнению с каноническими изоформами в последней базе данных генов человека. Интегрируя структурные предсказания с экспрессией и эволюционными доказательствами, этот подход продемонстрировал потенциал предсказания структуры белка как инструмента для уточнения аннотации генома человека. [68]
Существует коллекция баз данных альтернативного сплайсинга. [69] [70] [71] Эти базы данных полезны для поиска генов, имеющих пре-мРНК, подвергающиеся альтернативному сплайсингу, и событий альтернативного сплайсинга или для изучения функционального влияния альтернативного сплайсинга.
НА ВАЖНОСТЬ МНОГОЧИСЛЕННЫХ ПСИХОСОЦИАЛЬНЫХ ФАКТОРОВ, В СВОЕЙ СУТИ НАРКОТИЧЕСКАЯ ЗАВИСИМОСТЬ ВКЛЮЧАЕТ В СЕБЯ БИОЛОГИЧЕСКИЙ ПРОЦЕСС: способность многократного воздействия наркотика, вызывающего злоупотребление, вызывать изменения в уязвимом мозге, которые приводят к компульсивному поиску и приему наркотиков, а также к потере контроля над употреблением наркотиков, что определяет состояние зависимости. ... В большом объеме литературы показано, что такая индукция ΔFosB в нейронах NAc типа D1 повышает чувствительность животного к наркотикам, а также к естественным вознаграждениям и способствует самостоятельному приему наркотиков, предположительно, посредством процесса положительного подкрепления.
ΔFosB — это важный фактор транскрипции, участвующий в молекулярных и поведенческих путях зависимости после многократного воздействия наркотиков. Образование ΔFosB в нескольких областях мозга и молекулярный путь, приводящий к образованию комплексов AP-1, хорошо изучены. Установление функционального назначения ΔFosB позволило дополнительно определить некоторые ключевые аспекты его молекулярных каскадов, включающих такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих идентифицированных молекулярных изменений теперь напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия наркотиков (60,95,97,102). Новые рубежи исследований, изучающих молекулярные роли ΔFosB, были открыты эпигенетическими исследованиями, и недавние достижения проиллюстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно как
молекулярный переключатель
(34). В результате нашего улучшенного понимания ΔFosB при наркомании стало возможным оценить аддиктивный потенциал современных лекарств (119), а также использовать его в качестве биомаркера для оценки эффективности терапевтических вмешательств (121,122,124). Некоторые из этих предлагаемых вмешательств имеют ограничения (125) или находятся в зачаточном состоянии (75). Однако есть надежда, что некоторые из этих предварительных результатов могут привести к инновационным методам лечения, которые так необходимы при наркомании.
По этим причинам ΔFosB считается первичным и причинным фактором транскрипции в создании новых нейронных связей в центре вознаграждения, префронтальной коре и других регионах лимбической системы. Это отражается в повышенном, стабильном и длительном уровне чувствительности к кокаину и другим наркотикам, а также в тенденции к рецидиву даже после длительных периодов воздержания. Эти вновь созданные сети функционируют очень эффективно через новые пути, как только наркотики, вызывающие злоупотребление, принимаются снова