
Взаимодействия гликан-белок представляют собой класс биомолекулярных взаимодействий, которые происходят между свободными или связанными с белком гликанами и их родственными партнерами по связыванию. Внутримолекулярные взаимодействия гликан-белок (белок-гликан) происходят между гликанами и белками, к которым они ковалентно присоединены. Вместе с взаимодействиями белок-белок они образуют механистическую основу для многих важных клеточных процессов, особенно для взаимодействий клетка-клетка и взаимодействий хозяин-клетка. [2] Например, SARS-CoV-2 , возбудитель COVID-19 , использует свой обширно гликозилированный спайковый белок (S) для связывания с рецептором ACE2 , что позволяет ему проникать в клетки хозяина. [3] Спайковый белок представляет собой тримерную структуру, каждая субъединица которой содержит 22 участка N-гликозилирования , что делает его привлекательной целью для поиска вакцины . [3] [4]
Гликозилирование, т. е. добавление гликанов (общее название для моносахаридов и олигосахаридов ) к белку, является одной из основных посттрансляционных модификаций белков , способствующих огромной биологической сложности жизни. Действительно, три различных гексозы теоретически могли бы произвести от 1056 до 27 648 уникальных трисахаридов в отличие от всего лишь 6 пептидов или олигонуклеотидов, образованных из 3 аминокислот или 3 нуклеотидов соответственно. [2] В отличие от биосинтеза белка , управляемого шаблоном , «язык» гликозилирования до сих пор неизвестен, что делает гликобиологию горячей темой современных исследований, учитывая их распространенность в живых организмах. [2]
Изучение взаимодействий гликан-белок дает представление о механизмах клеточной сигнализации и позволяет создавать более эффективные диагностические инструменты для многих заболеваний, включая рак . Действительно, не существует известных типов рака, которые не включали бы нерегулярные паттерны гликозилирования белков . [5]
Связывание гликансвязывающих белков (GBP) с гликанами можно смоделировать с помощью простого равновесия . Обозначим гликаны как и белки как :
С соответствующей константой равновесия
Которая перестраивается, чтобы получить константу диссоциации, следуя биохимическим соглашениям:
Учитывая, что многие ГБП демонстрируют многовалентность, эту модель можно расширить для учета множественных равновесий:
Обозначая кумулятивное равновесие связывания с лигандами как
С соответствующей константой равновесия:
И записываем материальный баланс для белка ( обозначает общую концентрацию белка):
Выражая члены через константу равновесия, находим окончательный результат:
Концентрация свободного белка, таким образом, составляет:
Если , т.е. имеется только один домен углеводного рецептора, уравнение сводится к
С увеличением концентрации свободного белка уменьшается, следовательно, уменьшается и кажущееся.

Химическая интуиция предполагает, что участки связывания гликанов могут быть обогащены остатками полярных аминокислот , которые образуют нековалентные взаимодействия , такие как водородные связи , с полярными углеводами. Действительно, статистический анализ карманов связывания углеводов показывает, что остатки аспарагиновой кислоты и аспарагина присутствуют в два раза чаще, чем можно было бы предсказать случайно. [6] Удивительно, но существует еще более сильное предпочтение ароматическим аминокислотам : триптофан имеет 9-кратное увеличение распространенности, тирозин - в 3 раза, а гистидин - в 2 раза. Было показано, что основная сила - это взаимодействие между ароматической системой и углеводом, как показано на рисунке 1. Взаимодействие идентифицируется, если °, расстояние (расстояние от до ) меньше 4,5Å. [6]

Это взаимодействие сильно зависит от стереохимии молекулы углевода . Например, рассмотрим верхнюю ( ) и нижнюю ( ) грани -D-глюкозы и -D-галактозы . Было показано, что одно изменение стереохимии у углерода C4 смещает предпочтение ароматических остатков со стороны (2,7-кратное предпочтение для глюкозы) на сторону (14-кратное предпочтение для галактозы). [6]
Сравнение электростатических поверхностных потенциалов (ESP) ароматических колец в триптофане , тирозине , фенилаланине и гистидине предполагает, что электронные эффекты также играют роль в связывании с гликанами (см. Рисунок 2 ). После нормализации электронной плотности по площади поверхности триптофан по-прежнему остается наиболее богатым электронами акцептором взаимодействий, что указывает на возможную причину его 9-кратного преобладания в карманах связывания углеводов. [6] В целом, карты электростатического потенциала следуют тенденции преобладания .

Существует множество белков, способных связываться с гликанами, включая лектины , антитела , микробные адгезины , вирусные агглютинины и т. д.
Лектины — это общее название белков с доменами, распознающими углеводы (CRD). Хотя оно стало почти синонимом гликансвязывающих белков, оно не включает антитела, которые также относятся к этому классу.
Лектины, обнаруженные в клетках растений и грибов , широко использовались в исследованиях в качестве инструмента для обнаружения, очистки и анализа гликанов. Однако полезные лектины обычно имеют неоптимальную специфичность . Например,Агглютинин-1 Ulex europaeus (UEA-1), лектин, полученный из растений и способный связываться с антигеном первой группы крови человека , может также связываться с неродственными гликанами, такими как 2'-фукозиллактоза, GalNAcα1-4(Fucα1-2)Galβ1-4GlcNAc иантигеном Lewis-Y . [7]
Хотя антитела проявляют наномолярное сродство к белковым антигенам, специфичность против гликанов весьма ограничена. [8] Фактически, доступные антитела могут связывать только <4% из 7000 гликановых антигенов млекопитающих; более того, большинство этих антител имеют низкое сродство и проявляют перекрестную реактивность. [9] [7]
В отличие от челюстных позвоночных , иммунитет которых основан на вариабельных, разнообразных и соединяющихся генных сегментах (VDJ) иммуноглобулинов , бесчелюстные беспозвоночные , такие как минога и миксина , создают разнообразие рецепторов путем соматической перестройки ДНК модулей повторов, богатых лейцином (LRR), которые встроены в гены *vlr* (вариабельные лейкоцитарные рецепторы). [10] Эти LRR образуют трехмерные структуры, напоминающие изогнутые соленоиды , которые избирательно связывают определенные гликаны. [11]
Исследование, проведенное в Университете Мэриленда, показало, что антитела миноги (ламбоди) могут избирательно связываться с опухолеассоциированными углеводными антигенами (такими как Tn и TF ) при наномолярном сродстве. [9] Антиген T-nouvelle (Tn) и TF присутствуют в белках в 90% различных раковых клеток после посттрансляционной модификации , тогда как в здоровых клетках эти антигены гораздо сложнее. Выборка ламбоди, которые могут связываться с aGPA , гликопротеином мембраны эритроцитов человека , покрытым 16 фрагментами TF, посредством магнитно-активируемой сортировки клеток (MACS) и флуоресцентно-активируемой сортировки клеток (FACS), дала богатое лейцином ламбоди VLRB.aGPA.23 . Этот ламбовидный организм селективно окрашивал (по сравнению со здоровыми образцами) клетки 14 различных типов аденокарцином : мочевого пузыря , пищевода , яичника , языка , щек, шейки матки , печени , носа, носоглотки , большого сальника, толстой кишки , молочной железы , гортани и легких . [9] Более того, пациенты, чьи ткани были окрашены положительно с помощью VLRB.aGPA.23, имели значительно меньшую выживаемость. [9]
При внимательном рассмотрении кристаллической структуры VLRB.aGPA.23 обнаруживается остаток триптофана в позиции 187 прямо над карманом связывания углеводов. [12]

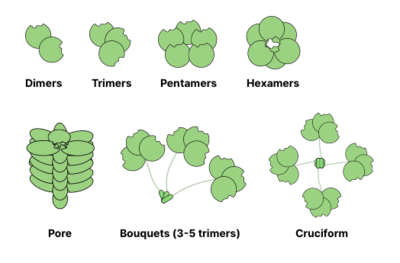
Многие гликансвязывающие белки (GBP) являются олигомерными и обычно содержат несколько участков для связывания гликанов (также называемых доменами распознавания углеводов). Способность образовывать многовалентные взаимодействия белок- лиганд значительно увеличивает прочность связывания: в то время как значения для отдельных взаимодействий CRD-гликан могут находиться в диапазоне мМ, общая аффинность GBP к гликанам может достигать наномолярных или даже пикомолярных диапазонов. Общая прочность взаимодействий описывается как авидность (в отличие от сродства , которое описывает единственное равновесие). Иногда авидность также называют кажущейся , чтобы подчеркнуть неравновесную природу взаимодействия. [13]
Ниже показаны общие структуры олигомеризации лектинов . Например, галектины обычно наблюдаются как димеры, в то время как интелектины образуют тримеры, а пентраксины собираются в пентамеры. Более крупные структуры, такие как гексамерные белки Reg , могут собираться в поры, проникающие в мембрану. Коллектины могут образовывать еще более причудливые комплексы: букеты тримеров или даже крестообразные структуры (например, в SP-D ). [14]
Учитывая важность взаимодействия гликанов и белков, в настоящее время ведутся исследования, посвященные а) созданию новых инструментов для обнаружения взаимодействия гликанов и белков и б) использованию этих инструментов для расшифровки так называемого сахарного кода.
Одним из наиболее широко используемых инструментов для исследования взаимодействий гликанов и белков являются гликановые массивы . Гликановый массив обычно представляет собой стеклянные слайды, активированные NHS или эпоксидной смолой , на которых с помощью роботизированной печати были напечатаны различные гликаны . [15] [16] Эти коммерчески доступные массивы могут содержать до 600 различных гликанов, специфичность которых была тщательно изучена. [17]
Взаимодействия гликан-белок могут быть обнаружены путем тестирования интересующих белков (или библиотек таковых), которые несут флуоресцентные метки . Структура гликан-связывающего белка может быть расшифрована несколькими аналитическими методами, основанными на масс-спектрометрии , включая MALDI-MS , LC-MS , тандемную MS-MS и/или 2D ЯМР . [18]
Вычислительные методы были применены для поиска параметров (например, склонность к остаткам, гидрофобность, планарность), которые могли бы отличать гликан-связывающие белки от других участков поверхности. Например, модель, обученная на 19 негомологичных структурах связывания углеводов, смогла предсказать домены связывания углеводов (CRD) с точностью 65% для неферментативных структур и 87% для ферментативных. [19] Дальнейшие исследования использовали расчеты энергий Ван-дер-Ваальса взаимодействий белок-зонд и склонностей аминокислот для идентификации CRD с 98%-ной специфичностью при 73%-ной чувствительности . [20] Более поздние методы могут предсказывать CRD даже из последовательностей белков , сравнивая последовательность с теми, для которых структуры уже известны. [21]
В отличие от исследований белков, где первичная структура белка однозначно определяется последовательностью нуклеотидов ( генетическим кодом ), гликобиология все еще не может объяснить, как определенное «сообщение» кодируется с помощью углеводов или как оно «считывается» и «переводится» другими биологическими объектами.
Междисциплинарное исследование, объединяющее химию, биологию и биохимию, изучает взаимодействие гликанов и белков, чтобы увидеть, как различные последовательности углеводов инициируют различные клеточные реакции. [22]
{{cite book}}: CS1 maint: DOI неактивен по состоянию на сентябрь 2024 г. ( ссылка ){{cite book}}: CS1 maint: DOI неактивен по состоянию на сентябрь 2024 г. ( ссылка )