
Ячейка Даниэля — тип электрохимической ячейки , изобретенной в 1836 году Джоном Фредериком Дэниэлом , британским химиком и метеорологом , и состоит из медного горшка, наполненного раствором сульфата меди (II) , в который погружен неглазурованный глиняный сосуд , наполненный серной кислотой. кислота и цинковый электрод. Он искал способ устранить проблему водородных пузырей, обнаруженную в гальванической батарее , и его решение заключалось в использовании второго электролита для поглощения водорода, вырабатываемого первым. Серную кислоту можно заменить сульфатом цинка . Элемент Даниэля представлял собой значительное улучшение по сравнению с существующей технологией, использовавшейся на заре разработки аккумуляторов . Более поздний вариант ячейки Даниэля, названный гравитационной ячейкой или ячейкой «гусиной лапки», был изобретен в 1860-х годах французом по имени Калло и стал популярным выбором для электрической телеграфии .
Ячейка Даниэля также является исторической основой современного определения вольта , который является единицей электродвижущей силы в Международной системе единиц . Определения электрических единиц, предложенные на Международной конференции электриков 1881 года , были разработаны таким образом, что электродвижущая сила элемента Даниэля составляла около 1,0 вольт. [1] [2] Согласно современным определениям, стандартный потенциал элемента Даниэля при 25 °C (77 °F) фактически составляет 1,10 В. [3]
В ячейке Даниэля медный и цинковый электроды погружены в раствор сульфата меди(II) и сульфата цинка соответственно.

На аноде (отрицательном электроде) цинк окисляется по следующей полуреакции:
На катоде (положительном электроде) медь восстанавливается по следующей реакции:
Обратите внимание, что положительно заряженные ионы меди движутся к положительному электроду за счет уменьшения химической энергии.
Суммарная реакция:
Эти процессы приводят к накоплению твердой меди на катоде и коррозии цинкового электрода в раствор в виде катионов цинка.

В демонстрациях в классе часто используется форма ячейки Даниэля, известная как две полуячейки, из-за ее простоты. Каждая из двух полуэлементов поддерживает половину реакций, описанных выше. Два электрода можно соединить проводом и лампочкой . Избыточные электроны , образующиеся в результате окисления металлического цинка, «выталкиваются» из анода, который, следовательно, является отрицательным электродом, проходят через провод и «втягиваются» в медный катод, где они поглощаются за счет восстановления ионов меди. Это обеспечивает электрический ток, который освещает лампочку.
Поскольку ни одна полуреакция не происходит независимо от другой, две полуячейки должны быть соединены таким образом, чтобы ионы могли свободно перемещаться между ними. Для разделения двух растворов можно использовать пористый барьер или керамический диск, обеспечивая при этом поток сульфат-ионов. Когда полуячейки помещаются в два совершенно разных и отдельных контейнера, для соединения двух ячеек часто используется соляной мостик . Солевой мостик обычно содержит высокую концентрацию нитрата калия (соли, которая не оказывает химического влияния на реакцию ни в одной из полуэлементов). В вышеупомянутой влажной камере во время разрядки нитрат-анионы в солевом мостике перемещаются в цинковую полуячейку, чтобы сбалансировать увеличение Zn.2+
ионы. В то же время ионы калия из солевого мостика перемещаются в медную полуячейку, чтобы заменить Cu2+
ионы осаждаются на медный электрод.
Если элемент подключен к источнику потенциала (например, зарядному устройству), так что разность потенциалов источника немного выше, чем ЭДС элемента (1,1 В), то ток может быть изменен на противоположный, и реакция будет такой:
или,
Следовательно, ячейка Даниэля является обратимой, если ток, потребляемый из нее (или подаваемый в нее), мал. Ячейку Даниэля можно использовать для «генерации» электроэнергии путем потребления электрода или для хранения электроэнергии.

Дэниел впервые построил свою камеру в 1836 году. [6] Его первоначальная конструкция представляла собой медный цилиндр диаметром 3,5 дюйма. Поперек утопленного сверху цилиндра располагался медный диск, продырявленный многочисленными отверстиями. Трубка из бычьего пищевода свисала с большого отверстия в центре перфорированного медного диска. Внутри этой трубки из бычьего пищевода, подвешенной на деревянных опорах, висел цинковый стержень диаметром 0,5 дюйма. Медный сосуд заполняли раствором серной кислоты , насыщенным сульфатом меди, до уровня выше уровня перфорированного диска. Бычье пищеводную трубку заполняли раствором серной кислоты. Кристаллы медного купороса складывали на перфорированный медный диск, чтобы раствор оставался насыщенным. Бычий пищевод действует как пористая мембрана, позволяющая проходить ионам. Дэниел утверждает, что для удобства вместо бычьего пищевода можно использовать пористую глиняную трубку, но такое устройство будет производить меньшую мощность. Другое предложение Дэниела по улучшению элемента заключалось в замене меди платиной, а сульфата меди хлоридом платины , но он отмечает, что «такая конструкция была бы идеальной, но слишком дорогой для обычных применений». [7] Именно пористая форма ячейки стала широко использоваться в телеграфии.

Пористая ячейка горшка состоит из центрального цинкового анода, погруженного в пористый глиняный горшок, содержащий раствор сульфата цинка. Пористый горшок, в свою очередь, погружается в раствор сульфата меди, содержащийся в медной банке, [ необходимо уточнение ] , который действует как катод элемента. Использование пористого барьера позволяет ионам проходить сквозь него, но предотвращает смешивание растворов. Без этого барьера, когда ток не подается, ионы меди будут дрейфовать к цинковому аноду и восстанавливаться без образования тока, что сократит срок службы батареи. [8] Замена серной кислоты сульфатом цинка была изобретением Дж. Ф. Фуллера в 1853 году. Она продлевает жизнь клетки. [9]
Со временем накопление меди закупорит поры глиняного барьера и сократит срок службы батареи. Тем не менее, элемент Даниэля обеспечивает более длительный и более надежный ток, чем Вольтов столб, поскольку электролит откладывает на катоде медь, которая является проводником , а не водород, который является изолятором . Это также более безопасно и менее коррозионно. При рабочем напряжении примерно 1,1 вольт он широко использовался в телеграфных сетях, пока в конце 1860-х годов его не вытеснил элемент Лекланше . [10]
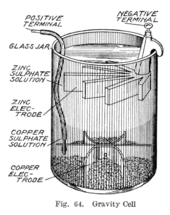
Где-то в 1860-х годах француз по имени Калло изобрел вариант ячейки Даниэля, в котором не использовался пористый барьер. [10] Вместо этого слой сульфата цинка находится поверх слоя сульфата меди. Эти две жидкости хранятся отдельно из-за их разной плотности, часто с добавлением слоя масла сверху для предотвращения испарения. Это уменьшает внутреннее сопротивление системы и, таким образом, батарея выдает более сильный ток.
Этот вариант, называемый гравитационной ячейкой, состоит из стеклянной банки, в которой на дне находится медный катод, а под краем в слое сульфата цинка подвешен цинковый анод. Кристаллы медного купороса рассыпаются вокруг катода, а затем сосуд наполняется дистиллированной водой. При прохождении тока вверху вокруг анода образуется слой раствора сульфата цинка. Этот верхний слой отделен от нижнего слоя сульфата меди из-за его более низкой плотности и полярности ячейки. Недостатком гравитационной ячейки является то, что необходимо постоянно создавать ток, чтобы предотвратить смешивание двух растворов путем диффузии, поэтому она непригодна для периодического использования. Кроме того, он был уязвим для потери целостности, если подается слишком большой электрический ток , что также приводит к перемешиванию слоев.
Эта конструкция, которую иногда называют элементом «гусиная лапка» из-за отличительной формы электродов, является менее дорогостоящей для больших многоэлементных батарей и быстро стала предпочтительной батареей для американских и британских телеграфных сетей. Даже после того, как большинство телеграфных линий начали питаться от мотор-генераторов, гравитационные батареи продолжали использоваться на промежуточных станциях для питания местной сети, по крайней мере, до 1950-х годов. [11] В телеграфной промышленности эту батарею часто собирали на месте сами телеграфисты, а когда она разряжалась, ее можно было обновить путем замены израсходованных компонентов. [12] Слой сульфата цинка бесцветен, в отличие от темно-синего слоя сульфата меди, что позволяет технику с первого взгляда определить срок службы батареи. С другой стороны, такая установка означает, что батарею можно использовать только в стационарном приборе, иначе растворы смешаются или прольются.
Вариант клетки Даниэля был изобретен в 1837 году врачом больницы Гая Голдингом Бердом , который использовал гипсовый барьер, чтобы разделить растворы. Эксперименты Берда с этой ячейкой имели определенное значение для новой дисциплины электрометаллургии , но сам Берд не занимался этой областью; его интересом была электротерапия . Неожиданным результатом экспериментов Берда стало осаждение меди на пористом гипсе и в проходящих через него венах без какого-либо контакта с металлическими электродами. Настолько удивительно, что поначалу в это не поверили исследователи-электрохимики, включая Майкла Фарадея . Самому Бёрду пришлось тщательно осмотреть свой аппарат на предмет случайного контакта, возможно, из-за роста медных «усов», прежде чем он убедился в результате. Отложение меди и других металлов отмечалось и раньше, но раньше всегда это было металл на металлическом электроде. [13] [14]
Джон Дэнсер , ливерпульский производитель инструментов, в 1838 году первым воспользовался коммерческими преимуществами уникальных особенностей ячейки Даниэля для меднения. С помощью процесса, который теперь известен как электротипирование, он обнаружил, что может придавать объектам любую желаемую форму, используя пористый барьер в качестве формы. Однако многие другие сделали то же открытие, и в патентном споре с Томасом Спенсером было указано, что Берд имеет приоритет в отношении этого принципа. Заслугу изобретения электротипирования обычно приписывают русскому Морицу фон Якоби . [13]