
Плазмида — это небольшая внехромосомная молекула ДНК внутри клетки, которая физически отделена от хромосомной ДНК и может реплицироваться независимо. Чаще всего они встречаются в виде небольших кольцевых двухцепочечных молекул ДНК у бактерий ; однако плазмиды иногда присутствуют у архей и эукариотических организмов . [1] [2] Плазмиды часто несут полезные гены, например, гены устойчивости к антибиотикам . В то время как хромосомы большие и содержат всю необходимую генетическую информацию для жизни в нормальных условиях, плазмиды обычно очень маленькие и содержат дополнительные гены для особых обстоятельств.
Искусственные плазмиды широко используются в качестве векторов в молекулярном клонировании , служащих для управления репликацией рекомбинантных последовательностей ДНК в организмах-хозяевах. В лаборатории плазмиды могут быть введены в клетку посредством трансформации . Синтетические плазмиды доступны для приобретения через Интернет. [3] [4] [5]
Плазмиды считаются репликонами , единицами ДНК, способными автономно реплицироваться в пределах подходящего хозяина. Однако плазмиды, как и вирусы , обычно не классифицируются как жизнь . [6] Плазмиды передаются от одной бактерии к другой (даже другого вида) в основном посредством конъюгации . [7] Этот перенос генетического материала от хозяина к хозяину является одним из механизмов горизонтального переноса генов , и плазмиды считаются частью мобилома . В отличие от вирусов, которые заключают свой генетический материал в защитную белковую оболочку, называемую капсидом , плазмиды представляют собой «голую» ДНК и не кодируют гены, необходимые для заключения генетического материала в оболочку для передачи новому хозяину; однако некоторые классы плазмид кодируют конъюгативный «половой» пилус, необходимый для их собственного переноса. Плазмиды различаются по размеру от 1 до более 400 тыс. п. н. , [8] а количество идентичных плазмид в одной клетке может варьироваться от одной до тысяч.
Термин плазмида был введен в 1952 году американским молекулярным биологом Джошуа Ледербергом для обозначения «любого внехромосомного наследственного детерминанта». [9] Первоначальное использование термина включало любой бактериальный генетический материал, который существует внехромосомно, по крайней мере, в течение части его цикла репликации, но поскольку это описание включает бактериальные вирусы, понятие плазмиды со временем было уточнено для обозначения генетических элементов, которые воспроизводятся автономно. [10] Позже, в 1968 году, было решено, что термин плазмида следует принять в качестве термина для внехромосомного генетического элемента, [11] и чтобы отличить его от вирусов, определение было сужено до генетических элементов, которые существуют исключительно или преимущественно вне хромосомы и могут реплицироваться автономно. [10]

Для того чтобы плазмиды могли независимо реплицироваться внутри клетки, они должны обладать участком ДНК, который может выступать в качестве источника репликации . Самореплицирующаяся единица, в данном случае плазмида, называется репликоном . Типичный бактериальный репликон может состоять из ряда элементов, таких как ген специфичного для плазмиды белка инициации репликации (Rep), повторяющиеся единицы, называемые итеронами , боксы DnaA и прилегающая область, богатая AT. [10] Меньшие плазмиды используют репликативные ферменты хозяина для создания своих копий, в то время как более крупные плазмиды могут нести гены, специфичные для репликации этих плазмид. Несколько типов плазмид также могут встраиваться в хромосому хозяина, и эти интегративные плазмиды иногда называют эписомами у прокариот . [12]
Плазмиды почти всегда несут по крайней мере один ген. Многие из генов, переносимых плазмидой, полезны для клеток-хозяев, например: позволяя клетке-хозяину выживать в среде, которая в противном случае была бы летальной или ограничивающей рост. Некоторые из этих генов кодируют признаки устойчивости к антибиотикам или тяжелым металлам, в то время как другие могут производить факторы вирулентности , которые позволяют бактерии колонизировать хозяина и преодолевать его защиту или иметь определенные метаболические функции, которые позволяют бактерии использовать определенное питательное вещество, включая способность разлагать неподатливые или токсичные органические соединения. [13] Плазмиды также могут обеспечивать бактерии способностью фиксировать азот . Однако некоторые плазмиды не оказывают наблюдаемого эффекта на фенотип клетки-хозяина, или их польза для клеток-хозяев не может быть определена, и эти плазмиды называются криптическими плазмидами. [14]
Природные плазмиды сильно различаются по своим физическим свойствам. Их размер может варьироваться от очень маленьких мини-плазмид размером менее 1 килопар оснований (кбп) до очень больших мегаплазмид размером в несколько мегапар оснований (Мбп). На верхнем конце мегаплазмида и минихромосома мало чем отличаются . Плазмиды, как правило, кольцевые, но известны также примеры линейных плазмид. Эти линейные плазмиды требуют специализированных механизмов для репликации своих концов. [10]
Плазмиды могут присутствовать в отдельной клетке в различном количестве, от одной до нескольких сотен. Нормальное количество копий плазмиды, которое может быть обнаружено в одной клетке, называется числом копий плазмиды и определяется тем, как регулируется инициация репликации, и размером молекулы. Более крупные плазмиды, как правило, имеют меньшее число копий. [12] Плазмиды с малым числом копий, которые существуют только в виде одной или нескольких копий в каждой бактерии, при делении клетки подвергаются опасности быть потерянными в одной из разделяющихся бактерий. Такие однокопийные плазмиды имеют системы, которые пытаются активно распространять копию в обе дочерние клетки. Эти системы, которые включают систему parABS и систему parMRC , часто называют системой разделения или функцией разделения плазмиды. [15]
Плазмиды линейной формы неизвестны среди фитопатогенов , за исключением одного Rhodococcus fascians . [16]

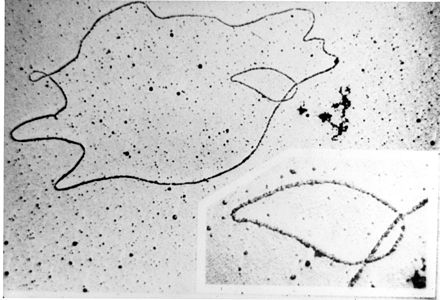

Плазмиды можно классифицировать несколькими способами. Плазмиды можно в целом классифицировать на конъюгативные плазмиды и неконъюгативные плазмиды. Конъюгативные плазмиды содержат набор генов переноса , которые способствуют половой конъюгации между различными клетками. [12] В сложном процессе конъюгации плазмиды могут передаваться от одной бактерии к другой через половые пили, кодируемые некоторыми из генов переноса (см. рисунок). [17] Неконъюгативные плазмиды не способны инициировать конъюгацию, поэтому они могут передаваться только с помощью конъюгативных плазмид. Промежуточный класс плазмид мобилизуем и несет только подмножество генов, необходимых для переноса. Они могут паразитировать на конъюгативной плазмиде, перенося с высокой частотой только в ее присутствии. [ необходима цитата ]
Плазмиды также можно классифицировать по группам несовместимости. Микроб может содержать различные типы плазмид, но различные плазмиды могут существовать в одной бактериальной клетке только в том случае, если они совместимы. Если две плазмиды несовместимы, одна или другая быстро исчезнет из клетки. Поэтому различные плазмиды могут быть отнесены к различным группам несовместимости в зависимости от того, могут ли они сосуществовать вместе. Несовместимые плазмиды (принадлежащие к одной и той же группе несовместимости) обычно имеют одинаковые механизмы репликации или разделения и, таким образом, не могут содержаться вместе в одной клетке. [18] [19]
Другой способ классификации плазмид — по функции. Существует пять основных классов:
Плазмиды могут принадлежать к более чем одной из этих функциональных групп.
Хотя большинство плазмид представляют собой двухцепочечные молекулы ДНК, некоторые состоят из одноцепочечной ДНК или преимущественно двухцепочечной РНК . РНК-плазмиды представляют собой неинфекционные внехромосомные линейные репликоны РНК, как инкапсулированные , так и неинкапсулированные, которые были обнаружены в грибах и различных растениях, от водорослей до наземных растений. Во многих случаях, однако, может быть трудно или невозможно четко отличить РНК-плазмиды от РНК-вирусов и других инфекционных РНК. [20]
Хромиды — это элементы, которые существуют на границе между хромосомой и плазмидой, обнаруженные примерно у 10% видов бактерий, секвенированных к 2009 году. Эти элементы несут основные гены и имеют использование кодонов, подобное хромосоме, но при этом используют механизм репликации плазмидного типа, такой как низкокопийный RepABC. В результате в прошлом их по-разному классифицировали как минихромосомы или мегаплазмиды. [21] У Vibrio бактерия синхронизирует репликацию хромосомы и хромида с помощью консервативного соотношения размеров генома. [22]
Искусственно сконструированные плазмиды могут использоваться в качестве векторов в генной инженерии . Эти плазмиды служат важными инструментами в генетических и биотехнологических лабораториях, где они обычно используются для клонирования и амплификации (создание множества копий) или экспрессии определенных генов. [23] Для таких целей на рынке доступно большое количество плазмид. Ген, который должен быть реплицирован, обычно вставляется в плазмиду, которая обычно содержит ряд особенностей для их использования. К ним относятся ген, который придает устойчивость к определенным антибиотикам ( ампициллин чаще всего используется для бактериальных штаммов), начало репликации, позволяющее бактериальным клеткам реплицировать плазмидную ДНК, и подходящий сайт для клонирования (называемый сайтом множественного клонирования ).
Структурную нестабильность ДНК можно определить как ряд спонтанных событий, которые достигают кульминации в непредвиденной перестройке, потере или приобретении генетического материала. Такие события часто вызываются транспозицией мобильных элементов или присутствием нестабильных элементов, таких как неканонические (не-B) структуры. Вспомогательные области, относящиеся к бактериальному остову, могут участвовать в широком спектре явлений структурной нестабильности. Хорошо известные катализаторы генетической нестабильности включают прямые, инвертированные и тандемные повторы, которые, как известно, заметны во многих коммерчески доступных векторах клонирования и экспрессии. [24] Последовательности вставки также могут серьезно влиять на функцию и выход плазмиды, приводя к делециям и перестройкам, активации, подавлению или инактивации экспрессии соседних генов . [25] Следовательно, уменьшение или полное устранение посторонних некодирующих последовательностей остова будет целенаправленно снижать склонность к таким событиям и, следовательно, общий рекомбиногенный потенциал плазмиды. [26] [27]

Плазмиды являются наиболее часто используемыми векторами бактериального клонирования. [28] Эти векторы клонирования содержат сайт, который позволяет вставлять фрагменты ДНК, например, сайт множественного клонирования или полилинкер, который имеет несколько обычно используемых сайтов рестрикции , к которым могут быть лигированы фрагменты ДНК . После вставки интересующего гена плазмиды вводятся в бактерии с помощью процесса, называемого трансформацией . Эти плазмиды содержат селективный маркер , обычно ген устойчивости к антибиотикам, который придает бактериям способность выживать и размножаться в селективной среде роста, содержащей определенные антибиотики. Клетки после трансформации подвергаются воздействию селективной среды, и выжить могут только клетки, содержащие плазмиду. Таким образом, антибиотики действуют как фильтр, отбирая только бактерии, содержащие плазмидную ДНК. Вектор может также содержать другие маркерные гены или репортерные гены для облегчения отбора плазмид с клонированными вставками. Бактерии, содержащие плазмиду, затем можно выращивать в больших количествах, собирать их, а затем выделять интересующую плазмиду, используя различные методы подготовки плазмид .
Вектор клонирования плазмиды обычно используется для клонирования фрагментов ДНК размером до 15 кб . [29] Для клонирования более длинных участков ДНК используются фаг лямбда с удаленными генами лизогении, космиды , бактериальные искусственные хромосомы или искусственные хромосомы дрожжей .
Другое важное применение плазмид — создание большого количества белков. В этом случае исследователи выращивают бактерии, содержащие плазмиду, несущую интересующий ген. Так же, как бактерия производит белки для обеспечения устойчивости к антибиотикам, ее также можно заставить производить большое количество белков из вставленного гена. Это дешевый и простой способ массового производства белка, кодируемого геном, например, инсулина .
Плазмиды также могут использоваться для переноса генов в качестве потенциального лечения в генной терапии , чтобы он мог экспрессировать белок, которого не хватает в клетках. Некоторые формы генной терапии требуют вставки терапевтических генов в предварительно выбранные хромосомные целевые сайты в пределах человеческого генома . Плазмидные векторы являются одним из многих подходов, которые могут быть использованы для этой цели. Нуклеазы цинковых пальцев (ZFN) предлагают способ вызвать сайт-специфический двухцепочечный разрыв в геноме ДНК и вызвать гомологичную рекомбинацию . Плазмиды, кодирующие ZFN, могут помочь доставить терапевтический ген в определенный сайт, чтобы избежать повреждения клеток , мутаций, вызывающих рак, или иммунного ответа . [30]
Плазмиды исторически использовались для генной инженерии эмбриональных стволовых клеток крыс для создания моделей генетических заболеваний у крыс. Ограниченная эффективность методов на основе плазмид исключала их использование для создания более точных моделей человеческих клеток. Однако разработки в области методов рекомбинации аденоассоциированных вирусов и нуклеаз с цинковыми пальцами позволили создать новое поколение изогенных моделей человеческих заболеваний .
Термин «эписома» был введен Франсуа Жакобом и Эли Воллманом в 1958 году для обозначения внехромосомного генетического материала, который может реплицироваться автономно или интегрироваться в хромосому. [31] [32] Однако с тех пор, как этот термин был введен, его использование изменилось, поскольку плазмида стала предпочтительным термином для автономно реплицирующейся внехромосомной ДНК. На симпозиуме 1968 года в Лондоне некоторые участники предложили отказаться от термина «эписома» , хотя другие продолжали использовать этот термин, изменив его значение. [33] [34]
Сегодня некоторые авторы используют эписому в контексте прокариот для обозначения плазмиды, которая способна интегрироваться в хромосому. Интегративные плазмиды могут реплицироваться и стабильно поддерживаться в клетке на протяжении нескольких поколений, но на каком-то этапе они будут существовать как независимая молекула плазмиды. [35] В контексте эукариот термин эписома используется для обозначения неинтегрированной внехромосомной замкнутой кольцевой молекулы ДНК, которая может реплицироваться в ядре. [36] [37] Наиболее распространенными примерами этого являются вирусы, такие как герпесвирусы , аденовирусы и полиомавирусы , но некоторые из них являются плазмидами. Другие примеры включают аберрантные хромосомные фрагменты, такие как двойные минутные хромосомы , которые могут возникать во время искусственных амплификации генов или в патологических процессах (например, трансформация раковых клеток). Эписомы у эукариот ведут себя подобно плазмидам у прокариот в том, что ДНК стабильно поддерживается и реплицируется с клеткой-хозяином. Также могут встречаться цитоплазматические вирусные эписомы (как при поксвирусных инфекциях). Некоторые эписомы, такие как герпесвирусы, реплицируются по механизму катящегося круга , подобно бактериофагам (бактериальным фаговым вирусам). Другие реплицируются посредством двунаправленного механизма репликации ( плазмиды типа Theta ). В любом случае эписомы остаются физически отделенными от хромосом клетки-хозяина. Несколько вирусов рака, включая вирус Эпштейна-Барр и герпесвирус, ассоциированный с саркомой Капоши , сохраняются как латентные, хромосомно отличные эписомы в раковых клетках, где вирусы экспрессируют онкогены , которые способствуют пролиферации раковых клеток. При раке эти эписомы пассивно реплицируются вместе с хромосомами хозяина, когда клетка делится. Когда эти вирусные эписомы инициируют литическую репликацию для генерации множественных вирусных частиц, они, как правило, активируют защитные механизмы клеточного врожденного иммунитета , которые убивают клетку-хозяина.
Некоторые плазмиды или микробные хозяева включают систему зависимости или постсегрегационную систему уничтожения (PSK), например, систему hok/sok (уничтожение хозяина/подавитель уничтожения) плазмиды R1 в Escherichia coli . [38] Этот вариант производит как долгоживущий яд , так и короткоживущий антидот . Несколько типов систем зависимости плазмиды (токсин/антитоксин, основанные на метаболизме, системы ORT) были описаны в литературе [ 39] и использовались в биотехнических (ферментация) или биомедицинских (вакцинная терапия) приложениях. Дочерние клетки, которые сохраняют копию плазмиды, выживают, в то время как дочерняя клетка, которая не может унаследовать плазмиду, умирает или страдает от снижения скорости роста из-за сохраняющегося яда от родительской клетки. Наконец, общая производительность может быть повышена.
Напротив, плазмиды, используемые в биотехнологии, такие как pUC18, pBR322 и производные векторы, практически никогда не содержат систем зависимости токсин-антитоксин, и поэтому их необходимо хранить под давлением антибиотиков, чтобы избежать потери плазмиды.
Дрожжи естественным образом содержат различные плазмиды. Среди них выделяются плазмиды размером 2 мкм — небольшие кольцевые плазмиды, часто используемые для генной инженерии дрожжей, — и линейные плазмиды pGKL из Kluyveromyces lactis , которые отвечают за фенотипы киллера. [40]
Другие типы плазмид часто связаны с векторами клонирования дрожжей, к которым относятся:
Митохондрии многих высших растений содержат самореплицирующиеся , внехромосомные линейные или кольцевые молекулы ДНК, которые считаются плазмидами. Они могут иметь размер от 0,7 до 20 кб. Плазмиды обычно подразделяются на две категории — кольцевые и линейные. [41] Кольцевые плазмиды были выделены и обнаружены во многих различных растениях, причем наиболее изученными являются те, что находятся в Vicia faba и Chenopodium album , и механизм их репликации известен. Кольцевые плазмиды могут реплицироваться с использованием модели репликации θ (как в Vicia faba ) и посредством репликации по типу катящегося кольца (как в C.album ). [42] Линейные плазмиды были обнаружены в некоторых видах растений, таких как Beta vulgaris , Brassica napus , Zea mays и т. д., но встречаются реже, чем их кольцевые аналоги.
Функция и происхождение этих плазмид остаются в значительной степени неизвестными. Было высказано предположение, что кольцевые плазмиды имеют общего предка, некоторые гены в митохондриальной плазмиде имеют аналоги в ядерной ДНК, что предполагает межкомпартментный обмен. Между тем, линейные плазмиды имеют структурные сходства, такие как инвертроны с вирусной ДНК и грибковыми плазмидами, как и грибковые плазмиды, они также имеют низкое содержание GC, эти наблюдения привели к некоторым гипотезам, что эти линейные плазмиды имеют вирусное происхождение или оказались в митохондриях растений через горизонтальный перенос генов от патогенных грибов. [41] [43]
Плазмиды часто используются для очистки определенной последовательности, поскольку их можно легко очистить от остального генома. Для их использования в качестве векторов и для молекулярного клонирования плазмиды часто необходимо изолировать.
Существует несколько методов выделения плазмидной ДНК из бактерий, от miniprep до maxiprep или bulkprep . [23] Первый метод можно использовать для быстрого определения правильности плазмиды в любом из нескольких бактериальных клонов. Выходом является небольшое количество нечистой плазмидной ДНК, которого достаточно для анализа методом рестрикции и для некоторых методов клонирования.
В последнем случае выращиваются гораздо большие объемы бактериальной суспензии, из которых можно выполнить макси-преп. По сути, это масштабированный мини-преп с последующей дополнительной очисткой. Это приводит к относительно большим количествам (несколько сотен микрограмм) очень чистой плазмидной ДНК.
Было создано множество коммерческих наборов для выделения плазмид в различных масштабах, с разной степенью чистоты и автоматизации.
Плазмидная ДНК может появляться в одной из пяти конформаций, которые (для данного размера) проходят с разной скоростью в геле во время электрофореза . Конформации перечислены ниже в порядке электрофоретической подвижности (скорости для данного приложенного напряжения) от самой медленной к самой быстрой:
Скорость миграции небольших линейных фрагментов прямо пропорциональна напряжению, приложенному при низких напряжениях. При более высоких напряжениях более крупные фрагменты мигрируют с непрерывно увеличивающейся, но разной скоростью. Таким образом, разрешение геля уменьшается с ростом напряжения.
При заданном низком напряжении скорость миграции небольших линейных фрагментов ДНК является функцией их длины. Крупные линейные фрагменты (более 20 кб или около того) мигрируют с определенной фиксированной скоростью независимо от длины. Это происходит потому, что молекулы «дышат», при этом основная часть молекулы следует за ведущим концом через гелевую матрицу. Рестрикционные гидролизаты часто используются для анализа очищенных плазмид. Эти ферменты специально разрывают ДНК в определенных коротких последовательностях. Полученные линейные фрагменты образуют «полосы» после гель-электрофореза . Можно очистить определенные фрагменты, вырезая полосы из геля и растворяя гель для высвобождения фрагментов ДНК.
Благодаря своей плотной структуре суперспиральная ДНК мигрирует через гель быстрее, чем линейная или кольцевая ДНК.
Использование плазмид в качестве метода в молекулярной биологии поддерживается программным обеспечением биоинформатики . Эти программы записывают последовательность ДНК плазмидных векторов, помогают предсказывать сайты разрезания рестриктаз и планировать манипуляции. Примерами пакетов программного обеспечения, которые обрабатывают карты плазмид, являются ApE, Clone Manager , GeneConstructionKit, Geneious, Genome Compiler , LabGenius, Lasergene, MacVector , pDraw32, Serial Cloner, VectorFriends, Vector NTI и WebDSV. Эти части программного обеспечения помогают проводить целые эксперименты in silico перед проведением влажных экспериментов. [44]
За эти годы было создано много плазмид, и исследователи предоставили плазмиды в базы данных плазмид, такие как некоммерческие организации Addgene и BCCM/LMBP. В этих базах данных можно найти и запросить плазмиды для исследований. Исследователи также часто загружают последовательности плазмид в базу данных NCBI, из которой можно получить последовательности определенных плазмид.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )