
В органической химии гидроформилирование , также известное как оксосинтез или оксопроцесс , представляет собой промышленный процесс производства альдегидов ( R-CH=O ) из алкенов ( R2C =CR2 ) . [1] [2] Эта химическая реакция влечет за собой чистое присоединение формильной группы ( -CHO ) и атома водорода к двойной связи углерод-углерод . Этот процесс постоянно развивался с момента его изобретения: производственная мощность достигла 6,6 × 106 тонн в 1995 году. Это важно, поскольку альдегиды легко превращаются во многие вторичные продукты. Например, полученные альдегиды гидрируются до спиртов , которые превращаются в моющие средства . Гидроформилирование также используется в специальных химикатах , имеющих отношение к органическому синтезу ароматизаторови фармацевтических препаратов . Развитие гидроформилирования является одним из главных достижений промышленной химии 20-го века .
Этот процесс включает в себя обработку алкена обычно под высоким давлением (от 10 до 100 атмосфер ) монооксидом углерода и водородом при температуре от 40 до 200 ° C. [3] В одном варианте вместо синтез-газа используется формальдегид . [4] Требуются катализаторы на основе переходных металлов . Катализатор неизменно растворяется в реакционной среде, т.е. гидроформилирование является примером гомогенного катализа .
Процесс был открыт немецким химиком Отто Рёленом в 1938 году в ходе исследования процесса Фишера-Тропша . Альдегиды и диэтилкетон были получены при добавлении этилена в реактор ФТ. Благодаря этим исследованиям Ролен обнаружил полезность кобальтовых катализаторов. HCo(CO) 4 , который был выделен всего за несколько лет до работы Рулена, оказался отличным катализатором. [5] [6] Термин «оксосинтез» был придуман патентным отделом Ruhrchemie, который ожидал, что этот процесс будет применим для получения как альдегидов, так и кетонов. Последующие работы показали, что лиганд трибутилфосфин (PBu 3 ) улучшает селективность процесса, катализируемого кобальтом. Механизм сокатализируемого гидроформилирования был объяснен Ричардом Ф. Хеком и Дэвидом Бреслоу в 1960-х годах. [7]
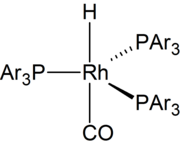
В 1968 г. сообщалось о высокоактивных катализаторах на основе родия. [8] С 1970-х годов большая часть гидроформилирования осуществляется с использованием катализаторов на основе родия . [9] Разработаны водорастворимые катализаторы. Они облегчают отделение продуктов от катализатора. [10]

Ключевым моментом гидроформилирования является соотношение «нормальной» и «изо» селективности . Например, гидроформилирование пропилена может дать два изомерных продукта: бутиральдегид или изобутиральдегид :
Эти изомеры отражают региохимию внедрения алкена по связи M–H. Поскольку оба продукта не одинаково желательны (нормальный изомер более стабилен, чем изомер), много исследований было посвящено поиску катализатора, который благоприятствовал бы нормальному изомеру.
Правилу Марковникова присоединение гидрида кобальта к первичным алкенам противоречит стерическим затруднениям между кобальтовым центром и вторичным алкильным лигандом. Громоздкие лиганды усугубляют это стерическое препятствие. Следовательно, смешанные карбонильно-фосфиновые комплексы обеспечивают большую селективность антимарковниковского присоединения, отдавая предпочтение продуктам с прямой цепью ( n- )альдегидам. Современные катализаторы все больше полагаются на хелатирующие лиганды, особенно дифосфиты. [12]

Кроме того, богатые электронами гидридные комплексы менее протоноподобны. Таким образом, в результате электронные эффекты , которые обычно способствуют присоединению Марковникова к алкену, становятся менее применимыми. Таким образом, богатые электронами гидриды более селективны.
Чтобы подавить конкурирующую изомеризацию алкена, скорость миграционного внедрения карбонила в связь углерод -металл алкила должна быть относительно высокой. Скорость внедрения карбонильного углерода в связь CM, вероятно, будет выше, чем скорость отщепления бета-гидрида. [13]

Гидроформилирование прохиральных алкенов создает новые стереоцентры . Используя хиральные фосфиновые лиганды , гидроформилирование можно настроить в пользу одного энантиомера . [14] [15] Так, например, дексибупрофен , (+)-( S )-энантиомер ибупрофена , может быть получен энантиоселективным гидроформилированием с последующим окислением.
Промышленные процессы различаются в зависимости от длины цепи олефина, подлежащего гидроформилированию, каталитического металла и лигандов, а также степени восстановления катализатора. Оригинальный процесс Ruhrchemie производил пропаналь из этена и синтез-газа с использованием тетракарбонилгидрида кобальта . Сегодня промышленные процессы на основе кобальтовых катализаторов в основном используются для производства олефинов со средней и длинной цепью, тогда как катализаторы на основе родия обычно используются для гидроформилирования пропилена . Родиевые катализаторы значительно дороже кобальтовых. При гидроформилировании олефинов с более высокой молекулярной массой отделение катализатора от образующихся альдегидов затруднено.
Оксо-процесс BASF начинается в основном с высших олефинов и основан на использовании катализатора на основе карбонила кобальта. [16] При проведении реакции при низких температурах наблюдается повышенная селективность в пользу линейного продукта. Процесс проводят при давлении около 30 МПа и в диапазоне температур от 150 до 170 °С. Кобальт извлекают из жидкого продукта окислением до водорастворимого Co 2 + с последующим добавлением водного раствора муравьиной или уксусной кислоты . Этот процесс дает водную фазу кобальта, которую затем можно переработать. Потери компенсируются добавлением солей кобальта. [17]
Процесс Exxon, также оксо-процесс Кульмана или PCUK, используется для гидроформилирования олефинов C6–C12. В основе процесса лежат кобальтовые катализаторы. Для восстановления катализатора к органической фазе добавляют водный раствор гидроксида натрия или карбоната натрия. Путем экстракции олефином и нейтрализации добавлением раствора серной кислоты под давлением монооксида углерода можно восстановить карбонилгидрид металла . Он отделяется с помощью синтез-газа, поглощается олефином и возвращается в реактор. Подобно процессу BASF, процесс Exxon осуществляется при давлении около 30 МПа и температуре от около 160 до 180 °C. [17]
В процессе Shell для гидроформилирования олефинов C7–C14 используются комплексы кобальта, модифицированные фосфиновыми лигандами . Полученные альдегиды непосредственно гидрируются до жирных спиртов , которые отделяются перегонкой , что позволяет повторно использовать катализатор. Этот процесс обладает хорошей селективностью по отношению к линейным продуктам, которые находят применение в качестве сырья для моющих средств . Процесс проводят при давлении около 4–8 МПа и в диапазоне температур около 150–190 °С. [17]
Процесс Union Carbide (UCC), также известный как оксо-процесс низкого давления (LPO), основан на использовании родиевого катализатора, растворенного в высококипящем густом масле, продукте конденсации первичных альдегидов с более высокой молекулярной массой, для гидроформилирования пропена. Реакционную смесь отделяют в испарителе с падающей пленкой от летучих компонентов. Жидкую фазу перегоняют, бутиральдегид удаляют в качестве головного продукта, а катализатор, содержащий кубовый продукт, возвращают в процесс. Процесс проводят при давлении около 1,8 МПа и температуре 95–100 °С. [17]


Процесс Рурхими/Рона-Пуленка (RCRPP) основан на использовании родиевого катализатора с водорастворимым TPPTS в качестве лиганда (катализатор Кунца Корнилса) для гидроформилирования пропена. [ 20] Трисульфирование трифенилфосфанового лиганда придает гидрофильные свойства металлоорганическому комплексу. Каталитический комплекс несет девять сульфонатных групп и хорошо растворим в воде (около 1 кг/л ) , но не в образующейся фазе продукта. [21] Водорастворимый ТППТС используется примерно в 50-кратном избытке, благодаря чему эффективно подавляется выщелачивание катализатора. Реагенты — пропен и синтез-газ, состоящий из водорода и монооксида углерода в соотношении 1,1:1. Образуется смесь бутиральдегида и изобутиральдегида в соотношении 96:4 с небольшим количеством побочных продуктов, таких как спирты, сложные эфиры и высококипящие фракции. [21] Процесс Рурхими/Рона-Пуленка является первой коммерчески доступной двухфазной системой, в которой катализатор присутствует в водной фазе. В ходе реакции образуется фаза органического продукта, которую непрерывно отделяют посредством разделения фаз, при этом водная фаза катализатора остается в реакторе. [21]
Процесс осуществляют в реакторе с мешалкой, где олефин и синтез-газ уносятся из нижней части реактора через фазу катализатора при интенсивном перемешивании. Полученную фазу сырого альдегида отделяют сверху от водной фазы. Водный раствор, содержащий катализатор, повторно нагревают через теплообменник и закачивают обратно в реактор. [21] Избыток олефина и синтез-газа отделяется от альдегидной фазы в отпарной колонне и возвращается обратно в реактор. Вырабатываемое тепло используется для выработки технологического пара, который используется для последующей перегонки органической фазы с разделением на бутиральдегид и изобутиральдегид. [21] Потенциальные каталитические яды, поступающие из синтез-газа, мигрируют в органическую фазу и удаляются из реакции с альдегидом. Таким образом, яды не накапливаются и можно отказаться от сложной тонкой очистки синтез-газа. [21]
В 1984 году в Оберхаузене был построен завод , который был устранен в 1988 году и снова в 1998 году до производственной мощности 500 000 тонн бутаналя в год. Степень конверсии пропена составляет 98%, а селективность по н-бутану высокая. За время эксплуатации партии катализатора в процессе теряется менее 1 миллиардной доли родия. [22]
Разработаны рецепты гидроформилирования в лабораторных масштабах, например, циклогексена . [3] [15]
Карбонильные комплексы кобальта и родия катализируют гидроформилирование формальдегида и оксида этилена с образованием гидроксиацетальдегида и 3-гидроксипропаналя , которые затем можно гидрировать до этиленгликоля и пропан-1,3-диола соответственно. Реакции проходят лучше всего, когда растворитель является основным (например, пиридин ). [23] [24]
В случае использования в качестве катализатора октакарбонила дикобальта или Со 2 (СО) 8 пентан-3-он может образовываться из этилена и СО, в отсутствие водорода. Предлагаемым промежуточным соединением является этилен-пропионильная разновидность [CH 3 C(O)Co(CO) 3 (этен)], которая подвергается миграционной вставке с образованием [CH 3 COCH 2 CH 2 Co(CO) 3 ]. Требуемый водород образуется в результате реакции конверсии воды . Подробнее см. [25]
Если реакция конверсии воды не протекает, в результате реакции образуется полимер, содержащий чередующиеся звенья монооксида углерода и этилена. Такие алифатические поликетоны традиционно получают с использованием палладиевых катализаторов. [26]
Функционализированные олефины, такие как аллиловый спирт, могут быть гидроформилированы. Целевой продукт 1,4-бутандиол и его изомер получают с использованием свободных от изомеризации катализаторов, таких как родий-трифенилфосфиновые комплексы. Использование комплекса кобальта приводит к изомеризации двойной связи в н- пропаналь . [27] Гидроформилирование алкениловых эфиров и алкениловых эфиров обычно происходит в α-положении к эфирной или сложноэфирной функции.
Гидроформилирование акриловой кислоты и метакриловой кислоты в катализируемом родием процессе приводит на первой стадии к продукту Марковникова . [28] Варьируя условия реакции, реакцию можно направить на получение различных продуктов. Высокая температура реакции и низкое давление монооксида углерода способствуют изомеризации продукта Марковникова в термодинамически более стабильный β-изомер, что приводит к н-альдегиду. Низкие температуры и высокое давление монооксида углерода, а также избыток фосфина, блокирующего свободные координационные центры, могут привести к более быстрому гидроформилированию в α-положении к сложноэфирной группе и подавить изомеризацию. [28]
Побочными реакциями алкенов являются изомеризация и гидрирование двойной связи. Хотя алканы, образующиеся в результате гидрирования двойной связи, в дальнейшем в реакции не участвуют, желательной реакцией является изомеризация двойной связи с последующим образованием н-алкильных комплексов. Гидрирование обычно не имеет большого значения; Однако кобальт-фосфин-модифицированные катализаторы могут обладать повышенной активностью гидрирования, при этом гидрируется до 15% алкена.
С использованием тандемного катализа были разработаны системы для однореакторной конверсии акенов в спирты. Первый этап – гидроформилирование. [29]
Условия катализа гидроформилирования могут вызывать деградацию опорных фосфорорганических лигандов. Трифенилфосфин подвергается гидрогенолизу с выделением бензола и дифенилфосфина. Введение оксида углерода в промежуточную связь металл-фенил может привести к образованию бензальдегида или к последующему гидрированию до бензилового спирта . [30] Одна из фенильных групп лигандов может быть заменена на пропен, и образующийся дифенилпропилфосфиновый лиганд может ингибировать реакцию гидроформилирования из-за своей повышенной основности. [30]
Хотя первоначальные катализаторы гидроформилирования были основаны на кобальте, в большинстве современных процессов используется родий, который является дорогим. Поэтому существует интерес к поиску альтернативных металлических катализаторов. Примеры альтернативных металлов включают железо и рутений. [31] [32]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )