
Гистопатология (сочетание трех греческих слов: ἱστός histos «ткань», πάθος pathos «страдание» и -λογία -logia «изучение») — микроскопическое исследование ткани с целью изучения проявлений заболевания . В частности, в клинической медицине гистопатология относится к исследованию биопсии или хирургического образца патологом после того , как образец был обработан и гистологические срезы были помещены на предметные стекла. Напротив, цитопатология исследует свободные клетки или микрофрагменты тканей (как «клеточные блоки»).
Гистопатологическое исследование тканей начинается с хирургического вмешательства , биопсии или вскрытия . Ткань удаляется из тела или растения , а затем, часто после экспертного вскрытия свежего состояния, помещается в фиксатор , который стабилизирует ткани и предотвращает гниение . Наиболее распространенным фиксатором является 10% нейтральный забуференный формалин (что соответствует 3,7% мас./об. формальдегида в нейтральной забуференной воде, такой как фосфатно-солевой буфер ).

Затем ткань подготавливают для просмотра под микроскопом , используя либо химическую фиксацию, либо замороженный срез.
Если предоставляется большой образец, например, после хирургической процедуры, то патологоанатом смотрит на образец ткани и выбирает ту часть, которая с наибольшей вероятностью позволит поставить полезный и точный диагноз - эту часть удаляют для исследования в процессе, обычно известном как сбор или разрезание. Образцы большего размера вырезаются, чтобы правильно расположить их анатомические структуры в кассете. Некоторые образцы (особенно биопсии) могут быть предварительно помещены в агар , чтобы обеспечить правильную ориентацию тканей в кассете, затем в блоке и затем на предметном стекле для диагностической микроскопии. Затем его помещают в пластиковую кассету на протяжении большей части оставшегося процесса. [ нужна цитата ]
Помимо формалина использовались и другие химические фиксаторы. Но с появлением иммуногистохимического окрашивания (ИГХ) и диагностического тестирования молекулярной патологии на этих образцах формалин стал стандартным химическим фиксатором в диагностической гистопатологии человека. Время фиксации очень маленьких образцов короче, и существуют стандарты в диагностической гистопатологии человека.
Вода удаляется из образца на последовательных стадиях путем использования возрастающей концентрации спирта . [1] На последней стадии дегидратации вместо спирта используется ксилол – это связано с тем, что воск, используемый на следующей стадии, растворим в ксилоле , тогда как он не растворяется в спирте, что позволяет воску проникать (инфильтрировать) образец. [1] Этот процесс обычно автоматизирован и выполняется в одночасье. Затем образец, пропитанный воском, переносят в индивидуальный контейнер для заливки образца (обычно металлический). Наконец, расплавленный воск подается вокруг образца в контейнере и охлаждается до затвердевания, чтобы закрепить его в восковом блоке. [1] Этот процесс необходим для получения правильно ориентированного образца, достаточно прочного для получения тонких срезов микротома для предметного стекла.
После того, как блок, залитый воском, будет готов, из него вырезают секции и обычно помещают их плавать на поверхность водяной бани, которая распределяет секцию. Обычно это делается вручную и представляет собой квалифицированную работу (гистотехнолога), при которой персонал лаборатории выбирает, какие части восковой ленты микротома образца разместить на предметных стеклах. Обычно готовится несколько слайдов с разных уровней по всему блоку. После этого предметное стекло, смонтированное на тонком срезе, окрашивают и на него надевают защитное покровное стекло. Для обычных пятен обычно используется автоматический процесс; но редко используемые морилки часто делаются вручную. [1]

Первоначальная оценка подозреваемой лимфомы заключается в проведении «осязательной подготовки», при которой предметное стекло слегка прижимают к иссеченной лимфоидной ткани и затем окрашивают (обычно красителем H&E ) для оценки под световой микроскопией . Второй метод гистологической обработки называется обработкой замороженных срезов . Это высокотехнологичный научный метод, выполняемый опытным ученым-историком. В этом методе ткань замораживается и нарезается тонкими срезами с помощью микротома , установленного в холодильном устройстве с температурой ниже нуля, называемом криостатом . Тонкие замороженные срезы помещают на предметное стекло, немедленно и на короткое время фиксируют жидким фиксатором и окрашивают, используя те же методы окрашивания, что и традиционные срезы, залитые воском. Преимуществами этого метода являются быстрое время обработки, меньшие требования к оборудованию и меньшая потребность в вентиляции в лаборатории. Недостаток – низкое качество итогового слайда. Его используют при интраоперационной патологии для определения, которое может помочь в выборе следующего этапа операции во время хирургического сеанса (например, для предварительного определения чистоты края резекции опухоли во время операции).
Это можно сделать со предметными стеклами, обработанными методом химической фиксации, или со предметными стеклами замороженных срезов. Чтобы увидеть ткань под микроскопом, срезы окрашивают одним или несколькими пигментами . Цель окрашивания – выявить клеточные компоненты; контрастные пятна используются для обеспечения контраста.
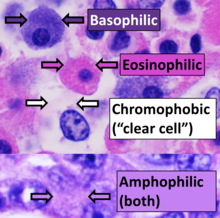
Наиболее часто используемое окрашивание в гистологии представляет собой комбинацию гематоксилина и эозина (часто сокращенно H&E). Гематоксилин используется для окрашивания ядер в синий цвет , тогда как эозин окрашивает цитоплазму и внеклеточный матрикс соединительной ткани большинства клеток в розовый цвет . Существуют сотни различных других методов, которые использовались для выборочного окрашивания клеток. Другие соединения, используемые для окраски срезов тканей, включают сафранин , Oil Red O , конго красный , соли серебра и искусственные красители. Гистохимия относится к науке об использовании химических реакций между лабораторными химикатами и компонентами тканей. Обычно применяемым гистохимическим методом является реакция Перлза «берлинской лазури» , используемая для выявления отложений железа при таких заболеваниях, как гемохроматоз . [2]
В последнее время антитела стали использовать для окрашивания определенных белков , липидов и углеводов . Этот метод, получивший название иммуногистохимии , значительно расширил возможности конкретной идентификации категорий клеток под микроскопом. Другие передовые методы включают гибридизацию in situ для идентификации конкретных молекул ДНК или РНК . Эти методы окрашивания антителами часто требуют использования гистологии замороженных срезов. Вышеуказанные процедуры также выполняются в лаборатории под пристальным вниманием и точностью обученного специалиста-медика-лаборанта (учёного-гистиолога). Цифровые камеры все чаще используются для получения гистопатологических изображений.
Гистологические слайды исследуются под микроскопом патологоанатомом , квалифицированным медицинским специалистом, прошедшим признанную программу обучения. Этот медицинский диагноз формулируется в виде отчета о патологии , описывающего гистологические данные и мнение патологоанатома. В случае рака это представляет собой диагностику тканей , необходимую для большинства протоколов лечения. При удалении рака патологоанатом укажет, очищен ли хирургический край или поражен (оставшийся рак остается). Это делается с использованием метода обработки хлеба или CCPDMA . Микроскопические визуальные артефакты потенциально могут привести к ошибочному диагнозу образцов.
Ниже приведены примеры общих особенностей подозрительных результатов, которые можно оценить при гистопатологии при малом или большом увеличении:
Основные гистопатологические архитектурные закономерности включают:
Основные ядерные модели включают:
После инфаркта миокарда (сердечного приступа) гистопатология не наблюдается в первые ~30 минут. Единственным возможным признаком в первые 4 часа является волнистость волокон на границе. Однако позже начинается коагуляционный некроз с отеком и кровоизлиянием. Через 12 часов наблюдаются кариопикноз и гиперэозинофилия миоцитов с некрозом контракционных полос по краям, а также начало нейтрофильной инфильтрации. На 1-3 сутки продолжается коагуляционный некроз с потерей ядер и исчерченности и повышенной инфильтрацией нейтрофилов в интерстиций. К концу первой недели после инфаркта начинается распад мертвых мышечных волокон, некроз нейтрофилов и начало удаления макрофагами мертвых клеток на границе, что увеличивается в последующие дни. Через неделю также начинается образование грануляционной ткани по краям, которая созревает в течение следующего месяца, увеличивается отложение коллагена и снижается клеточность, пока рубцевание миокарда полностью не созреет примерно через 2 месяца после инфаркта. [3]