Гуанидин — это соединение с формулой HNC(NH 2 ) 2 . Это бесцветное твердое вещество, растворяющееся в полярных растворителях. Это сильное основание , которое используется в производстве пластмасс и взрывчатых веществ . Оно обнаруживается в моче преимущественно у пациентов, страдающих почечной недостаточностью. [4] Фрагмент гуанидина также появляется в более крупных органических молекулах, в том числе в боковой цепи аргинина .
Гуанидин можно рассматривать как азотистый аналог угольной кислоты . То есть, группа C=O в угольной кислоте заменена на группу C=NH, а каждая OH заменена на NH
2группа. [5] Изобутен можно рассматривать как аналог углерода во многом таким же образом. Подробный кристаллографический анализ гуанидина был выяснен спустя 148 лет после его первого синтеза, несмотря на простоту молекулы. [6] В 2013 году положения атомов водорода и их параметры смещения были точно определены с помощью нейтронной дифракции на монокристалле. [7]
Гуанидин может быть получен из природных источников, впервые он был выделен в 1861 году Адольфом Штрекером путем окислительной деградации ароматического природного продукта, гуанина , выделенного из перуанского гуано . [8] [9]
Лабораторным методом получения гуанидина является щадящее (180-190 °С) термическое разложение сухого роданида аммония в безводных условиях:
Коммерческий путь включает двухэтапный процесс, начинающийся с реакции дициандиамида с солями аммония . Через посредничество бигуанидина этот этап аммонолиза дает соли катиона гуанидиния (см. ниже). На втором этапе соль обрабатывается основанием, таким как метоксид натрия . [8]
Соли изотиоурония (S-алкилированные тиомочевины ) реагируют с аминами, образуя соли гуанидиния : [10]
Полученные ионы гуанидиния часто могут быть депротонированы, чтобы получить гуанидин. Этот подход иногда называют синтезом Ратке, в честь его первооткрывателя. после Бернхарда Ратке [11] [12]
Сопряженная кислота называется катионом гуанидиния , ( C(NH
2)+
3). Этот плоский симметричный ион состоит из трех аминогрупп , каждая из которых связана с центральным атомом углерода ковалентной связью порядка 4/3. Это высокостабильный катион +1 в водном растворе благодаря эффективной резонансной стабилизации заряда и эффективной сольватации молекулами воды. В результате его p K aH составляет 13,6 [2] (p K b составляет 0,4), что означает, что гуанидин является очень сильным основанием в воде; в нейтральной воде он существует почти исключительно в виде гуанидиния. В связи с этим большинство производных гуанидина представляют собой соли, содержащие сопряженную кислоту.
Гуанидин можно селективно обнаружить с помощью натриевой соли 1,2-нафтохинон-4-сульфоновой кислоты ( реактив Фолина ) и подкисленной мочевины. [13]
Основной солью, представляющей коммерческий интерес, является нитрат [C( NH
2) 3 ] НЕТ
3. Используется в качестве пропеллента, например, в подушках безопасности .
Со времен Средневековья в Европе гуанидин использовался для лечения диабета в качестве активного антигипергликемического ингредиента французской сирени . Из-за его долгосрочной гепатотоксичности дальнейшие исследования по контролю сахара в крови были приостановлены сначала после открытия инсулина. Более поздняя разработка нетоксичных, безопасных бигуанидов привела к долговременному использованию лекарства первой линии для контроля диабета метформина , представленного в Европе в 1950-х годах и в Соединенных Штатах в 1995 году и теперь назначаемого более чем 17 миллионам пациентов в год в США. [14] [15]
Хлорид гуанидиния [14] является спорным в настоящее время адъювантом в лечении ботулизма . Недавние исследования показали, что некоторые значительные подгруппы пациентов не видят улучшения после введения этого препарата. [16]
Гуанидин существует в протонированной форме, как гуанидиний, в растворе при физиологическом pH.
Хлорид гуанидиния (также известный как гидрохлорид гуанидиния) обладает хаотропными свойствами и используется для денатурации белков. Известно, что хлорид гуанидиния денатурирует белки с линейной зависимостью между концентрацией и свободной энергией разворачивания. В водных растворах, содержащих 6 М хлорида гуанидиния, почти все белки теряют всю свою вторичную структуру и превращаются в беспорядочно скрученные пептидные цепи. Тиоцианат гуанидиния также используется из-за его денатурирующего эффекта на различные биологические образцы.
Недавние исследования показывают, что гуанидиний производится бактериями как токсичный побочный продукт. Чтобы снизить токсичность гуанидиния, бактерии разработали класс транспортеров, известных как экспортеры гуанидиния или белки Gdx, чтобы вытеснять излишки этого иона наружу из клетки. [17] Белки Gdx высокоселективны для гуанидиния и монозамещенных гуанидинильных соединений и разделяют перекрывающийся набор неканонических субстратов с экспортером лекарств EmrE. [18]
Гидроксид гуанидиния является активным ингредиентом некоторых нещелочных выпрямителей волос .
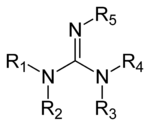
Гуанидины — это группа органических соединений , имеющих общую функциональную группу с общей структурой (R
1Р
2Н)(Р
3Р
4Н)С=Н−Р
5. Центральная связь в этой группе — это связь имина , а группа структурно связана с амидинами и мочевинами. Примерами гуанидинов являются аргинин , триазабициклодецен , сакситоксин и креатин .
Галегин – это изоамиленгуанидин . [19]