В координационной химии , координатная ковалентная связь , [1] также известная как дативная связь , [2] дипольная связь , [1] или координатная связь [3] является разновидностью двухцентровой, двухэлектронной ковалентной связи , в которой два электрона происходят от одного и того же атома . Связывание ионов металлов с лигандами включает этот тип взаимодействия. [4] Этот тип взаимодействия является центральным в теории кислот и оснований Льюиса .
Координационные связи обычно встречаются в координационных соединениях . [5]

Координационная ковалентная связь распространена повсеместно. [6] Во всех металлических аквакомплексах [M(H 2 O) n ] m + связь между водой и катионом металла описывается как координатная ковалентная связь. Взаимодействия металл-лиганд в большинстве металлоорганических соединений и большинстве координационных соединений описываются аналогично.
Термин «диполярная связь» используется в органической химии для таких соединений, как оксиды аминов , электронную структуру которых можно описать в терминах основного амина, отдающего два электрона атому кислорода.
Стрелка → указывает на то, что оба электрона в связи происходят из аминной части . В стандартной ковалентной связи каждый атом вносит один электрон. Поэтому альтернативное описание заключается в том, что амин отдает один электрон атому кислорода, который затем используется с оставшимся неспаренным электроном на атоме азота для образования стандартной ковалентной связи. Процесс переноса электрона от азота к кислороду создает формальные заряды , поэтому электронную структуру можно также изобразить как
Эта электронная структура имеет электрический диполь , отсюда и название полярная связь. В действительности атомы несут частичные заряды ; более электроотрицательный атом из двух, участвующих в связи, обычно будет нести частичный отрицательный заряд. Исключением является оксид углерода . В этом случае атом углерода несет частичный отрицательный заряд, хотя он менее электроотрицателен, чем кислород.
Примером дативной ковалентной связи является взаимодействие молекулы аммиака , основания Льюиса с неподеленной парой электронов на атоме азота, и трифторида бора , кислоты Льюиса , поскольку атом бора имеет неполный октет электронов. При образовании аддукта атом бора приобретает конфигурацию октета.
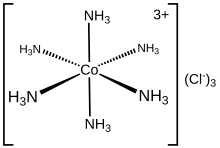
Электронная структура координационного комплекса может быть описана в терминах набора лигандов, каждый из которых отдает пару электронов металлическому центру. Например, в хлориде гексамминкобальта(III) каждый аммиачный лиганд отдает свою неподеленную пару электронов иону кобальта(III). В этом случае образованные связи описываются как координационные связи. В методе классификации ковалентных связей (CBC) лиганды, которые образуют координационные ковалентные связи с центральным атомом, классифицируются как L-тип, тогда как те, которые образуют нормальные ковалентные связи, классифицируются как X-тип.
Во всех случаях связь, будь то датив или «нормальное» электронное разделение, является ковалентной связью. В обычном использовании префикс дипольный, датив или координата просто служит для указания происхождения электронов, используемых при создании связи. Например, F 3 B ← O(C 2 H 5 ) 2 (« бор трифторид (диэтил) эфират ») получается из BF 3 и : O(C 2 H 5 ) 2 , в отличие от радикальных видов [•BF 3 ] – и [•O(C 2 H 5 ) 2 ] + . Датив также удобен с точки зрения обозначений, поскольку избегает формальных зарядов: мы можем записать D : + []A ⇌ D → A, а не D + –A – (здесь : и [] представляют собой неподеленную пару и пустую орбиталь на доноре электронной пары D и акцепторе A соответственно). Эта нотация иногда используется даже тогда, когда кислотно-основная реакция Льюиса является лишь условной (например, сульфоксид R 2 S → O редко, если вообще когда-либо, получается в результате реакции сульфида R 2 S с атомарным кислородом O). Таким образом, большинство химиков не делают никаких заявлений относительно свойств связи при выборе одной нотации вместо другой (формальные заряды против связи со стрелкой).
Однако в целом верно, что связи, изображенные таким образом, являются полярно-ковалентными, иногда сильно, и некоторые авторы утверждают, что существуют реальные различия в свойствах дативной связи и связи с разделением электронов, и предполагают, что показ дативной связи более уместен в определенных ситуациях. Еще в 1989 году Хааланд охарактеризовал дативную связь как связи, которые (i) слабые и длинные; (ii) с лишь небольшой степенью переноса заряда, происходящего во время образования связи; и (iii) чей предпочтительный режим диссоциации в газовой фазе (или инертном растворителе с низким ε) является гетеролитическим, а не гомолитическим. [7] В качестве классического примера приводится аддукт аммиака и борана (H 3 N → BH 3 ): связь слабая, с энергией диссоциации 31 ккал/моль (ср. 90 ккал/моль для этана), и длинная, при 166 пм (ср. 153 пм для этана), а молекула обладает дипольным моментом 5,2 D, что подразумевает перенос всего 0,2 e – от азота к бору. Гетеролитическая диссоциация H 3 N → BH 3 оценивается в 27 ккал/моль, что подтверждает, что гетеролиз в аммиак и боран более выгоден, чем гомолиз в радикальный катион и радикальный анион. Однако, помимо четких примеров, существуют значительные споры относительно того, когда конкретное соединение квалифицируется, и, таким образом, общей распространенности дативной связи (относительно предпочтительного определения автора). Специалисты по вычислительной химии предложили количественные критерии для различения двух «типов» связей. [8] [9] [10]
Некоторые неочевидные примеры, где дативное связывание считается важным, включают в себя субоксид углерода (O≡C → C 0 ← C≡O), тетрааминоаллены (описываемые с использованием языка дативных связей как «карбодикарбены»; (R 2 N) 2 C → C 0 ← C(NR 2 ) 2 ), карбодифосфоран Рамиреса (Ph 3 P → C 0 ← PPh 3 ) и катион бис(трифенилфосфин)иминия (Ph 3 P → N + ← PPh 3 ), все из которых демонстрируют значительно изогнутые равновесные геометрии, хотя и с неглубоким барьером для изгиба. Простое применение обычных правил для рисования структур Льюиса путем максимизации связей (используя связи с общими электронами) и минимизации формальных зарядов предсказывало бы гетерокумуленовые структуры и, следовательно, линейные геометрии для каждого из этих соединений. Таким образом, эти молекулы, как утверждается, лучше моделируются как координационные комплексы : C : (углерод(0) или карбона ) или : N : + (моноазотный катион) с CO, PPh 3 или N- гетероциклическими карбенами в качестве лигандов, причем неподеленные пары на центральном атоме отвечают за изогнутую геометрию. Однако полезность этой точки зрения оспаривается. [9] [10]