
Координационный комплекс — это химическое соединение, состоящее из центрального атома или иона , который обычно является металлическим и называется координационным центром , и окружающего его массива связанных молекул или ионов, которые, в свою очередь, известны как лиганды или комплексообразователи. [1] [2] [3] Многие металлосодержащие соединения , особенно те, которые включают переходные металлы (такие элементы, как титан , принадлежащие к d-блоку периодической таблицы ), представляют собой координационные комплексы. [4]
Координационные комплексы настолько распространены, что их структуры и реакции описываются по-разному, иногда запутанно. Атом внутри лиганда, который связан с центральным атомом или ионом металла, называется донорным атомом . В типичном комплексе ион металла связан с несколькими донорными атомами, которые могут быть одинаковыми или разными. Полидентатный (многосвязанный) лиганд представляет собой молекулу или ион , который связан с центральным атомом через несколько атомов лиганда; распространены лиганды с 2, 3, 4 или даже 6 связями с центральным атомом. Эти комплексы называются хелатными комплексами ; образование таких комплексов называется хелатированием, комплексообразованием и координацией.
Центральный атом или ион вместе со всеми лигандами составляют координационную сферу . [5] [6] Центральные атомы или ионы и донорные атомы составляют первую координационную сферу.
Координация относится к «координационным ковалентным связям» ( диполярным связям ) между лигандами и центральным атомом. Первоначально комплекс подразумевал обратимую ассоциацию молекул , атомов или ионов посредством столь слабых химических связей . Применительно к координационной химии это значение изменилось. Некоторые металлокомплексы образуются практически необратимо и многие связаны между собой достаточно прочными связями. [7] [8]
Число донорных атомов, присоединенных к центральному атому или иону, называется координационным числом . Наиболее распространенными координационными числами являются 2, 4 и особенно 6. Гидратированный ион — это один из видов сложного иона (или просто комплекса), разновидность, образующаяся между центральным ионом металла и одним или несколькими окружающими лигандами, молекулами или ионами, которые содержат хотя бы одну неподеленную пару электронов.
Если все лиганды монодентатны , то число донорных атомов равно числу лигандов. Например, ион гексагидрата кобальта(II) или ион гексааквакобальта(II) [Co(H 2 O) 6 ] 2+ представляет собой гидратно-комплексный ион, состоящий из шести молекул воды, присоединенных к иону металла Co. Степень окисления а координационное число отражает число связей, образующихся между ионом металла и лигандами в комплексном ионе. Однако координационное число Pt( en )2+
2равно 4 (а не 2), поскольку он имеет два бидентатных лиганда, которые содержат в общей сложности четыре донорных атома.
Любой донорный атом отдаст пару электронов. Существуют некоторые донорные атомы или группы, которые могут предлагать более одной пары электронов. Их называют бидентатными (имеют две пары электронов) или полидентатными (имеют более двух пар электронов). В некоторых случаях атом или группа предлагает пару электронов двум одинаковым или различным центральным атомам или акцепторам металла — путем разделения электронной пары — на трехцентровую двухэлектронную связь . Их называют мостиковыми лигандами.

Координационные комплексы известны с зарождения современной химии. Ранние хорошо известные координационные комплексы включают такие красители, как берлинская лазурь . Их свойства были впервые хорошо поняты в конце 1800-х годов, после работы Кристиана Вильгельма Бломстранда 1869 года . Бломстранд разработал то, что стало известно как теория сложных ионных цепей. Рассматривая металламинокомплексы, он предположил, что молекулы аммиака компенсируют заряд иона, образуя цепочки типа [(NH 3 ) X ] X+ , где X — координационное число иона металла. Он сравнил свои теоретические цепи аммиака с углеводородами формы (CH 2 ) X . [9]
Следуя этой теории, датский ученый Софус Мадс Йоргенсен внес в нее улучшения. В своей версии теории Йоргенсен утверждал, что когда молекула диссоциирует в растворе, есть два возможных результата: ионы связываются через цепи аммиака, описанные Бломстрандом, или ионы связываются непосредственно с металлом.
Лишь в 1893 году наиболее широко принятая сегодня версия теории была опубликована Альфредом Вернером . Работа Вернера включала два важных изменения в теорию Бломстранда. Во-первых, Вернер описал две возможности с точки зрения местоположения в сфере координации. Он утверждал, что если бы ионы образовали цепочку, это произошло бы за пределами координационной сферы, в то время как ионы, связавшиеся непосредственно с металлом, сделали бы это внутри координационной сферы. [10] Однако в одном из своих самых важных открытий Вернер опроверг большую часть теории цепей. Вернер открыл пространственное расположение лигандов, участвующих в образовании сложного гексакоординированного кобальта. Его теория позволяет понять разницу между координированным лигандом и ионом, уравновешивающим заряд в соединении, например, хлорид-ионом в хлоридах кобальтаммина, и объяснить многие из ранее необъяснимых изомеров.
В 1911 году Вернер впервые разделил координационный комплекс гексола на оптические изомеры , опровергнув теорию о том, что только соединения углерода могут обладать хиральностью . [11]
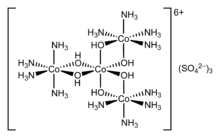
Ионы или молекулы, окружающие центральный атом, называются лигандами . Лиганды классифицируются как L или X (или их комбинация), в зависимости от того, сколько электронов они обеспечивают связь между лигандом и центральным атомом. Лиганды L отдают два электрона от неподеленной электронной пары , что приводит к образованию координатной ковалентной связи . Лиганды X обеспечивают один электрон, а центральный атом обеспечивает другой электрон, образуя таким образом регулярную ковалентную связь . Говорят, что лиганды координированы с атомом. В алкенах пи -связи могут координироваться с атомами металлов. Примером может служить этилен в комплексе [PtCl 3 (C 2 H 4 )] - ( соль Цейзе ).
В координационной химии структура сначала описывается ее координационным числом — количеством лигандов, присоединенных к металлу (точнее, количеством донорных атомов). Обычно можно подсчитать присоединенные лиганды, но иногда даже подсчет может оказаться неоднозначным. Координационные числа обычно составляют от двух до девяти, но для лантаноидов и актинидов нередко встречается большое количество лигандов. Число связей зависит от размера, заряда и электронной конфигурации иона металла и лигандов. Ионы металлов могут иметь более одного координационного числа.
Обычно в химии комплексов переходных металлов преобладают взаимодействия между s- и p- молекулярными орбиталями атомов-доноров в лигандах и d-орбиталями ионов металлов. На s-, p- и d-орбиталях металла могут разместиться 18 электронов (см. Правило 18 электронов ). Таким образом, максимальное координационное число для определенного металла связано с электронной конфигурацией иона металла (точнее, количеством пустых орбиталей) и соотношением размеров лигандов и иона металла. Крупные металлы и мелкие лиганды приводят к высоким координационным числам, например, [Mo(CN) 8 ] 4- . Маленькие металлы с большими лигандами приводят к низким координационным числам, например Pt[P(CMe 3 )] 2 . Из-за большого размера лантаноиды , актиниды и ранние переходные металлы имеют тенденцию иметь высокие координационные числа.
Большинство структур следуют схеме «точки на сфере» (или, как если бы центральный атом находился в середине многогранника, где углы этой формы являются местами расположения лигандов), где орбитали перекрываются (между лигандными и металлическими орбиталями). ), а отталкивание лиганд-лиганд имеет тенденцию приводить к определенной правильной геометрии. Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, которые отклоняются от правильной геометрии, например, из-за использования лигандов разных типов (что приводит к нерегулярным длинам связей; координационные атомы не следуют по схеме «точки на плоскости»). -сферный рисунок), из-за размера лигандов или из-за электронных эффектов (см., например, искажение Яна – Теллера ):
Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур со слегка отличающимися углами LML (лиганд-металл-лиганд), например, от разницы между квадратно-пирамидальными и тригонально-бипирамидальными структурами. [12]
Чтобы различать альтернативные координации пятикоординированных комплексов, Аддисон и др. изобрели индекс геометрии τ . [16] Этот индекс зависит от углов координационного центра и изменяется от 0 для квадратно-пирамидальных до 1 для тригонально-бипирамидальных структур, что позволяет классифицировать случаи между ними. Позднее эта система была расширена до четырехкоординированных комплексов Houser et al. [17] , а также Окуневский и др. [18]
В системах с малым числом d-электронов из-за особых электронных эффектов, таких как стабилизация Яна-Теллера (второго порядка), [19] определенная геометрия (в которой координационные атомы не следуют образцу точек на сфере) стабилизированы относительно других возможностей, например, для некоторых соединений тригонально-призматическая геометрия стабилизирована относительно октаэдрических структур для шестикоординации.
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно меняется в результате реакции, приводящей к образованию другого стабильного изомера .
В координационных комплексах, как и во многих других соединениях, существует множество видов изомерии .
Стереоизомерия возникает с одними и теми же связями в разных ориентациях. Стереоизомерию можно разделить на: [20]
Цис-транс-изомерия встречается в октаэдрических и плоско-квадратных комплексах (но не в тетраэдрах). Когда два лиганда расположены рядом, их называют цис- , если напротив друг друга - транс- . Когда три одинаковых лиганда занимают одну грань октаэдра, изомер называется фациальным, или фак . В fac -изомере любые два идентичных лиганда являются соседними или цис-ами друг к другу. Если эти три лиганда и ион металла находятся в одной плоскости, изомер называется меридиональным, или мер . Мер - изомер можно рассматривать как комбинацию транс- и цис -изомера , поскольку он содержит как транс-, так и цис-пары идентичных лигандов.
Оптическая изомерия возникает, когда комплекс не накладывается на свое зеркальное изображение. Он назван так потому, что каждый из двух изомеров оптически активен , то есть вращает плоскость поляризации света в противоположных направлениях. В первой показанной молекуле символ Λ ( лямбда ) используется в качестве префикса для описания левого поворота пропеллера, образованного тремя бидентатными лигандами. Вторая молекула является зеркальным отражением первой, с символом Δ ( дельта ) в качестве префикса для правостороннего поворота пропеллера. Третья и четвертая молекулы представляют собой аналогичную пару Λ- и Δ-изомеров, в данном случае с двумя бидентатными лигандами и двумя идентичными монодентатными лигандами. [21]
Структурная изомерия возникает, когда связи сами по себе различны. Выделяют четыре типа структурной изомерии: ионизационная изомерия, сольватная или гидратная изомерия, изомерия сцепления и координационная изомерия.
Многие свойства комплексов переходных металлов определяются их электронной структурой. Электронная структура может быть описана относительно ионной моделью, которая приписывает металлам и лигандам формальные заряды. Этот подход составляет суть теории кристаллического поля (КТП). Теория кристаллического поля, представленная Гансом Бете в 1929 году, представляет собой попытку понимания комплексов, основанную на квантовой механике . Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели включают ковалентность, и этот подход описывается теорией поля лигандов (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, представленная в 1935 году и построенная на основе теории молекулярных орбиталей, может обрабатывать более широкий диапазон комплексов и объяснять комплексы, в которых взаимодействия являются ковалентными . Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, позволяя решать формальные уравнения простыми, основанными на симметрии решениями.
Химики склонны использовать простейшую модель, необходимую для предсказания интересующих свойств; по этой причине CFT был фаворитом дискуссий, когда это было возможно. Теории МО и LF более сложны, но дают более реалистичную перспективу.
Электронная конфигурация комплексов придает им ряд важных свойств:

Комплексы переходных металлов часто имеют впечатляющие цвета, обусловленные электронными переходами при поглощении света. По этой причине их часто применяют в качестве пигментов . Большинство переходов, связанных с цветными металлокомплексами, представляют собой либо d–d-переходы, либо полосы переноса заряда . При ad–d переходе электрон на ад-орбитали металла возбуждается фотоном на другую d-орбиталь более высокой энергии, поэтому d–d-переходы происходят только для частично заполненных d-орбитальных комплексов (d 1–9 ). Для комплексов, имеющих конфигурацию d 0 или d 10 , перенос заряда все еще возможен, хотя d – d-переходы невозможны. Полоса переноса заряда влечет за собой продвижение электрона с орбитали на основе металла на орбиталь на основе пустого лиганда ( перенос заряда от металла к лиганду или MLCT). Также происходит обратное: возбуждение электрона на орбитали на основе лиганда в пустую орбиталь на основе металла ( перенос заряда от лиганда к металлу или LMCT). Эти явления можно наблюдать с помощью электронной спектроскопии; также известный как УФ-Вид . [25] Для простых соединений с высокой симметрией d–d-переходы можно обозначить с помощью диаграмм Танабе–Сугано . Эти задания получают все большую поддержку со стороны вычислительной химии .
На первый взгляд комплексы лантаноидов похожи на комплексы переходных металлов тем, что некоторые из них окрашены. Однако для обычных ионов Ln 3+ (Ln = лантанид) все цвета бледные и практически не зависят от природы лиганда. Цвета обусловлены 4f-электронными переходами. Поскольку 4f-орбитали в лантаноидах «похоронены» в ядре ксенона и экранированы от лиганда 5s- и 5p-орбиталями, они, следовательно, не подвергаются влиянию лигандов в какой-либо значительной степени, что приводит к гораздо меньшему расщеплению кристаллического поля , чем в переходных металлах. . Спектры поглощения иона Ln 3+ приближаются к спектру свободного иона, электронные состояния которого описываются спин-орбитальным взаимодействием . Это контрастирует с переходными металлами, у которых основное состояние расщепляется кристаллическим полем. Поглощение для Ln 3+ слабое, поскольку электрические дипольные переходы запрещены по четности ( запрещены по Лапорту ), но могут усиливаться из-за эффекта поля лиганда с низкой симметрией или смешивания с более высокими электронными состояниями ( например , d-орбиталями). Полосы поглощения ff чрезвычайно резкие, что контрастирует с полосами, наблюдаемыми для переходных металлов, которые обычно имеют широкие полосы. [26] [27] Это может привести к чрезвычайно необычным эффектам, таким как значительные изменения цвета при различных формах освещения.
Металлокомплексы, имеющие неспаренные электроны, магнитны . Если рассматривать только монометаллические комплексы, то неспаренные электроны возникают из-за того, что комплекс имеет нечетное число электронов или из-за того, что электронное спаривание дестабилизировано. Таким образом, мономерные частицы Ti(III) имеют один «d-электрон» и должны быть (пара)магнитными , независимо от геометрии или природы лигандов. Ti(II) с двумя d-электронами образует некоторые комплексы с двумя неспаренными электронами, а другие - без них. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P(CH 3 ) 2 ] 2 : когда X = Cl , комплекс парамагнитен ( высокоспиновая конфигурация), тогда как когда X = CH 3 , он диамагнитен ( низкоспиновая конфигурация). Важно понимать, что лиганды являются важным средством регулирования свойств основного состояния .
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или являются высокоспиновыми, ситуация сложнее. Если между двумя (или более) металлическими центрами существует взаимодействие (прямое или через лиганд), электроны могут соединяться ( антиферромагнитная связь , приводящая к образованию диамагнитного соединения) или усиливать друг друга ( ферромагнитная связь ). Когда взаимодействия нет, два (или более) отдельных металлоцентра ведут себя как будто в двух отдельных молекулах.
Комплексы демонстрируют множество возможных реакционных способностей: [28]
Если лиганды вокруг металла тщательно выбраны, металл может способствовать ( стехиометрическим или каталитическим ) преобразованиям молекул или использоваться в качестве сенсора.
Металлокомплексы, также известные как координационные соединения, включают практически все соединения металлов. [29] Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов , переходных металлов , лантаноидов , актинидов и металлоидов . Таким образом, координационная химия – это химия большей части таблицы Менделеева. Металлы и ионы металлов существуют, по крайней мере, в конденсированных фазах, только в окружении лигандов.
Области координационной химии можно классифицировать в зависимости от природы лигандов в широком смысле:
Минералогия , материаловедение и химия твердого тела – применительно к ионам металлов – являются подмножествами координационной химии в том смысле, что металлы окружены лигандами. Во многих случаях этими лигандами являются оксиды или сульфиды, но, тем не менее, металлы координируются, и применяются принципы и рекомендации, обсуждаемые ниже. В гидратах по крайней мере некоторые из лигандов представляют собой молекулы воды. Это правда, что фокус минералогии, материаловедения и химии твердого тела отличается от обычного фокуса координации или неорганической химии. Первые касаются прежде всего полимерных структур, свойств, возникающих в результате коллективного воздействия многих тесно связанных друг с другом металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Основная процедура наименования комплекса такова:
Примеры:
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), обозначается нижним индексом у греческого символа μ , помещенного перед названием лиганда. Таким образом, димер трихлорида алюминия описывается Al 2 Cl 4 (μ 2 -Cl) 2 .
Любая анионная группа может быть электронно стабилизирована любым катионом. Анионный комплекс может быть стабилизирован катионом водорода, превращаясь в кислотный комплекс, который может диссоциировать с высвобождением катионного водорода. Этот тип комплексного соединения имеет название с добавлением буквы «ic» после центрального металла. Например, H 2 [Pt(CN) 4 ] имеет название тетрацианоплатиновая (II) кислота.
Сродство ионов металлов к лигандам описывается константой стабильности, также называемой константой образования, и обозначается символом Kf . Это константа равновесия для его сборки из составляющего металла и лигандов, и ее можно рассчитать соответствующим образом, как в следующем примере для простого случая:
где: x, y и z — стехиометрические коэффициенты каждого вида. M означает металл/ион металла, L — основания Льюиса и, наконец, Z — комплексные ионы. Константы образования широко варьируются. Большие значения указывают на то, что металл имеет высокое сродство к лиганду при условии, что система находится в равновесии. [32]
Иногда константа устойчивости может иметь другую форму, известную как константа нестабильности. Эта константа выражается как обратная константе образования и обозначается как K d = 1/K f . [33] Эта константа представляет собой обратную реакцию распада сложного иона на отдельные компоненты металла и лиганда. При сравнении значений K d чем больше значение, тем более нестабильным является комплексный ион.
В результате образования этих комплексных ионов в растворах они также могут играть ключевую роль в растворимости других соединений. При образовании сложного иона он может изменять концентрации своих компонентов в растворе. Например:
Если бы обе эти реакции протекали в одном и том же реакционном сосуде, растворимость хлорида серебра увеличилась бы в присутствии NH 4 OH, поскольку образование комплекса диаммина серебра (I) поглощает значительную часть свободных ионов серебра из раствора. Согласно принципу Ле Шателье , это приводит к смещению равновесной реакции растворения хлорида серебра, продуктом которого является ион серебра.
Эту новую растворимость можно рассчитать, зная значения K f и K sp для исходных реакций. Растворимость по существу определяется путем объединения двух отдельных равновесий в одну объединенную равновесную реакцию, и именно эта объединенная реакция определяет новую растворимость. Итак, K c , новая константа растворимости, обозначается как:
Поскольку металлы существуют в растворе только в виде координационных комплексов, из этого следует, что этот класс соединений полезен во многих отношениях.
В бионеорганической химии и биометаллоорганической химии координационные комплексы выполняют либо структурные, либо каталитические функции. По оценкам, 30% белков содержат ионы металлов. Примеры включают ярко окрашенный витамин B12 , гемовую группу в гемоглобине , цитохромы , хлориновую группу в хлорофилле и карбоксипептидазу , гидролитический фермент, важный в пищеварении. Другой сложный ионный фермент — каталаза , которая разлагает перекись водорода , выделяемую клетками . Синтетические координационные соединения также используются для связывания с белками и особенно нуклеиновыми кислотами (например, противораковый препарат цисплатин ).
Гомогенный катализ является основным применением координационных соединений для производства органических веществ. Процессы включают гидрирование , гидроформилирование , окисление . В одном примере комбинация трихлорида титана и триэтилалюминия приводит к появлению катализаторов Циглера-Натта , используемых для полимеризации этилена и пропилена с получением полимеров, имеющих большое коммерческое значение в виде волокон, пленок и пластмасс.
Никель, кобальт и медь можно извлечь с помощью гидрометаллургических процессов с участием сложных ионов. Их извлекают из руд в виде амминных комплексов. Металлы также можно разделить с помощью селективного осаждения и растворимости комплексных ионов. Цианид используется главным образом для извлечения золота и серебра из руд.
Фталоцианиновые комплексы представляют собой важный класс пигментов.
В свое время координационные соединения использовались для определения присутствия металлов в образце. Качественный неорганический анализ в значительной степени вытеснен инструментальными методами анализа, такими как атомно-абсорбционная спектроскопия (ААС), атомно-эмиссионная спектроскопия с индуктивно связанной плазмой (ICP-AES) и масс-спектрометрия с индуктивно связанной плазмой (ICP-MS).