Перегруппировка Курциуса (или реакция Курциуса или деградация Курциуса ), впервые определенная Теодором Курциусом в 1885 году, представляет собой термическое разложение ацилазида до изоцианата с потерей газообразного азота . [1] [2] Затем изоцианат подвергается атаке различных нуклеофилов, таких как вода, спирты и амины , с образованием первичного амина, карбамата или производного мочевины соответственно. [3] Было опубликовано несколько обзоров. [ 4] [5]

Ацилазид обычно получают в результате реакции хлорангидридов или ангидридов кислот [6] с азидом натрия [7] или триметилсилилазидом . [8] Ацилазиды также получают путем обработки ацилгидразинов азотистой кислотой . [9] В качестве альтернативы ацилазид может быть образован путем прямой реакции карбоновой кислоты с дифенилфосфорилазидом (DPPA). [10] [11]

Считалось, что перегруппировка Курциуса представляет собой двухэтапный процесс, при котором происходит потеря азотного газа с образованием ацилнитрена , а затем следует миграция R-группы с образованием изоцианата . Однако недавние исследования показали, что термическое разложение является согласованным процессом , [12] причем оба этапа происходят вместе из-за отсутствия каких-либо побочных продуктов вставки или присоединения нитрена, наблюдаемых или выделяемых в ходе реакции. [13] Термодинамические расчеты также подтверждают согласованный механизм. [14]
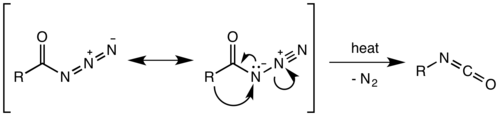
Миграция происходит с полным сохранением конфигурации в R-группе. Миграционная способность R-группы примерно третичная > вторичная ~ арил > первичная. Образованный изоцианат затем может быть гидролизован с образованием первичного амина или подвергнут нуклеофильной атаке спиртами и аминами с образованием карбаматов и производных мочевины соответственно .
Исследования показали, что перегруппировка Курциуса катализируется как кислотами Бренстеда [15] , так и кислотами Льюиса , посредством протонирования или координации с атомом кислорода ацила соответственно. Например, Фар и Нойманн показали, что использование катализатора трифторида бора или трихлорида бора снижает температуру разложения, необходимую для перегруппировки, примерно на 100 °C и значительно увеличивает выход изоцианата. [16]
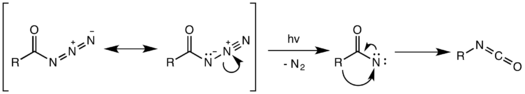
Фотохимическое разложение ацилазида также возможно. [17] Однако фотохимическая перегруппировка не согласована и вместо этого происходит с помощью промежуточного нитрена , образованного разрывом слабой связи N–N и потерей газообразного азота. Высокореактивный нитрен может подвергаться различным реакциям нитрена, таким как вставка и присоединение нитрена, давая нежелательные побочные продукты. [18] В приведенном ниже примере промежуточный нитрен вставляется в одну из связей C–H циклогексанового растворителя с образованием N-циклогексилбензамида в качестве побочного продукта.

В одном из вариантов , называемом деградацией Дарапски [19] или синтезом Дарапски , перегруппировка Курциуса происходит как один из этапов превращения α-цианоэфира в аминокислоту . Гидразин используется для превращения эфира в ацилгидразин , который реагирует с азотистой кислотой , давая ацилазид. Нагревание азида в этаноле дает этилкарбамат через перегруппировку Курциуса. Кислотный гидролиз дает амин из карбамата и карбоновую кислоту из нитрила одновременно, давая продукт аминокислоту. [20]

Фотохимическая миграция и перегруппировка фосфинового азида по Курциусу приводит к образованию метафосфонимидата [21] в ходе реакции, также известной как реакция Харгера (названной в честь доктора Мартина Харгера из Университета Лестера ). [22] За этим следует гидролиз, в примере ниже с метанолом , в результате которого получается фосфонамидат.

В отличие от перегруппировки Курциуса, существует выбор R-групп в фосфиновом азиде, которые могут мигрировать. Харгер обнаружил, что алкильные группы мигрируют преимущественно к арильным группам, и это предпочтение увеличивается в порядке метил < первичный < вторичный < третичный. Это, вероятно, связано со стерическими и конформационными факторами, поскольку чем объемнее R-группа, тем менее благоприятна конформация для миграции фенила. [23]
Перегруппировка Курциуса допускает наличие большого количества функциональных групп и имеет значительную синтетическую ценность, поскольку в зависимости от выбора нуклеофила, используемого для атаки на изоцианат, можно включить множество различных групп.
Например, при проведении реакции в присутствии трет -бутанола образуются амины , защищенные Boc , полезные промежуточные продукты в органическом синтезе . [24] [25] Аналогично, при проведении реакции Курциуса в присутствии бензилового спирта образуются амины , защищенные Cbz . [26]
RB Woodward и др. использовали перегруппировку Курциуса в качестве одного из этапов полного синтеза полихинана трихинацена в 1964 году. После гидролиза эфира в промежуточном соединении ( 1 ) была проведена перегруппировка Курциуса для преобразования групп карбоновой кислоты в ( 2 ) в группы метилкарбамата ( 3 ) с выходом 84%. Дальнейшие этапы дали трихинацен ( 4 ). [27]

В своем синтезе противовирусного препарата осельтамивир , также известного как Тамифлю, Ишикава и др. использовали перегруппировку Курциуса в одном из ключевых этапов преобразования ацилазида в амидную группу в целевой молекуле. В этом случае изоцианат, образованный перегруппировкой, подвергается атаке карбоновой кислоты с образованием амида. Последующие реакции можно было проводить в одном и том же реакционном сосуде, получая конечный продукт с общим выходом 57%. Важным преимуществом реакции Курциуса, подчеркнутым авторами, было то, что ее можно было проводить при комнатной температуре, что сводило к минимуму опасность нагревания. В целом схема была высокоэффективной, требуя всего трех операций «в одном сосуде» для производства этого важного и ценного препарата, используемого для лечения птичьего гриппа . [28]

Диеводиамин — это натуральный продукт из растения Euodia ruticarpa , которое широко используется в традиционной китайской медицине . Полный синтез диеводиамина без защитной группы, проведенный Ансвортом и др., использует перегруппировку Курциуса на первом этапе синтеза, катализируемую трифторидом бора . Затем активированный изоцианат быстро реагирует с индольным кольцом в реакции электрофильного ароматического замещения , давая амид с выходом 94%, а последующие этапы дают диеводамин. [29]
