Этилендиаминтетрауксусная кислота ( ЭДТА ), также называемая кислотой ЭДТА , представляет собой аминополикарбоновую кислоту с формулой [CH2N ( CH2CO2H ) 2 ] 2 . Это белое, слаборастворимое в воде твердое вещество широко используется для связывания с ионами железа (Fe2 + /Fe3 + ) и кальция (Ca2 + ), образуя водорастворимые комплексы даже при нейтральном pH. Таким образом, она используется для растворения Fe- и Ca -содержащих отложений, а также для доставки ионов железа в условиях, когда его оксиды нерастворимы. ЭДТА доступна в виде нескольких солей, в частности, динатриевой ЭДТА , натрий-кальциевой эдетата и тетранатриевой ЭДТА , но все они действуют схожим образом. [4]
ЭДТА широко используется в промышленности. Также применяется в консервировании продуктов питания, медицине, косметике, смягчении воды, в лабораториях и других областях.
ЭДТА в основном используется для секвестрации (связывания или ограничения) ионов металлов в водном растворе. В текстильной промышленности он предотвращает изменение цвета окрашенных изделий примесями ионов металлов. В целлюлозно-бумажной промышленности ЭДТА подавляет способность ионов металлов, особенно Mn2 + , катализировать диспропорционирование перекиси водорода , которая используется при отбеливании без хлора .
Водный [Fe(EDTA)] − используется для удаления (« очистки ») сероводорода из газовых потоков. Это преобразование достигается путем окисления сероводорода до элементарной серы, которая нелетуча:
В этом применении центр железа (III) восстанавливается до его производного железа (II), которое затем может быть повторно окислено воздухом. Аналогичным образом оксиды азота удаляются из газовых потоков с использованием [Fe(EDTA)] 2− .
Аналогичным образом ЭДТА добавляется в некоторые продукты питания в качестве консерванта или стабилизатора для предотвращения каталитического окислительного обесцвечивания, которое катализируется ионами металлов. [5]
Снижение жесткости воды в прачечных и растворение накипи в котлах зависят от ЭДТА и связанных с ней комплексообразователей для связывания Ca 2+ , Mg 2+ , а также других ионов металлов. После связывания с ЭДТА эти комплексы металлов с меньшей вероятностью образуют осадки или мешают действию мыла и моющих средств . [ необходима цитата ] По тем же причинам чистящие растворы часто содержат ЭДТА. Аналогичным образом ЭДТА используется в цементной промышленности для определения свободной извести и свободной магнезии в цементе и клинкерах . [6] [ необходима страница ]
Растворение ионов Fe 3+ при pH около нейтрального или ниже может быть достигнуто с помощью ЭДТА. Это свойство полезно в сельском хозяйстве, включая гидропонику. Однако, учитывая зависимость образования лигандов от pH, ЭДТА не помогает улучшить растворимость железа в почвах выше нейтрального. [7] В противном случае, при pH около нейтрального и выше, железо (III) образует нерастворимые соли, которые менее биодоступны для восприимчивых видов растений.
ЭДТА использовалась для разделения металлов лантаноидов с помощью ионообменной хроматографии . Усовершенствованный Ф. Х. Спеддингом и др . в 1954 году, метод основан на постоянном увеличении константы устойчивости комплексов лантаноидов с ЭДТА с атомным числом . [8] Используя сульфированные полистирольные шарики и Cu 2+ в качестве удерживающего иона, ЭДТА заставляет лантаноиды мигрировать вниз по колонке смолы, разделяясь на полосы чистых лантаноидов. Лантаноиды элюируются в порядке убывания атомного числа. Из-за стоимости этого метода по сравнению с противоточной экстракцией растворителем ионный обмен в настоящее время используется только для получения наивысшей чистоты лантаноидов (обычно более 99,99%). [ необходима цитата ]
Натрий-кальций-эдетат , производное ЭДТА, используется для связывания ионов металлов в практике хелатной терапии , например, для лечения отравлений ртутью и свинцом . [9] Он используется аналогичным образом для удаления избытка железа из организма. Эта терапия используется для лечения осложнений повторных переливаний крови , как это было бы применено для лечения талассемии .
В медицинской диагностике и тестах на функцию органов (здесь тест на функцию почек ) комплекс хрома(III) [Cr(EDTA)] − (как радиоактивный хром-51 ( 51 Cr)) вводится внутривенно и контролируется его фильтрация в мочу . Этот метод полезен для оценки скорости клубочковой фильтрации (СКФ) в ядерной медицине . [10]
ЭДТА широко используется в анализе крови. Это антикоагулянт для образцов крови для ОАК/ОАК , где ЭДТА хелатирует кальций, присутствующий в образце крови, останавливая процесс коагуляции и сохраняя морфологию клеток крови. [11] Пробирки, содержащие ЭДТА, отмечены лавандовыми (фиолетовыми) или розовыми крышками. [12] ЭДТА также находится в пробирках с коричневой крышкой для тестирования на свинец и может использоваться в пробирках с королевской синей крышкой для тестирования на следы металлов. [12]
ЭДТА является диспергатором слизи и, как было установлено, весьма эффективен в снижении роста бактерий во время имплантации интраокулярных линз (ИОЛ). [13]
Стоматологи и эндодонты используют растворы ЭДТА для удаления неорганических остатков ( смазанный слой ) и смазывания корневых каналов в эндодонтии. Эта процедура помогает подготовить корневые каналы к обтурации . Кроме того, растворы ЭДТА с добавлением поверхностно-активного вещества разрыхляют кальцификацию внутри корневого канала и позволяют проводить инструментальную обработку (формирование канала) и облегчают апикальное продвижение файла в плотном или кальцинированном корневом канале к верхушке.
Он служит консервантом ( обычно для усиления действия другого консерванта, такого как хлорид бензалкония или тиомерсал ) в глазных препаратах и глазных каплях .
Некоторые специалисты по альтернативной медицине считают, что ЭДТА действует как антиоксидант , предотвращая повреждение стенок кровеносных сосудов свободными радикалами , тем самым уменьшая атеросклероз . [14] Эти идеи не подтверждаются научными исследованиями и, по-видимому, противоречат некоторым принятым в настоящее время принципам. [15] Управление по контролю за продуктами и лекарствами США (FDA) не одобрило его для лечения атеросклероза. [16]
В шампунях , чистящих средствах и других средствах личной гигиены соли ЭДТА используются в качестве связывающего агента для повышения их стабильности на воздухе. [17]
В лаборатории ЭДТА широко используется для удаления ионов металлов: в биохимии и молекулярной биологии ионное истощение обычно используется для дезактивации металлозависимых ферментов , либо в качестве анализа их реактивности, либо для подавления повреждения ДНК , белков и полисахаридов . [18] ЭДТА также действует как селективный ингибитор против гидролизующих ферментов dNTP ( Taq-полимераза , dUTPase , MutT), [19] аргиназы печени [20] и пероксидазы хрена [21] независимо от хелатирования ионов металлов . Эти результаты побуждают переосмыслить использование ЭДТА в качестве биохимически неактивного поглотителя ионов металлов в ферментативных экспериментах. В аналитической химии ЭДТА используется в комплексонометрических титрованиях и анализе жесткости воды или в качестве маскирующего агента для удаления ионов металлов, которые могут помешать анализам.
ЭДТА находит множество специализированных применений в биомедицинских лабораториях, например, в ветеринарной офтальмологии в качестве антиколлагеназы для предотвращения ухудшения язв роговицы у животных . В культуре тканей ЭДТА используется в качестве хелатирующего агента, который связывается с кальцием и предотвращает соединение кадгеринов между клетками, предотвращая слипание клеток, выращенных в жидкой суспензии, или отсоединение адгезивных клеток для пассирования . В гистопатологии ЭДТА может использоваться в качестве декальцинирующего агента, что позволяет делать срезы с помощью микротома после деминерализации образца ткани.
Известно также, что ЭДТА ингибирует ряд металлопептидаз , метод ингибирования происходит посредством хелатирования иона металла, необходимого для каталитической активности. [22] ЭДТА также может использоваться для проверки биодоступности тяжелых металлов в отложениях . Однако он может влиять на биодоступность металлов в растворе, что может вызывать опасения относительно его воздействия на окружающую среду, особенно учитывая его широкое применение и области применения.
Окислительные свойства [Fe(EDTA)] − используются в фотографии для растворения частиц серебра . [4]
ЭДТА также используется для удаления окалины (корродированных металлов) с топливных стержней в ядерных реакторах. [23]
ЭДТА проявляет низкую острую токсичность с LD 50 (крыса) от 2,0 г/кг до 2,2 г/кг. [4] Было обнаружено, что он является как цитотоксичным , так и слабо генотоксичным для лабораторных животных. Было отмечено, что пероральное воздействие вызывает репродуктивные и развивающие эффекты. [17] В том же исследовании [17] также было обнаружено, что как дермальное воздействие ЭДТА в большинстве косметических формул, так и ингаляционное воздействие ЭДТА в аэрозольных косметических формулах будут давать уровни воздействия ниже тех, которые считаются токсичными в исследованиях перорального дозирования.
Соединение было впервые описано в 1935 году Фердинандом Мюнцем , [24] который получил соединение из этилендиамина и хлоруксусной кислоты . [25] Сегодня ЭДТА в основном синтезируется из этилендиамина (1,2-диаминоэтана), формальдегида и цианида натрия . [26] Этот путь дает тетранатриевую соль ЭДТА, которая на следующем этапе преобразуется в кислотные формы:
Этот процесс используется для производства около 80 000 тонн ЭДТА каждый год. Примеси, образующиеся в результате этого процесса, включают глицин и нитрилотриуксусную кислоту ; они возникают в результате реакций побочного продукта аммиака . [4]
Чтобы описать ЭДТА и ее различные протонированные формы , химики различают ЭДТА 4− , сопряженное основание , которое является лигандом , и H 4 ЭДТА, предшественник этого лиганда. При очень низком pH (очень кислых условиях) преобладает полностью протонированная форма H 6 ЭДТА 2+ , тогда как при очень высоком pH или очень основных условиях преобладает полностью депротонированная форма ЭДТА 4− . В этой статье термин ЭДТА используется для обозначения H 4− x ЭДТА x − , тогда как в его комплексах ЭДТА 4− обозначает тетраанионный лиганд.
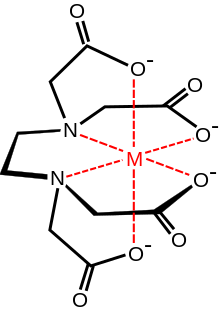

В координационной химии EDTA 4− является членом семейства лигандов аминополикарбоновых кислот . EDTA 4− обычно связывается с катионом металла через свои два амина и четыре карбоксилата, т. е. является гексадентатным ( «шестизубчатым») хелатирующим агентом . Многие из полученных координационных соединений принимают октаэдрическую геометрию . Хотя эти октаэдрические комплексы не имеют большого значения для его применения, они являются хиральными . Анион кобальта(III) [Co(EDTA)] − был разделен на энантиомеры . [28] Многие комплексы EDTA 4− принимают более сложные структуры из-за либо образования дополнительной связи с водой, т. е. семикоординационных комплексов, либо замещения одной карбоксилатной ветви водой. Комплекс железа(III) EDTA является семикоординационным. [29] Ранняя работа по разработке ЭДТА была предпринята Герольдом Шварценбахом в 1940-х годах. [30] ЭДТА образует особенно прочные комплексы с Mn(II) , Cu(II) , Fe(III), Pb(II) и Co(III). [31] [ нужна страница ]
Несколько особенностей комплексов ЭДТА имеют отношение к его применению. Во-первых, из-за его высокой дентатности этот лиганд имеет высокое сродство к катионам металлов:
Записанный таким образом, равновесный коэффициент показывает, что ионы металлов конкурируют с протонами за связывание с ЭДТА. Поскольку ионы металлов широко окутаны ЭДТА, их каталитические свойства часто подавляются. Наконец, поскольку комплексы ЭДТА 4− являются анионными , они, как правило, хорошо растворимы в воде. По этой причине ЭДТА способна растворять отложения оксидов и карбонатов металлов .
Значения p K a свободной ЭДТА составляют 0, 1,5, 2, 2,66 ( депротонирование четырех карбоксильных групп ) и 6,16, 10,24 (депротонирование двух аминогрупп ). [32 ]
ЭДТА настолько широко используется, что возникли вопросы, является ли она стойким органическим загрязнителем . Хотя ЭДТА выполняет множество положительных функций в различных промышленных, фармацевтических и других областях, долговечность ЭДТА может представлять серьезную проблему для окружающей среды. Разложение ЭДТА происходит медленно. В основном это происходит абиотически в присутствии солнечного света. [33]
Самым важным процессом устранения ЭДТА из поверхностных вод является прямой фотолиз на длинах волн ниже 400 нм. [34] В зависимости от условий освещения периоды полураспада фотолиза железа (III) ЭДТА в поверхностных водах могут варьироваться от 11,3 минут до более 100 часов. [35] Разложение FeEDTA, но не самого ЭДТА, приводит к образованию комплексов железа триацетата (ЭД3А), диацетата (ЭДДА) и моноацетата (ЭДМА) — 92% ЭДДА и ЭДМА биоразлагаются за 20 часов, в то время как ЭД3А демонстрирует значительно более высокую устойчивость. Многие распространенные в окружающей среде виды ЭДТА (такие как Mg2 + и Ca2 + ) более устойчивы.
На многих промышленных очистных сооружениях сточных вод устранение ЭДТА может быть достигнуто примерно на 80% с использованием микроорганизмов . [36] Полученные побочные продукты - ЭД3А и иминодиуксусная кислота (ИДА) - предполагают, что были атакованы как основная, так и ацетильная группы. Было даже обнаружено, что некоторые микроорганизмы образуют нитраты из ЭДТА, но они оптимально функционируют в умеренно щелочных условиях pH 9,0-9,5. [37]
Несколько штаммов бактерий, выделенных из очистных сооружений, эффективно разрушают ЭДТА. Конкретные штаммы включают Agrobacterium radiobacter ATCC 55002 [38] и подвиды Pseudomonadota, такие как BNC1, BNC2, [39] и штамм DSM 9103. [40] Три штамма обладают схожими свойствами аэробного дыхания и классифицируются как грамотрицательные бактерии . В отличие от фотолиза, хелатированные виды не являются исключительными для железа (III) для того, чтобы быть разрушенными. Скорее, каждый штамм уникально потребляет различные комплексы металл-ЭДТА через несколько ферментативных путей. Agrobacterium radiobacter разрушает только Fe (III) ЭДТА [39] , тогда как BNC1 и DSM 9103 не способны разрушать железо (III) ЭДТА и больше подходят для комплексов кальция , бария , магния и марганца (II) . [41] Комплексы ЭДТА требуют диссоциации перед разрушением.
Интерес к экологической безопасности вызвал опасения по поводу биоразлагаемости аминополикарбоксилатов, таких как ЭДТА. Эти опасения стимулируют исследование альтернативных аминополикарбоксилатов. [33] Кандидаты на роль хелатирующих агентов включают нитрилотриуксусную кислоту (НТА), иминодиянтарную кислоту (ИДС), полиаспарагиновую кислоту , S,S -этилендиамин- N , N′ -диянтарную кислоту (ЭДДС) , метилглициндиуксусную кислоту (МГДА) и тетранатриевую соль N , N -диуксусной кислоты L-глутаминовой кислоты (ГЛДА). [42]
Коммерчески используемая с 1998 года, иминодиянтарная кислота (IDS) биоразлагается примерно на 80% всего за 7 дней. IDS исключительно хорошо связывается с кальцием и образует стабильные соединения с другими ионами тяжелых металлов. Помимо того, что она имеет более низкую токсичность после хелатирования, IDS разлагается Agrobacterium tumefaciens (BY6), который можно собирать в больших масштабах. Участвующие ферменты, эпимераза IDS и лиаза C−N , не требуют никаких кофакторов . [43]
Полиаспарагиновая кислота , как и IDS, связывается с кальцием и другими ионами тяжелых металлов. Она имеет множество практических применений, включая ингибиторы коррозии, добавки для сточных вод и сельскохозяйственные полимеры. Стиральный порошок на основе полиаспарагиновой кислоты был первым стиральным порошком в мире, получившим экологическую маркировку ЕС «Цветок» . [44] Способность полиаспарагиновой кислоты связывать кальций использовалась для нацеливания наноносителей с лекарственными средствами на кость. [45] Получение гидрогелей на основе полиаспарагиновой кислоты в различных физических формах, от волокон до частиц , может потенциально обеспечить легкое отделение хелатированных ионов из раствора. [46] Поэтому, несмотря на то, что она слабее, чем ЭДТА, полиаспарагиновая кислота все еще может рассматриваться как жизнеспособная альтернатива из-за этих особенностей, а также биосовместимости и биоразлагаемости . [47]
Структурный изомер ЭДТА, этилендиамин- N , N′ -диянтарная кислота (ЭДДС) легко биоразлагается с высокой скоростью в своей S , S форме. [48]
Тринатрийдикарбоксиметилаланинат , также известный как метилглициндиуксусная кислота (MGDA), имеет высокую скорость биодеградации - более 68%, но в отличие от многих других хелатирующих агентов может распадаться без помощи адаптированных бактерий. Кроме того, в отличие от EDDS или IDS, MGDA может выдерживать более высокие температуры, сохраняя при этом высокую стабильность, а также весь диапазон pH. [ необходима цитата ] Было показано, что MGDA является эффективным хелатирующим агентом со способностью к мобилизации, сравнимой с таковой у нитрилотриуксусной кислоты (NTA), с применением к воде для промышленного использования и для удаления оксалата кальция из мочи у пациентов с камнями в почках . [49]
Наиболее чувствительным методом обнаружения и измерения ЭДТА в биологических образцах является выборочная реакция мониторинга капиллярного электрофореза масс-спектрометрии (SRM-CE/MS), которая имеет предел обнаружения 7,3 нг/мл в плазме человека и предел количественного определения 15 нг/мл. [50] Этот метод работает с образцами объемом всего 7–8 нл. [50]
ЭДТА также была измерена в безалкогольных напитках с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) на уровне 2,0 мкг/мл. [51] [52]
В фильме «Блэйд» (1998) ЭДТА используется как оружие для убийства вампиров, взрываясь при контакте с кровью вампира. [53]