Апоптоз (от древнегреческого : ἀπόπτωσις , романизированного : apóptōsis , букв. «отпадение») — это форма запрограммированной гибели клеток , которая происходит в многоклеточных организмах и в некоторых эукариотических одноклеточных микроорганизмах, таких как дрожжи . [1] Биохимические события приводят к характерным изменениям клеток ( морфологии ) и смерти. [2] Эти изменения включают блеббинг , сморщивание клеток , фрагментацию ядер , конденсацию хроматина , фрагментацию ДНК и распад мРНК . Средний взрослый человек теряет от 50 до 70 миллиардов клеток каждый день из-за апоптоза. [a] Для среднего ребенка в возрасте от 8 до 14 лет ежедневная приблизительная потеря составляет от 20 до 30 миллиардов клеток. [4]
В отличие от некроза , который является формой травматической гибели клеток, возникающей в результате острого повреждения клеток, апоптоз является строго регулируемым и контролируемым процессом, который дает преимущества в течение жизненного цикла организма. Например, разделение пальцев рук и ног у развивающегося человеческого эмбриона происходит из-за того, что клетки между пальцами подвергаются апоптозу. В отличие от некроза, апоптоз производит фрагменты клеток, называемые апоптотическими тельцами , которые фагоциты способны поглотить и удалить до того, как содержимое клетки сможет выплеснуться на окружающие клетки и нанести им вред. [5]
Поскольку апоптоз не может остановиться после того, как он начался, это строго регулируемый процесс. Апоптоз может быть инициирован одним из двух путей. Во внутреннем пути клетка убивает себя, потому что она чувствует клеточный стресс , в то время как во внешнем пути клетка убивает себя из-за сигналов от других клеток. Слабые внешние сигналы также могут активировать внутренний путь апоптоза. [6] Оба пути вызывают гибель клетки, активируя каспазы , которые являются протеазами , или ферментами, которые разрушают белки. Оба пути активируют инициирующие каспазы, которые затем активируют каспазы-исполнители, которые затем убивают клетку, разрушая белки без разбора.
Помимо своей важности как биологического явления, дефектные апоптотические процессы были вовлечены в широкий спектр заболеваний. Избыточный апоптоз вызывает атрофию , тогда как недостаточное количество приводит к неконтролируемой пролиферации клеток, такой как рак . Некоторые факторы, такие как рецепторы Fas и каспазы, способствуют апоптозу, в то время как некоторые члены семейства белков Bcl-2 ингибируют апоптоз. [7]
Немецкий ученый Карл Фогт был первым, кто описал принцип апоптоза в 1842 году. В 1885 году анатом Вальтер Флемминг дал более точное описание процесса запрограммированной гибели клеток. Однако только в 1965 году эта тема была возрождена. Изучая ткани с помощью электронной микроскопии, Джон Керр из Университета Квинсленда смог отличить апоптоз от травматической гибели клеток. [8] После публикации статьи, описывающей это явление, Керр был приглашен присоединиться к Аластеру Карри , а также к Эндрю Уилли , который был аспирантом Карри, [9] в Университете Абердина . В 1972 году трио опубликовало основополагающую статью в British Journal of Cancer . [10] Первоначально Керр использовал термин запрограммированный некроз клеток, но в статье процесс естественной гибели клеток был назван апоптозом . Керр, Уайли и Карри приписывают Джеймсу Кормаку, профессору греческого языка в Университете Абердина, предложение термина апоптоз. Керр получил премию Пауля Эрлиха и Людвига Дармштедтера 14 марта 2000 года за свое описание апоптоза. Он разделил премию с бостонским биологом Х. Робертом Хорвицем . [11]
В течение многих лет ни «апоптоз», ни «запрограммированная клеточная смерть» не были часто цитируемыми терминами. Два открытия вывели клеточную смерть из неизвестности в крупную область исследований: идентификация первого компонента контроля клеточной смерти и эффекторных механизмов и связь аномалий клеточной смерти с человеческими заболеваниями, в частности раком. Это произошло в 1988 году, когда было показано, что BCL2, ген, ответственный за фолликулярную лимфому, кодирует белок, который ингибирует клеточную смерть. [12]
Нобелевская премия по медицине 2002 года была присуждена Сиднею Бреннеру , Х. Роберту Хорвицу и Джону Салстону за их работу по выявлению генов, контролирующих апоптоз. Гены были выявлены в ходе исследований нематоды C. elegans , а гомологи этих генов функционируют у людей, регулируя апоптоз.

В греческом языке апоптоз переводится как «падение» листьев с дерева. [13] Кормак, профессор греческого языка, вновь ввел термин для медицинского использования, поскольку он имел медицинское значение для греков более двух тысяч лет назад. Гиппократ использовал термин для обозначения «падения костей». Гален расширил его значение до «сбрасывания струпьев». Кормак, несомненно, знал об этом использовании, когда предлагал это название. Продолжаются дебаты по поводу правильного произношения, при этом мнения разделились между произношением с непроизносимой второй p ( / æ p ə ˈ t oʊ s ɪ s / ap-ə- TOH -sis [14] [15] ) и произнесенной второй p ( / eɪ p ə p ˈ t oʊ s ɪ s / ). [14] [16] В английском языке буква p греческого согласующего -pt- обычно не произносится в начале слова (например, pterodactyl , Ptolemy ), но произносится при использовании в сочетаниях форм, которым предшествует гласная, как в словах helicopter или отрядах насекомых: diptera , lepidoptera и т. д.
В оригинальной статье Керра, Уайли и Карри [10] есть сноска относительно произношения:
Мы очень благодарны профессору Джеймсу Кормаку с кафедры греческого языка Абердинского университета за предложение этого термина. Слово «апоптоз» ( ἀπόπτωσις ) используется в греческом языке для описания «опадения» или «спадания» лепестков цветов или листьев деревьев. Чтобы наглядно показать происхождение, мы предлагаем ставить ударение на предпоследний слог, а вторую половину слова произносить как «птоз» (с немым «п»), которое происходит от того же корня «падать» и уже используется для описания опущения верхнего века.

Инициация апоптоза строго регулируется механизмами активации, поскольку после начала апоптоза он неизбежно приводит к гибели клетки. [17] [2] Два наиболее изученных механизма активации — это внутренний путь (также называемый митохондриальным путем) и внешний путь. [18] Внутренний путь активируется внутриклеточными сигналами, генерируемыми при стрессе клеток, и зависит от высвобождения белков из межмембранного пространства митохондрий. [19] Внешний путь активируется внеклеточными лигандами, связывающимися с рецепторами смерти на поверхности клетки, что приводит к образованию сигнального комплекса, индуцирующего смерть (DISC). [20]
Клетка инициирует внутриклеточную апоптотическую сигнализацию в ответ на стресс, [21] что может привести к самоубийству клетки. Связывание ядерных рецепторов глюкокортикоидами , [22] теплом, [22] радиацией, [22] нехваткой питательных веществ, [22] вирусной инфекцией, [22] гипоксией , [22] повышенной внутриклеточной концентрацией свободных жирных кислот [23] и повышенной внутриклеточной концентрацией кальция , [24] [25] например, при повреждении мембраны, может вызвать высвобождение внутриклеточных апоптотических сигналов поврежденной клеткой. Ряд клеточных компонентов, таких как поли-АДФ-рибозополимераза , также могут помогать регулировать апоптоз. [26] Колебания отдельных клеток наблюдались в экспериментальных исследованиях апоптоза, вызванного стрессом. [27] [28]
Прежде чем фактический процесс гибели клетки будет ускорен ферментами, апоптотические сигналы должны заставить регуляторные белки инициировать путь апоптоза. Этот шаг позволяет этим сигналам вызвать гибель клетки или остановить процесс, если клетке больше не нужно умирать. В этом участвуют несколько белков, но были выявлены два основных метода регуляции: нацеливание на функциональность митохондрий [29] или прямая передача сигнала через адаптерные белки в апоптотические механизмы. Внешний путь инициации, выявленный в нескольких исследованиях токсинов, — это увеличение концентрации кальция внутри клетки, вызванное активностью препарата, что также может вызвать апоптоз через связывающую кальций протеазу кальпаин .
Внутренний путь также известен как митохондриальный путь. Митохондрии необходимы для многоклеточной жизни. Без них клетка перестает дышать аэробно и быстро погибает. Этот факт лежит в основе некоторых апоптотических путей. Апоптотические белки, нацеленные на митохондрии, влияют на них по-разному. Они могут вызывать набухание митохондрий посредством образования мембранных пор или могут увеличивать проницаемость митохондриальной мембраны и вызывать утечку апоптотических эффекторов. [22] [30] Также появляется все больше доказательств того, что оксид азота способен вызывать апоптоз, помогая рассеивать мембранный потенциал митохондрий и, следовательно, делая ее более проницаемой. [31] Оксид азота был вовлечен в инициирование и ингибирование апоптоза посредством его возможного действия в качестве сигнальной молекулы последующих путей, которые активируют апоптоз. [32]
Во время апоптоза цитохром c высвобождается из митохондрий посредством действия белков Bax и Bak . Механизм этого высвобождения загадочен, но, по-видимому, он происходит из-за множества гомо- и гетеродимеров Bax/Bak Bax/Bak, вставленных во внешнюю мембрану. [33] После высвобождения цитохром c связывается с фактором активации апоптотической протеазы - 1 ( Apaf-1 ) и АТФ , которые затем связываются с прокаспазой-9 , создавая белковый комплекс, известный как апоптосома . Апоптосома расщепляет прокаспазу до ее активной формы каспазы-9 , которая, в свою очередь, расщепляет и активирует прокаспазу в эффекторную каспазу-3 .
Митохондрии также высвобождают белки, известные как SMAC (второй митохондриальный активатор каспаз ) в цитозоль клетки после увеличения проницаемости мембран митохондрий. SMAC связывается с белками, которые ингибируют апоптоз (IAP), тем самым дезактивируя их и не давая IAP остановить процесс и, следовательно, позволяя апоптозу продолжаться. IAP также обычно подавляет активность группы цистеиновых протеаз, называемых каспазами , [34] , которые осуществляют деградацию клетки. Таким образом, можно видеть, что фактические ферменты деградации косвенно регулируются проницаемостью митохондрий.
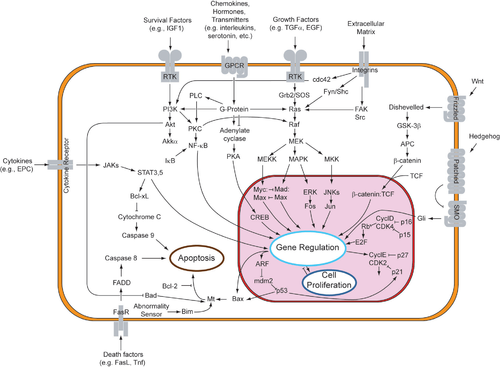
Были предложены две теории прямого запуска механизмов апоптоза у млекопитающих: модель , индуцированная ФНО ( фактором некроза опухоли ), и модель, опосредованная лигандом Fas-Fas , обе из которых включают рецепторы семейства рецепторов ФНО (TNFR) [35] , связанные с внешними сигналами.
TNF-альфа — это цитокин, вырабатываемый в основном активированными макрофагами , и является основным внешним медиатором апоптоза. Большинство клеток в организме человека имеют два рецептора для TNF-альфа: TNFR1 и TNFR2 . Было показано, что связывание TNF-альфа с TNFR1 инициирует путь, который приводит к активации каспазы через промежуточные мембранные белки домен смерти, ассоциированный с рецептором TNF ( TRADD ) и белок домена смерти, ассоциированный с Fas ( FADD ). cIAP1 /2 может ингибировать сигнализацию TNF-α, связываясь с TRAF2 . FLIP ингибирует активацию каспазы-8. [36] Связывание этого рецептора также может косвенно приводить к активации факторов транскрипции , участвующих в выживании клеток и воспалительных реакциях. [37] Однако сигнализация через TNFR1 также может вызывать апоптоз независимо от каспазы. [38] Связь между TNF-альфа и апоптозом показывает, почему аномальное производство TNF-альфа играет фундаментальную роль в нескольких заболеваниях человека, особенно при аутоиммунных заболеваниях . Суперсемейство рецепторов TNF-альфа также включает рецепторы смерти (DR), такие как DR4 и DR5 . Эти рецепторы связываются с белком TRAIL и опосредуют апоптоз. Известно, что апоптоз является одним из основных механизмов таргетной терапии рака. [39] Недавно были разработаны люминесцентные гибриды иридиевого комплекса и пептида (IPH), которые имитируют TRAIL и связываются с рецепторами смерти на раковых клетках, тем самым вызывая их апоптоз. [40]
Рецептор fas (первый сигнал апоптоза) – (также известный как Apo-1 или CD95 ) – это трансмембранный белок семейства TNF, который связывает лиганд Fas (FasL). [35] Взаимодействие между Fas и FasL приводит к образованию комплекса сигнализации, индуцирующего смерть (DISC), который содержит FADD, каспазу-8 и каспазу-10. В некоторых типах клеток (тип I) обработанная каспаза-8 напрямую активирует других членов семейства каспаз и запускает выполнение апоптоза клетки. В других типах клеток (тип II) Fas -DISC запускает петлю обратной связи, которая спирально переходит в увеличение высвобождения проапоптотических факторов из митохондрий и усиленную активацию каспазы-8. [41]
После активации TNF-R1 и Fas в клетках млекопитающих [ требуется ссылка ] устанавливается баланс между проапоптотическими ( BAX , [42] BID , BAK или BAD ) и антиапоптотическими ( Bcl-Xl и Bcl-2 ) членами семейства Bcl-2 . Этот баланс представляет собой долю проапоптотических гомодимеров , которые образуются во внешней мембране митохондрии. Проапоптотические гомодимеры необходимы для того, чтобы сделать митохондриальную мембрану проницаемой для высвобождения активаторов каспазы, таких как цитохром c и SMAC. Контроль проапоптотических белков в нормальных клеточных условиях неапоптотических клеток не до конца понятен, но в целом Bax или Bak активируются активацией белков, содержащих только BH3, которые являются частью семейства Bcl-2 . [43]
Каспазы играют центральную роль в передаче апоптотических сигналов ЭР. Каспазы — это белки, которые являются высококонсервативными, цистеин-зависимыми аспартат-специфическими протеазами. Существует два типа каспаз: инициаторные каспазы (каспазы 2, 8, 9, 10, 11 и 12) и эффекторные каспазы (каспазы 3, 6 и 7). Активация инициаторных каспаз требует связывания со специфическим олигомерным активаторным белком . Затем эффекторные каспазы активируются этими активными инициаторными каспазами посредством протеолитического расщепления. Затем активные эффекторные каспазы протеолитически разрушают множество внутриклеточных белков для выполнения программы гибели клетки.
Существует также независимый от каспазы путь апоптоза, опосредованный AIF ( фактор, индуцирующий апоптоз ). [44]
Лягушка Xenopus laevis служит идеальной модельной системой для изучения механизмов апоптоза. Фактически, йод и тироксин также стимулируют впечатляющий апоптоз клеток личиночных жабр, хвоста и плавников в метаморфозе амфибий и стимулируют эволюцию их нервной системы, превращая водного, вегетарианского головастика в наземную, плотоядную лягушку . [45] [46] [47] [48]
Отрицательная регуляция апоптоза подавляет сигнальные пути клеточной смерти, помогая опухолям избегать клеточной смерти и развивать лекарственную устойчивость . Соотношение между антиапоптотическими (Bcl-2) и проапоптотическими (Bax) белками определяет, будет ли клетка жить или умрет. [49] [50] Многие семейства белков действуют как отрицательные регуляторы, классифицируемые либо как антиапоптотические факторы, такие как белки IAP и Bcl-2 , либо как факторы, способствующие выживанию, такие как cFLIP , BNIP3 , FADD , Akt и NF-κB . [51]
Множество путей и сигналов ведут к апоптозу, но они сходятся на одном механизме, который фактически вызывает смерть клетки. После того, как клетка получает стимул, она подвергается организованной деградации клеточных органелл активированными протеолитическими каспазами . В дополнение к разрушению клеточных органелл, мРНК быстро и глобально деградирует с помощью механизма, который еще полностью не охарактеризован. [52] Распад мРНК запускается очень рано в апоптозе.
Клетка, подвергающаяся апоптозу, демонстрирует ряд характерных морфологических изменений. Ранние изменения включают:
Апоптоз быстро прогрессирует, и его продукты быстро удаляются, что затрудняет его обнаружение или визуализацию на классических гистологических срезах. Во время кариорексиса активация эндонуклеазы оставляет короткие фрагменты ДНК, равномерно распределенные по размеру. Они дают характерный «лестничный» вид на агаровом геле после электрофореза . [57] Тесты на лестницу ДНК дифференцируют апоптоз от ишемической или токсической гибели клеток. [58]

Прежде чем апоптотическая клетка будет уничтожена, происходит процесс разборки. Существует три признанных этапа разборки апоптотической клетки: [60]
Удаление мертвых клеток соседними фагоцитарными клетками было названо эффероцитозом . [66] Умирающие клетки, которые проходят конечные стадии апоптоза, демонстрируют фагоцитарные молекулы, такие как фосфатидилсерин , на своей клеточной поверхности. [67] Фосфатидилсерин обычно находится на внутренней поверхности листка плазматической мембраны, но перераспределяется во время апоптоза на внеклеточную поверхность белком, известным как скрамблаза . [68] Эти молекулы маркируют клетку для фагоцитоза клетками, обладающими соответствующими рецепторами, такими как макрофаги. [69] Удаление умирающих клеток фагоцитами происходит упорядоченным образом, не вызывая воспалительной реакции . [70] Во время апоптоза клеточная РНК и ДНК отделяются друг от друга и сортируются в различные апоптотические тельца; разделение РНК инициируется как ядрышковая сегрегация. [71]
Было сделано много нокаутов в путях апоптоза, чтобы проверить функцию каждого из белков. Несколько каспаз, в дополнение к APAF1 и FADD , были мутированы, чтобы определить новый фенотип. Чтобы создать нокаут фактора некроза опухоли (TNF), из гена был удален экзон, содержащий нуклеотиды 3704–5364. [72] Этот экзон кодирует часть зрелого домена TNF, а также лидерную последовательность, которая является высококонсервативной областью, необходимой для правильной внутриклеточной обработки. Мыши TNF-/- развиваются нормально и не имеют грубых структурных или морфологических аномалий. Однако при иммунизации SRBC (бараньими эритроцитами) эти мыши продемонстрировали дефицит созревания ответа антител; они были способны генерировать нормальные уровни IgM, но не могли развить специфические уровни IgG. [73] Apaf-1 — это белок, который включает каспазу 9 путем расщепления, чтобы начать каскад каспаз, который приводит к апоптозу. [74] Поскольку мутация -/- в гене APAF-1 является эмбриональной летальной, была использована стратегия генной ловушки для создания мыши APAF-1 -/-. Этот анализ используется для нарушения функции гена путем создания внутригенного слияния генов. Когда генная ловушка APAF-1 вводится в клетки, происходит множество морфологических изменений, таких как spina bifida, сохранение межпальцевых перепонок и открытый мозг. [75] Кроме того, после 12,5 дня эмбрионального развития мозг эмбрионов показал несколько структурных изменений. Клетки APAF-1 защищены от стимулов апоптоза, таких как облучение. У мыши с нокаутом BAX-1 наблюдается нормальное формирование переднего мозга и снижение запрограммированной гибели клеток в некоторых популяциях нейронов и в спинном мозге, что приводит к увеличению количества двигательных нейронов. [76]
Белки каспазы являются неотъемлемой частью пути апоптоза, поэтому следует, что сделанные нокауты имеют различные разрушительные результаты. Нокаут каспазы 9 приводит к серьезному пороку развития мозга [ требуется цитата ] . Нокаут каспазы 8 приводит к сердечной недостаточности и, следовательно, эмбриональной летальности [ требуется цитата ] . Однако с использованием технологии cre-lox был создан нокаут каспазы 8, который демонстрирует увеличение периферических Т-клеток, нарушенный ответ Т-клеток и дефект закрытия нервной трубки [ требуется цитата ] . Было обнаружено, что эти мыши устойчивы к апоптозу, опосредованному CD95, TNFR и т. д., но не устойчивы к апоптозу, вызванному УФ-облучением, химиотерапевтическими препаратами и другими стимулами. Наконец, нокаут каспазы 3 характеризовался эктопическими клеточными массами в мозге и аномальными апоптотическими признаками, такими как мембранное выпячивание или ядерная фрагментация [ требуется ссылка ] . Примечательной особенностью этих мышей KO является то, что у них очень ограниченный фенотип: у мышей KO Casp3, 9, APAF-1 наблюдаются деформации нервной ткани, а у мышей KO FADD и Casp 8 наблюдалось дефектное развитие сердца, однако в обоих типах KO другие органы развивались нормально, а некоторые типы клеток все еще были чувствительны к апоптотическим стимулам, что позволяет предположить существование неизвестных проапоптотических путей.

Для сравнения апоптотических и некротических клеток можно использовать визуализацию живых клеток без метки , покадровую микроскопию , проточную флуороцитометрию и трансмиссионную электронную микроскопию . Существуют также различные биохимические методы анализа маркеров клеточной поверхности (экспозиция фосфатидилсерина против проницаемости клеток с помощью проточной цитометрии), клеточных маркеров, таких как фрагментация ДНК [77] (проточная цитометрия), [78] активация каспазы, расщепление Bid и высвобождение цитохрома c ( вестерн-блоттинг ). Скрининг супернатанта на каспазы, HMGB1 и высвобождение цитокератина 18 может идентифицировать первичные и вторичные некротические клетки. Однако пока не идентифицированы отдельные поверхностные или биохимические маркеры некротической гибели клеток, и доступны только отрицательные маркеры. Они включают отсутствие апоптотических маркеров (активация каспазы, высвобождение цитохрома c и фрагментация олигонуклеосомной ДНК) и дифференциальную кинетику маркеров клеточной смерти (воздействие фосфатидилсерина и проницаемость клеточной мембраны). Выбор методов, которые можно использовать для различения апоптоза и некроптоза клеток, можно найти в этих ссылках. [79] [80] [81] [82]



Множество различных типов апоптотических путей содержат множество различных биохимических компонентов, многие из которых еще не изучены. [83] Поскольку путь по своей природе более или менее последователен, удаление или изменение одного компонента приводит к эффекту в другом. В живом организме это может иметь катастрофические последствия, часто в форме заболевания или расстройства. Обсуждение каждого заболевания, вызванного модификацией различных апоптотических путей, было бы непрактичным, но концепция, лежащая в основе каждого из них, одна и та же: нормальное функционирование пути было нарушено таким образом, что нарушилась способность клетки подвергаться нормальному апоптозу. Это приводит к тому, что клетка живет дольше своего «срока годности» и способна реплицироваться и передавать любые неисправные механизмы своему потомству, увеличивая вероятность того, что клетка станет раковой или больной.
Недавно описанный пример этой концепции в действии можно увидеть в развитии рака легких под названием NCI-H460 . [84] X -связанный ингибитор белка апоптоза ( XIAP ) сверхэкспрессируется в клетках клеточной линии H460 . XIAP связываются с обработанной формой каспазы-9 и подавляют активность активатора апоптоза цитохрома c , поэтому сверхэкспрессия приводит к уменьшению количества проапоптотических агонистов. В результате баланс антиапоптотических и проапоптотических эффекторов нарушается в пользу первых, и поврежденные клетки продолжают реплицироваться, несмотря на то, что им предписано умереть. Дефекты в регуляции апоптоза в раковых клетках часто возникают на уровне контроля факторов транскрипции. В качестве конкретного примера, дефекты в молекулах, которые контролируют фактор транскрипции NF-κB при раке, изменяют режим транскрипционной регуляции и ответ на апоптотические сигналы, чтобы сократить зависимость от ткани, к которой принадлежит клетка. Такая степень независимости от внешних сигналов выживания может способствовать метастазированию рака. [85]
Белок-супрессор опухолей p53 накапливается, когда ДНК повреждается из-за цепочки биохимических факторов. Часть этого пути включает альфа - интерферон и бета-интерферон, которые индуцируют транскрипцию гена p53 , что приводит к повышению уровня белка p53 и усилению апоптоза раковых клеток. [86] p53 предотвращает репликацию клетки, останавливая клеточный цикл на стадии G1 или интерфазы, чтобы дать клетке время на восстановление; однако он вызовет апоптоз, если повреждение обширно и попытки восстановления не увенчаются успехом. [87] Любое нарушение регуляции генов p53 или интерферона приведет к нарушению апоптоза и возможному образованию опухолей.
Ингибирование апоптоза может привести к ряду видов рака, воспалительных заболеваний и вирусных инфекций. Первоначально считалось, что связанное с этим накопление клеток было обусловлено увеличением клеточной пролиферации, но теперь известно, что это также связано со снижением клеточной гибели. Наиболее распространенным из этих заболеваний является рак, заболевание чрезмерной клеточной пролиферации, которое часто характеризуется сверхэкспрессией членов семейства IAP . В результате злокачественные клетки испытывают аномальную реакцию на индукцию апоптоза: гены, регулирующие цикл (такие как p53, ras или c-myc), мутируют или инактивируются в больных клетках, а другие гены (такие как bcl-2) также изменяют свою экспрессию в опухолях. Некоторые факторы апоптоза жизненно важны во время митохондриального дыхания, например, цитохром C. [88] Патологическая инактивация апоптоза в раковых клетках коррелирует с частыми респираторными метаболическими сдвигами в сторону гликолиза (наблюдение, известное как «гипотеза Варбурга». [89]
Апоптоз в клетках HeLa [b] ингибируется белками, продуцируемыми клеткой; эти ингибирующие белки нацелены на белки, подавляющие опухоль ретинобластомы. [90] Эти белки, подавляющие опухоль, регулируют клеточный цикл, но становятся неактивными при связывании с ингибирующим белком. [90] ВПЧ E6 и E7 являются ингибирующими белками, экспрессируемыми вирусом папилломы человека, ВПЧ отвечает за образование опухоли шейки матки, из которой происходят клетки HeLa. [91] ВПЧ E6 заставляет p53, который регулирует клеточный цикл, стать неактивным. [92] ВПЧ E7 связывается с белками, подавляющими опухоль ретинобластомы, и ограничивает его способность контролировать деление клеток. [92] Эти два ингибирующих белка частично отвечают за бессмертие клеток HeLa, ингибируя возникновение апоптоза. [93]
Основной метод лечения потенциальной смерти от заболеваний, связанных с сигнализацией, включает либо увеличение, либо уменьшение восприимчивости к апоптозу в больных клетках, в зависимости от того, вызвано ли заболевание ингибированием или избыточным апоптозом. Например, методы лечения направлены на восстановление апоптоза для лечения заболеваний с недостаточной гибелью клеток и на увеличение порога апоптоза для лечения заболеваний, связанных с избыточной гибелью клеток. Чтобы стимулировать апоптоз, можно увеличить количество лигандов рецепторов смерти (таких как TNF или TRAIL), противодействовать антиапоптотическому пути Bcl-2 или вводить миметики Smac для ингибирования ингибитора (IAP). [49] Добавление таких агентов, как Герцептин, Иресса или Гливек, останавливает цикл клеток и вызывает активацию апоптоза, блокируя сигнализацию роста и выживания выше по течению. Наконец, добавление комплексов p53- MDM2 вытесняет p53 и активирует путь p53, что приводит к остановке клеточного цикла и апоптозу. Можно использовать множество различных методов для стимуляции или ингибирования апоптоза в различных местах сигнального пути смерти. [94]
Апоптоз — это многоступенчатая, многопутевая программа клеточной смерти, присущая каждой клетке организма. При раке соотношение деления клеток при апоптозе изменяется. Лечение рака химиотерапией и облучением убивает клетки-мишени в первую очередь за счет индукции апоптоза.
С другой стороны, потеря контроля над гибелью клеток (приводящая к избыточному апоптозу) может привести к нейродегенеративным заболеваниям, гематологическим заболеваниям и повреждению тканей. Нейроны, которые полагаются на митохондриальное дыхание, подвергаются апоптозу при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера [95] и болезнь Паркинсона. [96] (наблюдение, известное как «обратная гипотеза Варбурга» [88] [97] ). Более того, существует обратная эпидемиологическая коморбидность между нейродегенеративными заболеваниями и раком. [98] Прогрессирование ВИЧ напрямую связано с избыточным, нерегулируемым апоптозом. У здорового человека количество лимфоцитов CD4+ находится в равновесии с клетками, генерируемыми костным мозгом; однако у ВИЧ-положительных пациентов этот баланс утрачен из-за неспособности костного мозга регенерировать клетки CD4+. В случае ВИЧ лимфоциты CD4+ погибают ускоренными темпами через неконтролируемый апоптоз при стимуляции. На молекулярном уровне гиперактивный апоптоз может быть вызван дефектами сигнальных путей, которые регулируют белки семейства Bcl-2. Повышенная экспрессия апоптотических белков, таких как BIM, или их сниженный протеолиз приводят к гибели клеток и могут вызывать ряд патологий в зависимости от клеток, где наблюдается чрезмерная активность BIM. Раковые клетки могут избегать апоптоза через механизмы, которые подавляют экспрессию BIM, или за счет повышенного протеолиза BIM. [ необходима цитата ]
Лечение, направленное на ингибирование, блокирует определенные каспазы. Наконец, протеинкиназа Akt способствует выживанию клеток двумя путями. Akt фосфорилирует и ингибирует Bad (член семейства Bcl-2), заставляя Bad взаимодействовать с каркасом 14-3-3 , что приводит к диссоциации Bcl и, таким образом, выживанию клеток. Akt также активирует IKKα, что приводит к активации NF-κB и выживанию клеток. Активный NF-κB индуцирует экспрессию антиапоптотических генов, таких как Bcl-2, что приводит к ингибированию апоптоза. Было обнаружено, что NF-κB играет как антиапоптотическую, так и проапоптотическую роль в зависимости от используемых стимулов и типа клеток. [99]
Прогрессирование инфекции вируса иммунодефицита человека в СПИД обусловлено в первую очередь истощением CD4+ Т-хелперных лимфоцитов способом, который слишком быстр для того, чтобы костный мозг организма мог восполнить клетки, что приводит к нарушению иммунной системы. Одним из механизмов, посредством которого истощаются Т-хелперные клетки, является апоптоз, который является результатом ряда биохимических путей: [100]
Клетки также могут погибнуть в результате прямых последствий вирусных инфекций. Экспрессия ВИЧ-1 вызывает остановку G2/M тубулярных клеток и апоптоз. [101] Прогрессирование от ВИЧ к СПИДу не является немедленным или даже не обязательно быстрым; цитотоксическая активность ВИЧ по отношению к лимфоцитам CD4+ классифицируется как СПИД, как только количество клеток CD4+ у данного пациента падает ниже 200. [102]
Исследователи из Университета Кумамото в Японии разработали новый метод искоренения ВИЧ в вирусных резервуарных клетках, названный «Lock-in and apoptosis». Используя синтезированное соединение гептаноилфосфатидил L-инозитол пентакисфосфат (или L-Hippo) для прочного связывания с белком ВИЧ PR55Gag, они смогли подавить вирусное почкование. Подавляя вирусное почкование, исследователи смогли запереть вирус ВИЧ в клетке и позволить клетке подвергнуться апоптозу (естественной гибели клетки). Доцент Микако Фудзита заявила, что этот подход пока недоступен для пациентов с ВИЧ, поскольку исследовательская группа должна провести дополнительные исследования по объединению лекарственной терапии, которая в настоящее время существует, с этим подходом «Lock-in and apoptosis», чтобы привести к полному выздоровлению от ВИЧ. [103]
Вирусная индукция апоптоза происходит, когда одна или несколько клеток живого организма заражаются вирусом , что приводит к гибели клетки. Смерть клеток в организмах необходима для нормального развития клеток и созревания клеточного цикла. [104] Она также важна для поддержания регулярных функций и активности клеток.
Вирусы могут вызывать апоптоз инфицированных клеток посредством ряда механизмов, включая:
Известно, что вирус собачьей чумы (CDV) вызывает апоптоз в центральной нервной системе и лимфоидной ткани инфицированных собак in vivo и in vitro. [106] Апоптоз, вызванный CDV, обычно индуцируется через внешний путь , который активирует каспазы , которые нарушают клеточную функцию и в конечном итоге приводят к гибели клеток. [90] В нормальных клетках CDV сначала активирует каспазу-8, которая работает как инициирующий белок, а затем - исполнительный белок каспаза-3. [90] Однако апоптоз, вызванный CDV в клетках HeLa, не включает инициирующий белок каспазу-8. Апоптоз клеток HeLa, вызванный CDV, следует другому механизму, чем в клеточных линиях vero. [90] Это изменение в каскаде каспаз предполагает, что CDV индуцирует апоптоз через внутренний путь , исключая необходимость в инициирующей каспазе-8. Вместо этого белок-палач активируется внутренними стимулами, вызванными вирусной инфекцией, а не каскадом каспаз. [90]
Вирус Оропуш (OROV) относится к семейству Bunyaviridae . Изучение апоптоза, вызываемого Bunyaviridae, было начато в 1996 году, когда было обнаружено, что вирус Ла-Кросс индуцирует апоптоз в клетках почек детенышей хомяков и в мозге детенышей мышей. [107]
OROV — это болезнь, которая передается от человека к человеку через кровососущих мошек ( Culicoides paraensis ). [108] Он относится к зоонозным арбовирусам и вызывает лихорадочное заболевание, характеризующееся внезапным приступом лихорадки, известным как лихорадка Оропуш. [109]
Вирус Оропуш также вызывает нарушение в культивируемых клетках – клетках, которые культивируются в определенных и специфических условиях. Пример этого можно увидеть в клетках HeLa , когда клетки начинают дегенерировать вскоре после заражения. [107]
С использованием гель-электрофореза можно наблюдать, что OROV вызывает фрагментацию ДНК в клетках HeLa. Это можно интерпретировать путем подсчета, измерения и анализа клеток популяции клеток Sub/G1. [107] Когда клетки HeLA инфицированы OROV, цитохром C высвобождается из мембраны митохондрий в цитозоль клеток. Этот тип взаимодействия показывает, что апоптоз активируется через внутренний путь. [104]
Для того, чтобы апоптоз произошел в OROV, необходимо вирусное раздевание, вирусная интернализация, а также репликация клеток. Апоптоз в некоторых вирусах активируется внеклеточными стимулами. Однако исследования показали, что инфекция OROV вызывает активацию апоптоза через внутриклеточные стимулы и вовлекает митохондрии. [107]
Многие вирусы кодируют белки, которые могут ингибировать апоптоз. [110] Несколько вирусов кодируют вирусные гомологи Bcl-2. Эти гомологи могут ингибировать проапоптотические белки, такие как BAX и BAK, которые необходимы для активации апоптоза. Примерами вирусных белков Bcl-2 являются белок BHRF1 вируса Эпштейна-Барр и белок E1B 19K аденовируса . [111] Некоторые вирусы экспрессируют ингибиторы каспазы, которые ингибируют активность каспазы, и примером является белок CrmA вирусов коровьей оспы. В то время как ряд вирусов могут блокировать эффекты TNF и Fas. Например, белок M-T2 вирусов миксомы может связывать TNF, предотвращая его связывание с рецептором TNF и вызывая ответ. [112] Кроме того, многие вирусы экспрессируют ингибиторы p53, которые могут связывать p53 и ингибировать его транскрипционную трансактивационную активность. Вследствие этого p53 не может индуцировать апоптоз, поскольку он не может индуцировать экспрессию проапоптотических белков. Белок аденовируса E1B-55K и белок вируса гепатита B HBx являются примерами вирусных белков, которые могут выполнять такую функцию. [113]
Вирусы могут оставаться нетронутыми от апоптоза, в частности, на последних стадиях инфекции. Они могут экспортироваться в апоптотических тельцах , которые отрываются от поверхности умирающей клетки, и тот факт, что они поглощаются фагоцитами, предотвращает начало реакции хозяина. Это способствует распространению вируса. [112] Прионы могут вызывать апоптоз в нейронах .
Запрограммированная клеточная смерть у растений имеет ряд молекулярных сходств с апоптозом у животных, но у нее также есть отличия, заметными из которых являются наличие клеточной стенки и отсутствие иммунной системы , которая удаляет части мертвой клетки. Вместо иммунного ответа умирающая клетка синтезирует вещества для своего расщепления и помещает их в вакуоль , которая разрывается, когда клетка умирает. Кроме того, растения не содержат фагоцитарных клеток, которые необходимы для процесса расщепления и удаления апоптотических тел. [114] Неясно , напоминает ли весь этот процесс апоптоз животных достаточно близко, чтобы оправдать использование названия апоптоз (в отличие от более общего термина запрограммированная клеточная смерть ). [115] [116]
Характеристика каспаз позволила разработать ингибиторы каспаз, которые можно использовать для определения того, задействованы ли в клеточном процессе активные каспазы. С помощью этих ингибиторов было обнаружено, что клетки могут умирать, демонстрируя морфологию, похожую на апоптоз без активации каспаз. [117] Более поздние исследования связали это явление с высвобождением AIF ( фактора, индуцирующего апоптоз ) из митохондрий и его транслокацией в ядро, опосредованной его NLS ( сигналом ядерной локализации ). Внутри митохондрий AIF закреплен на внутренней мембране. Для высвобождения белок расщепляется кальций-зависимой кальпаиновой протеазой .