В биохимии изоферменты (также известные как изоферменты или более широко как множественные формы ферментов ) — это ферменты , которые различаются по аминокислотной последовательности, но катализируют одну и ту же химическую реакцию. Изоферменты обычно имеют разные кинетические параметры (например, разные значения K M ) или регулируются по-разному. Они позволяют тонко настраивать метаболизм для удовлетворения конкретных потребностей данной ткани или стадии развития.
Во многих случаях изоферменты кодируются гомологичными генами, которые со временем разошлись. Строго говоря, ферменты с разными аминокислотными последовательностями, катализирующие одну и ту же реакцию, являются изоферментами, если кодируются разными генами, или аллозимами, если кодируются разными аллелями одного и того же гена ; эти два термина часто используются взаимозаменяемо.
Изоферменты были впервые описаны RL Hunter и Clement Markert (1957), которые определили их как различные варианты одного и того же фермента, имеющие идентичные функции и присутствующие у одного и того же человека . [1] Это определение охватывает (1) варианты фермента, которые являются продуктами разных генов и, таким образом, представляют разные локусы (описываемые как изоферменты ) и (2) ферменты, которые являются продуктами разных аллелей одного и того же гена (описываемые как аллозимы ). [2]
Изоферменты обычно являются результатом дупликации генов , но также могут возникать в результате полиплоидизации или гибридизации нуклеиновых кислот . С течением времени эволюции, если функция нового варианта остается идентичной исходной, то вполне вероятно, что один или другой будет утрачен по мере накопления мутаций , что приведет к появлению псевдогена . Однако, если мутации не сразу препятствуют функционированию фермента, а вместо этого изменяют либо его функцию, либо его характер экспрессии , то оба варианта могут быть одобрены естественным отбором и стать специализированными для разных функций. [3] Например, они могут быть выражены на разных стадиях развития или в разных тканях. [4]
Аллозимы могут быть результатом точечных мутаций или событий вставки-делеции ( индел ), которые влияют на кодирующую последовательность гена. Как и в случае с любыми другими новыми мутациями, с новым аллозимом могут произойти три вещи:
Примером изофермента является глюкокиназа , вариант гексокиназы , который не ингибируется глюкозо-6-фосфатом . Его различные регуляторные особенности и более низкое сродство к глюкозе (по сравнению с другими гексокиназами) позволяют ему выполнять различные функции в клетках определенных органов, такие как контроль высвобождения инсулина бета-клетками поджелудочной железы или инициация синтеза гликогена клетками печени . Оба эти процесса должны происходить только при избытке глюкозы.
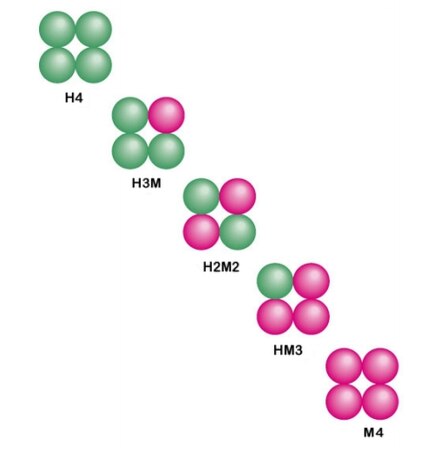

1.) Фермент лактатдегидрогеназа представляет собой тетрамер, состоящий из двух различных субъединиц, H-формы и M-формы. Они объединяются в различных комбинациях в зависимости от ткани: [7]
2.) Изоферменты креатинфосфокиназы: [7] Креатинкиназа (КК) или креатинфосфокиназа (КФК) катализирует взаимопревращение фосфокреатина в креатин.
КФК существует в 3 изоферментах. Каждый изофермент представляет собой димер из 2 субъединиц M (мышцы), B (мозг) или обеих [7]
3.) Изоферменты щелочной фосфатазы: [7] Было идентифицировано шесть изоферментов. Фермент является мономером, изоферменты обусловлены различиями в содержании углеводов (остатков сиаловой кислоты). Наиболее важными изоферментами ЩФ являются α1 - ЩФ, α2 - термолабильная ЩФ, α2 - термостабильная ЩФ, пре-β ЩФ и γ-ЩФ. Повышение α2 - термолабильной ЩФ предполагает гепатит, тогда как пре-β ЩФ указывает на заболевания костей.
Изозимы (и аллозимы) являются вариантами одного и того же фермента. Если они не идентичны по своим биохимическим свойствам, например, по субстратам и кинетике фермента , их можно различить с помощью биохимического анализа . Однако такие различия обычно незначительны, особенно между аллозимами , которые часто являются нейтральными вариантами . Эта тонкость ожидаема, поскольку два фермента, которые существенно различаются по своей функции, вряд ли были идентифицированы как изозимы .
Хотя изоферменты могут быть почти идентичны по функциям, они могут отличаться в других отношениях. В частности, замены аминокислот , которые изменяют электрический заряд фермента, легко идентифицируются с помощью гель-электрофореза , и это формирует основу для использования изоферментов в качестве молекулярных маркеров . Для идентификации изоферментов сырой белковый экстракт получают путем измельчения животной или растительной ткани с экстракционным буфером, а компоненты экстракта разделяют в соответствии с их зарядом с помощью гель-электрофореза. Исторически это обычно делалось с использованием гелей, изготовленных из картофельного крахмала , но акриламидные гели обеспечивают лучшее разрешение.
Все белки из ткани присутствуют в геле, поэтому отдельные ферменты должны быть идентифицированы с помощью анализа, который связывает их функцию с реакцией окрашивания. Например, обнаружение может быть основано на локальном осаждении растворимых индикаторных красителей, таких как соли тетразолия , которые становятся нерастворимыми, когда они восстанавливаются такими кофакторами , как НАД или НАДФ , которые образуются в зонах активности ферментов. Этот метод анализа требует, чтобы ферменты оставались функциональными после разделения ( нативного гель-электрофореза ), и представляет наибольшую сложность для использования изоферментов в качестве лабораторной техники.
Изоферменты различаются по кинетике (имеют разные значения K M и V max ).
Популяционная генетика по сути является изучением причин и следствий генетической изменчивости внутри и между популяциями, и в прошлом изоферменты были одними из наиболее широко используемых молекулярных маркеров для этой цели. Хотя в настоящее время они в значительной степени вытеснены более информативными подходами на основе ДНК (такими как прямое секвенирование ДНК , полиморфизмы отдельных нуклеотидов и микросателлиты ), они по-прежнему являются одними из самых быстрых и дешевых в разработке маркерных систем и остаются (по состоянию на 2005 год [обновлять]) отличным выбором для проектов, в которых необходимо идентифицировать только низкие уровни генетической изменчивости, например, количественная оценка систем спаривания .