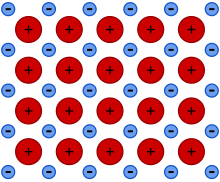
Металлическая связь — это тип химической связи , которая возникает из-за электростатической силы притяжения между электронами проводимости (в форме электронного облака делокализованных электронов ) и положительно заряженными ионами металла . Ее можно описать как совместное использование свободных электронов в структуре положительно заряженных ионов ( катионов ). Металлическая связь объясняет многие физические свойства металлов, такие как прочность , пластичность , тепловое и электрическое сопротивление и проводимость , непрозрачность и блеск . [1] [2] [3] [4]
Металлическая связь — не единственный тип химической связи, которую может проявлять металл, даже в чистом виде. Например, элементарный галлий состоит из ковалентно связанных пар атомов как в жидком, так и в твердом состоянии — эти пары образуют кристаллическую структуру с металлической связью между ними. Другим примером ковалентной связи металл-металл является ион ртути ( Hg2+
2).
По мере того, как химия развивалась в науку, стало ясно, что металлы составляют большую часть периодической таблицы элементов, и был достигнут большой прогресс в описании солей, которые могут быть образованы в реакциях с кислотами . С появлением электрохимии стало ясно, что металлы обычно переходят в раствор как положительно заряженные ионы, и реакции окисления металлов стали хорошо поняты в их электрохимических рядах. Возникла картина металлов как положительных ионов, удерживаемых вместе океаном отрицательных электронов.
С появлением квантовой механики эта картина получила более формальную интерпретацию в форме модели свободных электронов и ее дальнейшего расширения, модели почти свободных электронов . В обеих моделях электроны рассматриваются как газ, движущийся через структуру твердого тела с энергией, которая по существу изотропна, в том смысле, что она зависит от квадрата величины , а не от направления вектора импульса k . В трехмерном k-пространстве множество точек самых высоких заполненных уровней ( поверхность Ферми ) должно, следовательно, быть сферой. В почти свободной модели коробчатые зоны Бриллюэна добавляются к k-пространству периодическим потенциалом, испытываемым (ионной) структурой, таким образом, мягко нарушая изотропию.
Появление рентгеновской дифракции и термического анализа позволило изучать структуру кристаллических твердых тел, включая металлы и их сплавы; и были разработаны фазовые диаграммы . Несмотря на весь этот прогресс, природа интерметаллических соединений и сплавов в значительной степени оставалась загадкой, и их изучение часто было чисто эмпирическим. Химики обычно избегали всего, что, казалось бы, не следовало законам кратных отношений Дальтона ; и эта проблема считалась областью другой науки, металлургии.
Модель почти свободных электронов была с энтузиазмом принята некоторыми исследователями в области металлургии, в частности Хьюмом-Розери , в попытке объяснить, почему интерметаллические сплавы с определенным составом образуются, а другие — нет. Первоначально попытки Хьюма-Розери были довольно успешными. Его идея состояла в том, чтобы добавлять электроны, чтобы раздувать сферический шар Ферми внутри ряда ящиков Бриллюэна и определять, когда определенный ящик будет заполнен. Это предсказывало довольно большое количество составов сплавов, которые позже были обнаружены. Как только циклотронный резонанс стал доступен и можно было определить форму шара, было обнаружено, что шар не был сферическим, как считал Хьюм-Розери, за исключением, возможно, случая цезия . Это показало, как модель иногда может давать целый ряд правильных предсказаний, но при этом все еще быть неверной в своих основных предположениях.
Почти свободный электронный крах заставил исследователей изменить предположение о том, что ионы текут в море свободных электронов. Был разработан ряд квантово-механических моделей, таких как расчеты зонной структуры на основе молекулярных орбиталей и теория функционала плотности . Эти модели либо отходят от атомных орбиталей нейтральных атомов, которые делят свои электроны, либо (в случае теории функционала плотности) отходят от общей электронной плотности. Картина свободных электронов, тем не менее, осталась доминирующей во вводных курсах по металлургии.
Модель электронной зонной структуры стала основным направлением изучения металлов и, в еще большей степени, полупроводников . Вместе с электронными состояниями, колебательные состояния также, как было показано, образуют полосы. Рудольф Пайерлс показал, что в случае одномерного ряда металлических атомов, скажем, водорода, неизбежная нестабильность разорвет такую цепочку на отдельные молекулы. Это вызвало интерес к общему вопросу: когда коллективная металлическая связь стабильна, а когда ее место займет локализованная связь? Много исследований было посвящено изучению кластеризации атомов металлов.
Несмотря на то, что модель зонной структуры оказалась мощной в описании металлической связи, она остается одноэлектронным приближением многочастичной проблемы: энергетические состояния отдельного электрона описываются так, как если бы все остальные электроны образовывали однородный фон. Такие исследователи, как Мотт и Хаббард, поняли, что одноэлектронное рассмотрение, возможно, подходит для сильно делокализованных s- и p -электронов ; но для d -электронов, и тем более для f -электронов, взаимодействие с близлежащими отдельными электронами (и атомные смещения) может стать сильнее, чем делокализованное взаимодействие, которое приводит к широким зонам. Это дало лучшее объяснение перехода от локализованных неспаренных электронов к блуждающим, участвующим в металлической связи.
Сочетание двух явлений приводит к образованию металлической связи: делокализации электронов и доступности гораздо большего числа делокализованных энергетических состояний, чем делокализованных электронов. [ необходимо разъяснение ] Последнее можно было бы назвать дефицитом электронов .
Графен является примером двумерной металлической связи. Его металлические связи аналогичны ароматическим связям в бензоле , нафталине , антрацене , овалене и т. д.
Металлическая ароматичность в металлических кластерах — еще один пример делокализации, на этот раз часто в трехмерных расположениях. Металлы доводят принцип делокализации до крайности, и можно сказать, что кристалл металла представляет собой одну молекулу, по которой все электроны проводимости делокализованы во всех трех измерениях. Это означает, что внутри металла, как правило, нельзя различить молекулы, так что металлическая связь не является ни внутри-, ни межмолекулярной. «Немолекулярная», возможно, был бы лучшим термином. Металлическая связь в основном неполярна, потому что даже в сплавах существует небольшая разница между электроотрицательностью атомов , участвующих во взаимодействии связи (а в чистых элементарных металлах — вообще никакой). Таким образом, металлическая связь — это чрезвычайно делокализованная коллективная форма ковалентной связи. В некотором смысле металлическая связь вообще не является «новым» типом связи. Она описывает связь только как присутствующую в куске конденсированного вещества: будь то кристаллическое твердое тело, жидкость или даже стекло. Металлические пары, напротив, часто являются атомарными ( Hg ) или иногда содержат молекулы, такие как Na2 , удерживаемые вместе более обычной ковалентной связью. Вот почему неправильно говорить об одной «металлической связи». [ необходимо уточнение ]
Делокализация наиболее выражена для s- и p -электронов. Делокализация в цезии настолько сильна, что электроны фактически освобождаются от атомов цезия, образуя газ, ограниченный только поверхностью металла. Поэтому для цезия картина ионов Cs +, удерживаемых вместе отрицательно заряженным электронным газом, очень близка к точной (хотя и не идеально). [a] Для других элементов электроны менее свободны, поскольку они все еще испытывают потенциал атомов металла, иногда довольно сильный. Они требуют более сложной квантово-механической обработки (например, сильной связи ), в которой атомы рассматриваются как нейтральные, во многом как атомы углерода в бензоле. Для d- и особенно f -электронов делокализация совсем не сильна, и это объясняет, почему эти электроны способны продолжать вести себя как неспаренные электроны , сохраняющие свой спин, добавляя этим металлам интересные магнитные свойства .
Атомы металлов содержат мало электронов в своих валентных оболочках относительно их периодов или энергетических уровней . Они являются элементами с дефицитом электронов , и общее разделение этого не меняет. Остается гораздо больше доступных энергетических состояний, чем общих электронов. Таким образом, выполняются оба требования к проводимости: сильная делокализация и частично заполненные энергетические зоны. Поэтому такие электроны могут легко переходить из одного энергетического состояния в немного другое. Таким образом, они не только становятся делокализованными, образуя море электронов, пронизывающих структуру, но и могут мигрировать через структуру, когда применяется внешнее электрическое поле, что приводит к электропроводности. Без поля есть электроны, движущиеся одинаково во всех направлениях. В таком поле некоторые электроны будут немного корректировать свое состояние, принимая другой волновой вектор . Следовательно, будет больше движения в одну сторону, чем в другую, и возникнет чистый ток.
Свобода перемещения электронов также дает атомам металла или их слоям возможность скользить друг мимо друга. Локально связи могут легко разрываться и заменяться новыми после деформации. Этот процесс не сильно влияет на общую металлическую связь, что приводит к характерной для металлов пластичности и ковкости . Это особенно верно для чистых элементов. В присутствии растворенных примесей обычно легко образующиеся расщепления могут блокироваться, и материал становится тверже. Золото, например, очень мягкое в чистом виде (24 карата ), поэтому в ювелирных изделиях предпочитают сплавы.
Металлы обычно также являются хорошими проводниками тепла, но электроны проводимости вносят лишь частичный вклад в это явление. Коллективные (т. е. делокализованные) колебания атомов, известные как фононы , которые проходят через твердое тело как волна, вносят больший вклад.
Однако такое вещество, как алмаз , которое проводит тепло довольно хорошо, не является электрическим проводником. Это не следствие отсутствия делокализации в алмазе, а просто то, что углерод не является электронно-дефицитным.
Дефицит электронов важен для различения металлической и более обычной ковалентной связи. Таким образом, мы должны изменить выражение, приведенное выше, на: Металлическая связь является чрезвычайно делокализованной коммунальной формой ковалентной связи с дефицитом электронов [b] .
Металлический радиус определяется как половина расстояния между двумя соседними ионами металла в металлической структуре. Этот радиус зависит от природы атома, а также от его окружения, в частности, от координационного числа (CN), которое, в свою очередь, зависит от температуры и приложенного давления.
При сравнении периодических тенденций в размерах атомов часто желательно применять так называемую поправку Гольдшмидта, которая преобразует атомные радиусы в значения, которые атомы имели бы, если бы они были 12-координированными. Поскольку металлические радиусы наибольшие для наибольшего координационного числа, поправка для менее плотных координаций включает умножение на x , где 0 < x < 1. В частности, для CN = 4, x = 0,88; для CN = 6, x = 0,96 и для CN = 8, x = 0,97. Поправка названа в честь Виктора Гольдшмидта , который получил числовые значения, указанные выше. [6]
Радиусы следуют общим периодическим тенденциям : они уменьшаются по периоду из-за увеличения эффективного заряда ядра , что не компенсируется увеличением числа валентных электронов ; но радиусы увеличиваются вниз по группе из-за увеличения главного квантового числа . Между 4d и 5d элементами наблюдается лантаноидное сжатие — наблюдается очень небольшое увеличение радиуса вниз по группе из-за наличия плохо экранирующих f- орбиталей .
Между атомами металлов существует сильная сила притяжения. Для ее преодоления требуется много энергии. Поэтому металлы часто имеют высокие температуры кипения, причем у вольфрама (5828 К) она чрезвычайно высока. Замечательным исключением являются элементы группы цинка : Zn, Cd и Hg. Их электронные конфигурации заканчиваются на ...n s 2 , что напоминает конфигурацию благородного газа, например, гелия , все больше и больше при движении вниз по периодической таблице, поскольку разница в энергии для пустых n p орбиталей становится больше. Поэтому эти металлы относительно летучи, и их избегают в системах сверхвысокого вакуума .
В противном случае металлическая связь может быть очень прочной, даже в расплавленных металлах, таких как галлий . Хотя галлий плавится от тепла руки при температуре чуть выше комнатной, его точка кипения не так уж далека от точки кипения меди. Расплавленный галлий, таким образом, является очень нелетучей жидкостью благодаря своей прочной металлической связи.
Сильная связь металлов в жидкой форме показывает, что энергия металлической связи не сильно зависит от направления связи; это отсутствие направленности связи является прямым следствием электронной делокализации и лучше всего понимается в сравнении с направленной связью ковалентных связей. Таким образом, энергия металлической связи в основном является функцией числа электронов, окружающих металлический атом, как показано на примере модели встроенного атома . [7] Это обычно приводит к тому, что металлы принимают относительно простые, плотноупакованные кристаллические структуры, такие как ГЦК, ОЦК и ГКП.
При достаточно высоких скоростях охлаждения и соответствующем составе сплава металлическая связь может происходить даже в стеклах , имеющих аморфную структуру.
Большая часть биохимии опосредована слабым взаимодействием ионов металлов и биомолекул. Такие взаимодействия и связанные с ними конформационные изменения были измерены с помощью интерферометрии двойной поляризации .
Металлы нерастворимы в воде или органических растворителях, если только они не вступают с ними в реакцию. Обычно это реакция окисления, которая отнимает у атомов металла их блуждающие электроны, разрушая металлическую связь. Однако металлы часто легко растворяются друг в друге, сохраняя металлический характер своей связи. Например, золото легко растворяется в ртути даже при комнатной температуре. Даже в твердых металлах растворимость может быть обширной. Если структуры двух металлов одинаковы, может быть даже полная растворимость в твердом теле , как в случае электрума , сплава серебра и золота. Иногда, однако, два металла будут образовывать сплавы с другими структурами, чем любой из двух родителей. Можно было бы назвать эти материалы соединениями металлов . Но, поскольку материалы с металлической связью, как правило, не являются молекулярными, закон интегралов Дальтона недействителен; и часто может быть достигнут диапазон стехиометрических соотношений. В таких случаях лучше отказаться от таких понятий, как «чистое вещество» или «растворенное вещество», и вместо этого говорить о фазах . Изучение таких фаз традиционно было скорее областью металлургии, чем химии , хотя эти две области во многом пересекаются.
Металлическая связь в сложных соединениях не обязательно включает все составляющие элементы в равной степени. Вполне возможно, что один или несколько элементов вообще не участвуют. Можно представить, как электроны проводимости текут вокруг них, как река вокруг острова или большого камня. Можно наблюдать, какие элементы участвуют: например, посмотрев на основные уровни в спектре рентгеновской фотоэлектронной спектроскопии (XPS). Если элемент участвует, его пики, как правило, искажены.
Некоторые интерметаллические материалы, например, демонстрируют металлические кластеры, напоминающие молекулы; и эти соединения являются скорее темой химии, чем металлургии. Образование кластеров можно рассматривать как способ «конденсации» (локализации) электронно-дефицитной связи в связи более локализованной природы. Водород является экстремальным примером этой формы конденсации. При высоких давлениях он является металлом . Можно сказать, что ядро планеты Юпитер удерживается вместе комбинацией металлической связи и высокого давления, вызванного гравитацией. Однако при более низких давлениях связь становится полностью локализованной в обычную ковалентную связь. Локализация настолько полная, что получается (более знакомый) газ H 2 . Похожий аргумент справедлив для такого элемента, как бор. Хотя он является электронно-дефицитным по сравнению с углеродом, он не образует металл. Вместо этого он имеет ряд сложных структур, в которых доминируют икосаэдрические кластеры B 12 . Волны плотности заряда являются родственным явлением.
Поскольку эти явления подразумевают движение атомов друг к другу или друг от друга, их можно интерпретировать как связь между электронными и колебательными состояниями (т. е. фононами) материала. Считается, что другое такое электрон-фононное взаимодействие приводит к совершенно иному результату при низких температурах, к сверхпроводимости . Вместо того, чтобы блокировать подвижность носителей заряда путем формирования электронных пар в локализованных связях, образуются куперовские пары , которые больше не испытывают никакого сопротивления своей подвижности.
Наличие океана подвижных носителей заряда оказывает глубокое влияние на оптические свойства металлов, понять которые можно, только рассматривая электроны как коллектив , а не рассматривая состояния отдельных электронов, участвующих в более традиционных ковалентных связях.
Свет состоит из комбинации электрического и магнитного поля. Электрическое поле обычно способно возбуждать упругий отклик электронов, участвующих в металлической связи. В результате фотоны не могут проникать очень далеко в металл и обычно отражаются, хотя некоторые из них могут также поглощаться. Это справедливо для всех фотонов в видимом спектре, поэтому металлы часто серебристо-белые или сероватые с характерным зеркальным отражением металлического блеска . Баланс между отражением и поглощением определяет, насколько белым или серым является металл, хотя поверхностная тусклость может скрыть блеск. Серебро, металл с высокой проводимостью, является одним из самых белых.
Известными исключениями являются красноватая медь и желтоватое золото. Причина их цвета в том, что существует верхний предел частоты света, на который металлические электроны могут легко реагировать: частота плазмона . На частоте плазмона зависящая от частоты диэлектрическая функция свободного электронного газа меняется с отрицательной (отражающей) на положительную (пропускающую); фотоны более высокой частоты не отражаются на поверхности и не вносят вклад в цвет металла. Есть некоторые материалы, такие как оксид индия и олова (ITO), которые являются металлическими проводниками (фактически вырожденными полупроводниками ), для которых этот порог находится в инфракрасном диапазоне , [8] поэтому они прозрачны в видимом диапазоне, но хорошо отражают в инфракрасном.
Для серебра предельная частота находится в дальнем ультрафиолете, а для меди и золота она ближе к видимому. Это объясняет цвета этих двух металлов. На поверхности металла могут возникать резонансные эффекты, известные как поверхностные плазмоны . Они представляют собой коллективные колебания электронов проводимости, подобные ряби в электронном океане. Однако, даже если у фотонов достаточно энергии, у них обычно недостаточно импульса , чтобы привести рябь в движение. Поэтому плазмоны трудно возбудить в объемном металле. Вот почему золото и медь выглядят как блестящие металлы, хотя и с примесью цвета. Однако в коллоидном золоте металлическая связь ограничена крошечной металлической частицей, что не дает колебательной волне плазмона «убежать». Таким образом, правило отбора импульса нарушается, и плазмонный резонанс вызывает чрезвычайно интенсивное поглощение в зеленом цвете, что приводит к пурпурно-красному цвету. Такие цвета на порядки интенсивнее обычных поглощений, наблюдаемых в красителях и подобных веществах, в которых задействованы отдельные электроны и их энергетические состояния.