
Металлоцен — это соединение, обычно состоящее из двух циклопентадиенильных анионов ( C
5ЧАС−
5, сокращенно Cp), связанный с металлическим центром (M) в степени окисления II, с результирующей общей формулой (C 5 H 5 ) 2 M. Тесно связаны с металлоценами производные металлоценов, например, дихлорид титаноцена или дихлорид ванадоцена . Некоторые металлоцены и их производные проявляют каталитические свойства, хотя металлоцены редко используются в промышленности. Катионные производные металлоценов группы 4, связанные с [Cp 2 ZrCH 3 ] +, катализируют полимеризацию олефинов .
Некоторые металлоцены состоят из металла и двух циклооктатетраенидных анионов ( C
8ЧАС2−
8, сокращенно cot 2− ), а именно лантаноцены и актиноцены ( ураноцен и другие).
Металлоцены являются подмножеством более широкого класса соединений, называемых сэндвичевыми соединениями . [1] В структуре, показанной справа, два пятиугольника представляют собой циклопентадиенильные анионы с кругами внутри них, указывающими на то, что они ароматически стабилизированы. Здесь они показаны в шахматной конформации .
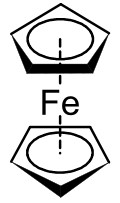
Первым классифицированным металлоценом был ферроцен , который был открыт одновременно в 1951 году Кили и Паусоном [2] и Миллером и др. [3] Кили и Паусон пытались синтезировать фульвален путем окисления циклопентадиенильной соли безводным FeCl3 , но вместо этого получили вещество C10H10Fe [ 2] В то же время Миллер и др . сообщили о том же продукте железа из реакции циклопентадиена с железом в присутствии оксидов алюминия, калия или молибдена [ 3] Структура «C10H10Fe » была определена Джеффри Уилкинсоном и др. [1] и Эрнстом Отто Фишером и др. [4] Эти двое были удостоены Нобелевской премии по химии в 1973 году за свою работу по сэндвичевым соединениям, включая определение структуры ферроцена. [1] Они определили, что атомы углерода циклопентадиенильного (Cp) лиганда в равной степени способствовали связыванию и что связывание происходило за счет d-орбиталей металла и π- электронов в p-орбиталях лигандов Cp. Этот комплекс теперь известен как ферроцен, а группа дициклопентадиенильных соединений переходных металлов известна как металлоцены. Металлоцены имеют общую формулу [( η 5 -C 5 H 5 ) 2 M]. Фишер и др. впервые получили производные ферроцена, включающие Co и Ni. Часто полученные из замещенных производных циклопентадиенида , были получены металлоцены многих элементов. [5]
Одним из самых первых коммерческих производителей металлоценов была компания Arapahoe Chemicals в Боулдере, штат Колорадо [6]

Общее название металлоцен происходит от ферроцена , (C 5 H 5 ) 2 Fe или Cp 2 Fe, систематически называемого бис( η 5 - циклопентадиенил )железо(II). Согласно определению Международного союза теоретической и прикладной химии , металлоцен содержит переходный металл и два циклопентадиенильных лиганда, координированных в сэндвич-структуре, т. е. два циклопентадиенильных аниона находятся на параллельных плоскостях с равными длинами связей и прочностью. Используя номенклатуру « гаптичности », эквивалентное связывание всех 5 атомов углерода циклопентадиенильного кольца обозначается как η 5 , произносится как «пентагапто». Существуют исключения, такие как ураноцен , который имеет два циклооктатетраеновых кольца, заключающих атом урана .
В названиях металлоценов префикс перед окончанием -оцен указывает на то, какой металлический элемент находится между группами Cp. Например, в ферроцене присутствует железо(II), двухвалентное железо.
В отличие от более строгого определения, предложенного Международным союзом теоретической и прикладной химии, которое требует наличия d-блочного металла и сэндвичевой структуры, термин металлоцен и, следовательно, обозначение -оцен , применяется в химической литературе также к соединениям непереходных металлов, таким как бароцен (Cp 2 Ba), или к структурам, в которых ароматические кольца не параллельны, например, обнаруженным в дихлориде манганоцена или титаноцена (Cp 2 TiCl 2 ).
Сообщалось о некоторых металлоценовых комплексах актинидов , где для монометаллического комплекса имеется три циклопентадиенильных лиганда, все три из которых связаны с η 5 . [7]
Существует много комплексов ( η 5 -C 5 H 5 )–металлов, и их можно классифицировать по следующим формулам: [8]
Комплексы на основе Cp также можно классифицировать по типу: [8]
При образовании этих типов соединений обычно используются три основных пути: [8]
Циклопентадиенид натрия (NaCp) является предпочтительным реагентом для этих типов реакций. Его проще всего получить реакцией расплавленного натрия и дициклопентадиена. [9] Традиционно отправной точкой является крекинг дициклопентадиена , димера циклопентадиена. Циклопентадиен депротонируется сильными основаниями или щелочными металлами.
В этой реакции NaCp действует как восстановитель и лиганд.
Эта технология позволяет использовать атомы металла в газовой фазе, а не в твердом металле. Высокореактивные атомы или молекулы генерируются при высокой температуре в вакууме и объединяются с выбранными реагентами на холодной поверхности.
Разработано множество реагентов, которые переводят Cp в металлы. Когда-то популярным был циклопентадиенид таллия . Он реагирует с галогенидами металлов, образуя хлорид таллия, который плохо растворяется, и циклопентадиенильный комплекс . Также использовались триалкильные производные олова Cp − .
Было разработано много других методов. Хромоцен может быть получен из гексакарбонила хрома путем прямой реакции с циклопентадиеном в присутствии диэтиламина ; в этом случае формальное депротонирование циклопентадиена сопровождается восстановлением полученных протонов до газообразного водорода , что облегчает окисление металлического центра. [10]
Металлоцены, как правило, обладают высокой термической стабильностью. Ферроцен может сублимироваться на воздухе при температуре более 100 °C без разложения; металлоцены обычно очищаются в лаборатории методом вакуумной сублимации . В промышленных масштабах сублимация нецелесообразна, поэтому металлоцены выделяют кристаллизацией или производят как часть углеводородного раствора. Для металлоценов группы IV донорные растворители, такие как эфир или ТГФ, явно нежелательны для полиолефинового катализа. Нейтральные по заряду металлоцены растворимы в обычных органических растворителях. Алкильное замещение в металлоцене увеличивает растворимость в углеводородных растворителях.
Структурная тенденция для серии MCp 2 включает изменение связей MC, которые удлиняются по мере отклонения числа валентных электронов от 18. [11]
В металлоценах типа (C 5 R 5 ) 2 M циклопентадиенильные кольца вращаются с очень низкими барьерами. Исследования рентгеновской дифракции монокристаллов выявляют как заслоненные , так и заторможенные ротамеры. Для незамещенных металлоценов разница энергий между заторможенной и заторможенной конформациями составляет всего несколько кДж/моль . Кристаллы ферроцена и осмоцена демонстрируют заторможенные конформации при низких температурах, тогда как в родственных бис(пентаметилциклопентадиенильных) комплексах кольца обычно кристаллизуются в заторможенной конформации, по-видимому, для минимизации стерических препятствий между метильными группами .
Инфракрасная и Рамановская спектроскопия оказались важными в анализе циклических полиенильных металлических сэндвич-видов, с особым использованием для выяснения ковалентных или ионных связей M–кольцо и различения центральных и координированных колец. Некоторые типичные спектральные полосы и назначения металлоценов группы железа показаны в следующей таблице: [8]
Ядерный магнитный резонанс (ЯМР) является наиболее применяемым инструментом в изучении металлических сэндвич-соединений и металлоорганических соединений, предоставляя информацию о ядерных структурах в растворах, жидкостях, газах и в твердом состоянии. Химические сдвиги 1 H ЯМР для парамагнитных соединений органопереходных металлов обычно наблюдаются между 25 и 40 ppm, но этот диапазон гораздо уже для диамагнитных металлоценовых комплексов, где химические сдвиги обычно наблюдаются между 3 и 7 ppm. [8]
Масс-спектрометрия металлоценовых комплексов была очень хорошо изучена, и влияние металла на фрагментацию органического фрагмента привлекло значительное внимание, а идентификация металлосодержащих фрагментов часто облегчается изотопным распределением металла. Три основных фрагмента, наблюдаемых в масс-спектрометрии, - это молекулярный ионный пик, [C 10 H 10 M] + , и фрагментные ионы, [C 5 H 5 M] + и M + .
После открытия ферроцена синтез и характеристика производных металлоцена и других сэндвичевых соединений привлекли внимание исследователей.
Металлоценофаны характеризуются связыванием циклопентадиенильных или полиаренильных колец путем введения одного или нескольких гетероаннулярных мостиков. Некоторые из этих соединений подвергаются термической полимеризации с раскрытием кольца , давая растворимые высокомолекулярные полимеры с переходными металлами в полимерной цепи. Анса-металлоцены являются производными металлоценов с внутримолекулярным мостиком между двумя циклопентадиенильными кольцами.

Трехпалубные комплексы состоят из трех анионов Cp и двух катионов металлов в чередующемся порядке. Первый трехпалубный сэндвич-комплекс, [Ni 2 Cp 3 ] + , был описан в 1972 году. [12] Впоследствии было описано много примеров, часто с борсодержащими кольцами . [13]
Самым известным примером является ферроцений , [Fe(C 5 H 5 ) 2 ] + , синий комплекс железа(III), полученный при окислении оранжевого ферроцена железа(II). Анион литоцена, [Li(C 5 H 5 ) 2 ] – , [14] является наиболее документированным примером металлоценового аниона; в остальном такие ионы малоизвестны.
Многие производные ранних металлических металлоценов являются активными катализаторами полимеризации олефинов . В отличие от традиционных и все еще доминирующих гетерогенных катализаторов Циглера-Натта , металлоценовые катализаторы являются гомогенными. [8] Производные ранних металлических металлоценов, например , реагент Теббе , реагент Петазиса и реагент Шварца , полезны в специализированных органических синтетических операциях.
Биосенсор на основе ферроцена/ ферроцения обсуждался для определения уровня глюкозы в образце электрохимическим путем с помощью серии связанных окислительно-восстановительных циклов. [8]
Дигалогениды металлоценов [Cp 2 MX 2 ] (M = Ti, Mo, Nb) проявляют противоопухолевые свойства, хотя ни один из них не продвинулся далеко в клинических испытаниях. [15]