Метатезис с замыканием кольца ( RCM ) — это широко используемый вариант метатезиса олефинов в органической химии для синтеза различных ненасыщенных колец посредством внутримолекулярного метатезиса двух концевых алкенов , который образует циклоалкен в виде E- или Z- изомеров и летучий этилен . [1] [2]

Размер наиболее часто синтезируемых колец составляет от 5 до 7 атомов; [3] однако сообщалось, что синтезы включают макрогетероциклы с числом от 45 до 90 членов. [4] [5] [6] Эти реакции катализируются металлами и протекают через промежуточный металлциклобутан . [7] Впервые он был опубликован Дидером Вильменом в 1980 году с описанием синтеза предшественника экзальтолида, [8] и позже стал популяризирован Робертом Х. Граббсом и Ричардом Р. Шроком , которые разделили Нобелевскую премию по химии вместе с Ивом Шовеном. в 2005 году за совместную работу по метатезису олефинов . [9] [10] RCM является фаворитом среди химиков-органиков из-за его синтетической применимости в формировании колец, к которым ранее было трудно получить эффективный доступ, а также широкого спектра субстратов. [11] Поскольку единственным основным побочным продуктом является этилен , эти реакции также можно считать атомоэкономичными , что становится все более важной проблемой в развитии зеленой химии . [7]
Опубликовано несколько обзоров по метатезису замыкания кольца. [2] [3] [12] [13]
О первом примере метатезиса с замыканием цикла сообщил Дидер Виллемин в 1980 году, когда он синтезировал предшественник экзалтолида , используя катализируемую WCl 6 /Me 4 Sn циклизацию метатезиса с выходом 60-65% в зависимости от размера кольца (А) . [8] В последующие месяцы Дзиро Цудзи сообщил о подобной реакции метатезиса, описывающей получение макролида, катализируемого WCl 6 и диметилтитаноценом (Cp 2 TiMe 2 ) со скромным выходом 17,9% (B) . [14] Цудзи описывает реакцию метатезиса олефинов как «...потенциально полезную в органическом синтезе» и обращает внимание на необходимость разработки более универсального катализатора, допускающего различные функциональные группы.

В 1987 году Зигфрид Варвель и Ханс Кейткер опубликовали синтез симметричных макроциклов посредством перекрестно-метатезисной димеризации исходных циклоолефинов с получением диенов C 14 , C 18 и C 20 с выходом 58-74%, а также C 16 с выходом 30%. выход, используя Re 2 O 7 на Al 2 O 3 и Me 4 Sn для активации катализатора. [15]

Спустя десять лет с момента его первоначального открытия Граббс и Фу опубликовали в 1992 году два влиятельных отчета, в которых подробно описывается синтез O- и N-гетероциклов с помощью RCM с использованием молибден-алкилиденовых катализаторов Шрока, которые оказались более надежными и толерантными к функциональным группам, чем катализаторы на основе хлорида вольфрама. [16] [17] Синтетический путь позволил получить дигидропираны с высоким выходом (89-93%) из легкодоступных исходных материалов. [16] Кроме того, был продемонстрирован синтез замещенных пирролинов , тетрагидропиридинов и амидов с выходом от умеренного до высокого (73-89%). [17] Движущая сила реакции циклизации была объяснена энтропийной благоприятностью за счет образования двух молекул на одну молекулу исходного материала. Потеря второй молекулы, этилена , очень летучего газа, запускает реакцию в прямом направлении в соответствии с принципом Ле Шателье . [16]

В 1993 году Граббс и другие не только опубликовали отчет о синтезе карбоциклов с использованием молибденового катализатора [18] , но также подробно рассказали о первоначальном использовании нового карбенового комплекса рутения для реакций метатезиса, который позже стал популярным катализатором из-за его исключительной полезности. Рутениевые катализаторы не чувствительны к воздуху и влаге, в отличие от молибденовых катализаторов. [19] Рутениевые катализаторы, более известные как катализаторы Граббса , а также молибденовые катализаторы или катализаторы Шрока , до сих пор используются для многих реакций метатезиса, включая RCM. В целом, было показано, что реакции RCM, катализируемые металлами, очень эффективны в реакциях образования связей CC и будут иметь большое значение в органическом синтезе , химической биологии , материаловедении и различных других областях для доступа к широкому спектру ненасыщенных и высокофункционализированных соединений. циклические аналоги. [2] [3]
Механизм метатезиса олефинов , катализируемого переходными металлами , широко исследовался за последние сорок лет. [20] RCM проходит тот же механизм, что и другие реакции метатезиса олефинов , такие как перекрестный метатезис (CM), метатезисная полимеризация с раскрытием кольца (ROMP) и метатезис ациклических диенов (ADMET) . [21] Поскольку все этапы каталитического цикла считаются обратимыми, некоторые из этих других путей могут пересекаться с RCM в зависимости от условий реакции и субстратов. [12] В 1971 году Шовен предложил образование промежуточного металлоциклобутана посредством [2+2] циклоприсоединения [21] [22] , которое затем циклоэлиминируется с образованием тех же алкенов и каталитических частиц (непродуктивный путь) или с образованием нового каталитические частицы и алкилиден (продуктивный путь). [23] Этот механизм получил широкое признание среди химиков и служит моделью механизма RCM. [24]

Инициирование происходит путем замещения алкенового лиганда катализатора субстратом. Этот процесс происходит посредством образования нового алкилидена в результате одного цикла [2+2] циклоприсоединения и циклоэлиминирования. Ассоциация и диссоциация фосфинового лиганда происходит также в случае катализаторов Граббса. [25] В реакции RCM алкилиден подвергается внутримолекулярному [2+2] циклоприсоединению со вторым реакционноспособным концевым алкеном на той же молекуле, а не межмолекулярному присоединению второй молекулы исходного материала, распространенной конкурирующей побочной реакции, которая может приводят к полимеризации. [26] Циклоэлиминирование промежуточного металлоциклобутана приводит к образованию желаемого продукта RCM вместе с частицами [M]=CH 2 или алкилидена , которые повторно входят в каталитический цикл. Хотя потеря летучего этилена является движущей силой РКМ, [24] она также генерируется конкурирующими реакциями метатезиса и поэтому не может считаться единственной движущей силой реакции. [2]
Реакция может находиться под кинетическим или термодинамическим контролем в зависимости от точных условий реакции, катализатора и субстрата. Обычные кольца, 5-7-членные циклоалкены, имеют высокую склонность к образованию и часто находятся под большим термодинамическим контролем из-за энтальпийной благоприятности циклических продуктов, как показали Иллюминаты и Мандолини при образовании лактонных колец. [27] Меньшие кольца, от 5 до 8 атомов, термодинамически более предпочтительны по сравнению со средними и большими кольцами из-за более низкой деформации кольца . Деформация кольца возникает из-за аномальных валентных углов, что приводит к более высокой теплоте сгорания по сравнению с линейным аналогом. [27] Если продукт RCM содержит напряженный олефин, полимеризация становится предпочтительной посредством метатезисной полимеризации с раскрытием кольца вновь образованного олефина. [28] Средние кольца, в частности, имеют большую кольцевую деформацию, отчасти из-за большего трансаннулярного взаимодействия с противоположных сторон кольца, а также из-за неспособности ориентировать молекулу таким образом, чтобы предотвратить штрафные взаимодействия . [27] [29] RCM можно считать имеющим кинетическую предвзятость, если продукты не могут повторно войти в каталитический цикл или взаимопреобразоваться посредством равновесия. Кинетическое распределение продуктов может привести в основном к продуктам РКМ или к олигомерам и полимерам, которые чаще всего не одобряются. [2]

С появлением более реакционноспособных катализаторов довольно часто наблюдается равновесное РКМ, что может привести к большему распределению продуктов. Механизм можно расширить, включив в него различные конкурирующие равновесные реакции, а также указав, где на пути реакции образуются различные побочные продукты, такие как олигомеры. [30]
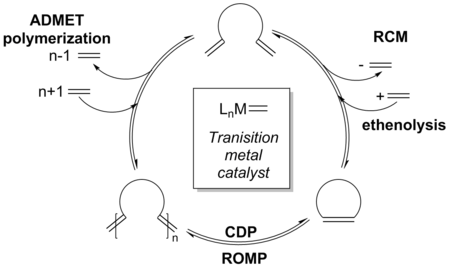
Хотя реакция все еще находится под термодинамическим контролем, исходный кинетический продукт , которым может быть димеризация или олигомеризация исходного материала, образуется в начале реакции в результате более высокой реакционной способности катализатора. Повышенная активность катализатора также позволяет олефиновым продуктам повторно войти в каталитический цикл посредством неконцевого присоединения алкена к катализатору. [2] [31] [32] Благодаря дополнительной реакционной способности напряженных олефинов наблюдается равновесное распределение продуктов; однако это равновесие можно нарушить с помощью различных методов, чтобы изменить соотношение продуктов в пользу желаемого продукта РКМ. [33] [34]

Поскольку вероятность встречи реакционноспособных групп в одной и той же молекуле обратно пропорциональна размеру кольца, необходимое внутримолекулярное циклоприсоединение становится все более трудным по мере увеличения размера кольца. Эта взаимосвязь означает, что РКМ больших колец часто проводят при высоком разбавлении (0,05–100 мМ) (А) [2] [35] для уменьшения межмолекулярных реакций; в то время как ОКМ общих колец можно проводить при более высоких концентрациях, в редких случаях даже в чистом виде . [36] [37] Равновесную реакцию можно довести до желаемых термодинамических продуктов за счет увеличения температуры (B) , чтобы уменьшить вязкость реакционной смеси и, следовательно, увеличить тепловое движение, а также увеличить или уменьшить время реакции (C) . [30] [38]
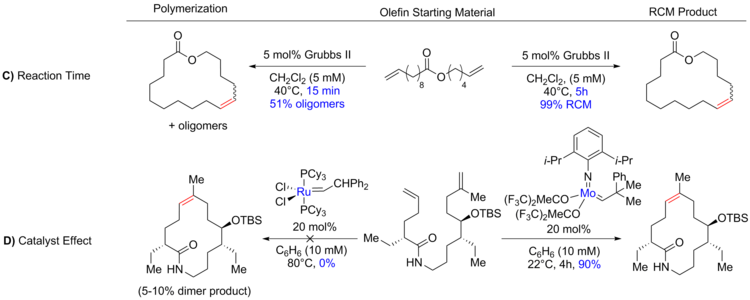
Также было показано, что выбор катализатора (D) имеет решающее значение для контроля образования продукта. Некоторые из катализаторов, обычно используемых в метатезисе с замыканием цикла, показаны ниже. [11] [39] [40] [41]
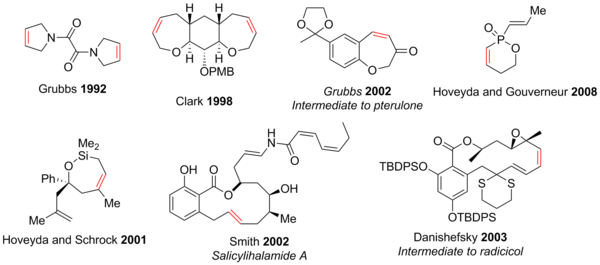
Метатезис с замыканием кольца показал полезность в синтезе 5-30-членных колец, [42] полициклов и гетероциклов, содержащих такие атомы, как N , O , S , P и даже Si . [2] [3] [43] [44] Благодаря толерантности к функциональным группам современные реакции РКМ позволяют синтезировать структурно сложные соединения, содержащие ряд функциональных групп, таких как эпоксиды , кетоны , спирты , простые эфиры , амины , амиды и многие другие могут быть достигнуты легче, чем предыдущие методы. Гетероциклы кислорода и азота доминируют из-за их обилия в натуральных продуктах и фармацевтических препаратах. Некоторые примеры показаны ниже (красный алкен указывает на связь CC, образованную посредством RCM). [3]
Помимо концевых алкенов , в реакциях RCM использовались три- и тетразамещенные алкены для получения продуктов замещенных циклических олефинов. [32] Метатезис с замыканием кольца также использовался для циклизации колец, содержащих алкин , с образованием нового концевого алкена или даже для повторной циклизации с образованием велосипедов. Этот тип реакции более формально известен как метатезис с замыканием енинового кольца . [7] [45]

В реакциях RCM могут образовываться два возможных геометрических изомера : E- или Z- изомер . Стереоселективность зависит от катализатора, деформации кольца и исходного диена. В кольцах меньшего размера преобладают Z- изомеры как более стабильный продукт, что отражает минимизацию деформации кольца. [46] В макроциклах E- изомер часто получается в результате термодинамической предвзятости в реакциях RCM, поскольку E- изомеры более стабильны по сравнению с Z- изомерами . Как правило, рутениевые катализаторы NHC (N-гетероциклический карбен) способствуют селективности E по образованию транс-изомера. Частично это связано с стерическим столкновением между заместителями, которые принимают транс-конфигурацию как наиболее стабильную конформацию в промежуточном металлоциклобутане с образованием E- изомера . [21] Синтез стереочистых Z- изомеров ранее достигался посредством метатезиса алкинов с замыканием цикла . Однако в 2013 году Граббс сообщил об использовании хелатирующего рутениевого катализатора для получения Z- макроциклов с высокой селективностью. Селективность объясняется усилением стерического столкновения между лигандами катализатора и образующимся промежуточным металлоциклобутаном. Повышенные стерические взаимодействия в переходном состоянии приводят к образованию олефина Z , а не олефина E , поскольку переходное состояние, необходимое для образования E- изомера, крайне нежелательно. [47]

Добавки также используются для изменения конформационных предпочтений, увеличения концентрации реакции и хелатирования высокополярных групп, таких как сложные эфиры или амиды , которые могут связываться с катализатором. [2] Изопропоксид титана (Ti(O i Pr) 4 ) обычно используется для хелатирования полярных групп во избежание отравления катализатора , а в случае сложного эфира кислота Льюиса титана связывает карбонильный кислород. Как только кислород образует хелат с титаном, он больше не может связываться с металлическим рутением катализатора, что приведет к дезактивации катализатора. Это также позволяет проводить реакцию при более высокой эффективной концентрации без димеризации исходного материала. [48]

Другим классическим примером является использование объемистой кислоты Льюиса для образования E- изомера сложного эфира вместо предпочтительного Z -изомера для циклолактонизации средних колец. В одном исследовании добавление трис(2,6-дифенилфеноксида) алюминия (АТФН) привело к образованию 7-членного лактона. Металлический алюминий связывается с карбонильным кислородом, заставляя объемные дифенилфеноксидные группы находиться в непосредственной близости от сложноэфирного соединения. В результате сложный эфир принимает E- изомер , чтобы минимизировать штрафные стерические взаимодействия. Без кислоты Льюиса наблюдалось только 14-членное димерное кольцо. [49]

Путем ориентации молекулы таким образом, чтобы два реакционноспособных алкена находились в непосредственной близости, риск межмолекулярного перекрестного метатезиса сводится к минимуму.
Многие реакции метатезиса с рутениевыми катализаторами затрудняются нежелательной изомеризацией вновь образованной двойной связи, и считается, что за это ответственны гидриды рутения , образующиеся в качестве побочной реакции. В одной работе [50] было обнаружено, что изомеризация подавляется в реакции РКМ диаллилового эфира со специфическими добавками, способными удалять эти гидриды . Без добавки продуктом реакции является 2,3-дигидрофуран , а не ожидаемый 2,5-дигидрофуран (вместе с образованием газообразного этилена ). Поглотители радикалов , такие как TEMPO или фенол , не подавляют изомеризацию ; однако такие добавки, как 1,4-бензохинон или уксусная кислота, успешно предотвращают нежелательную изомеризацию . Обе добавки способны окислять гидриды рутения , что может объяснить их поведение.

Другой распространенной проблемой, связанной с RCM, является риск деградации катализатора из-за высокого разбавления, необходимого для некоторых циклизаций. Высокое разбавление также является ограничивающим фактором в промышленном применении из-за большого количества отходов, образующихся в результате крупномасштабных реакций при низкой концентрации. [2] Были предприняты усилия по увеличению концентрации реакции без ущерба для селективности. [51]
Метатезис замыкания цикла исторически использовался во многих органических синтезах и продолжает использоваться сегодня в синтезе различных соединений. Следующие примеры лишь отражают широкую полезность RCM, поскольку существует множество возможностей. Дополнительные примеры см. во многих обзорных статьях. [2] [3] [13] [42]
Метатезис, замыкающий кольцо, важен для тотального синтеза . Одним из примеров является его использование для образования 12-членного кольца в синтезе встречающегося в природе циклофана- флорезолида. Флорезолид B был выделен из асцидии рода Apidium и показал цитотоксичность в отношении опухолевых клеток KB. В 2005 году К.С. Николау и другие завершили синтез обоих изомеров посредством метатезиса с замыканием цикла на поздней стадии с использованием катализатора Граббса 2-го поколения, чтобы получить смесь E- и Z- изомеров (1:3 E/Z ) с выходом 89%. . Хотя присутствует один прохиральный центр, продукт является рацемическим . Флоресолид является атропоизомером , поскольку новое кольцо образуется (из-за стерических ограничений в переходном состоянии), проходя через переднюю часть карбонильной группы, а не через заднюю. Карбонильная группа затем навсегда фиксирует кольцо на месте. Затем E /Z -изомеры разделяли, а затем на последней стадии удаляли защитную группу фенолнитробензоата с помощью карбоната калия с получением конечного продукта и неприродного Z -изомера. [52]

В 1995 году Роберт Граббс и другие подчеркнули возможную стереоселективность с помощью RCM. Группа синтезировала диен с внутренней водородной связью, образующей β-виток. Водородная связь стабилизировала предшественник макроцикла, помещая оба диена в непосредственной близости, готовя к метатезису. После воздействия на смесь диастереомеров условий реакции был получен только один диастереомер β-поворота олефина. Затем эксперимент был повторен с пептидами ( S,S,S ) и ( R,S,R ) . Только диастереомер ( S,S,S ) был реакционноспособным, что иллюстрирует конфигурацию, необходимую для возможности замыкания кольца. Абсолютная конфигурация олефинового продукта имитирует конфигурацию дисульфидного пептида Баларама. [53]

Кольцевая деформация в кольцах из 8-11 атомов оказалась сложной задачей для RCM; однако во многих случаях эти циклические системы были синтезированы. [3] В 1997 году Фюрстнер сообщил о легком синтезе для доступа к кетолактону жасмина ( E/Z ) посредством заключительного этапа RCM. В то время никакое предыдущее 10-членное кольцо не было сформировано посредством RCM, и предыдущие синтезы часто были длительными, включая макролактонизацию с образованием деканолида. Добавляя диен и катализатор в течение 12 часов к кипящему толуолу, Фюрстнер смог избежать олигомеризации и получить оба E/Z -изомера с выходом 88%. CH 2 Cl 2 способствовал образованию Z- изомера в соотношении 1:2,5 ( E/Z ), тогда как толуол давал только смесь 1:1,4 ( E/Z ). [54]

В 2000 году Алоис Фюрстнер сообщил о восьмиэтапном синтезе доступа к (-)-баланолу с использованием RCM с образованием 7-членного промежуточного гетероцикла. Баланол представляет собой метаболит, выделенный из erticiullium balanoides и проявляющий ингибирующее действие в отношении протеинкиназы C (PKC) . На стадии метатезиса замыкания кольца в качестве предварительного катализатора использовали инденилиденовый комплекс рутения, чтобы получить желаемое 7-членное кольцо с выходом 87%. [55]

В 2002 году Стивен Ф. Мартин и другие сообщили о 24-этапном синтезе манзамина А с двумя стадиями метатезиса с замыканием кольца для доступа к полициклическому алкалоиду . [56] Натуральный продукт был выделен из морских губок у побережья Окинавы. Манзамин является хорошей мишенью из-за его потенциала в качестве противоопухолевого соединения. Первым шагом RCM было формирование 13-членного кольца D исключительно в виде Z -изомера с выходом 67%, что является уникальным отличием от обычного предпочтительного E -изомера метатезиса. После дальнейших преобразований второй RCM использовали для образования 8-членного E-кольца с выходом 26% с использованием стехиометрического катализатора Граббса 1-го поколения. Синтез подчеркивает способность к реакциям метатезиса толерантности к функциональным группам, а также способность получать доступ к сложным молекулам с кольцами разного размера. [56]

В 2003 году Данишефский и другие сообщили о полном синтезе (+)-миграстатина , макролида , выделенного из Streptomyces , который ингибировал миграцию опухолевых клеток. [57] Макролид содержит 14 - членный гетероцикл, который образуется посредством RCM. Реакция метатезиса дала защищенный мигстатин с выходом 70% в виде только ( E,E,Z )-изомера. Сообщается, что эта селективность возникает из-за предпочтения рутениевого катализатора сначала добавляться к менее затрудненному олефину, а затем циклизоваться до наиболее доступного олефина. Окончательное снятие защиты с силилового эфира дало (+)-миграстатин . [57]

В целом, метатезис с замыканием цикла является очень полезной реакцией для быстрого получения циклических соединений различного размера и химического состава; однако у него есть некоторые ограничения, такие как высокое разбавление, селективность и нежелательная изомеризация.