Компартментальные модели являются очень общей техникой моделирования. Они часто применяются для математического моделирования инфекционных заболеваний . Популяция распределяется по компартментам с метками – например, S , I или R ( восприимчивый, инфекционный или выздоровевший ) . Люди могут переходить из компартмента в компартмент. Порядок меток обычно показывает закономерности потоков между компартментами; например, SEIS означает восприимчивый , подвергшийся воздействию, инфекционный, затем снова восприимчивый.
Такие модели появились в начале 20-го века, и наиболее важными из них были работы Росса [1] в 1916 году, Росса и Хадсона в 1917 году, [2] [3] Кермака и Маккендрика в 1927 году, [4] и Кендалла в 1956 году. [5] Модель Рида–Фроста также была важным и широко игнорируемым предшественником современных подходов к эпидемиологическому моделированию. [6]
Чаще всего модели реализуются с помощью обыкновенных дифференциальных уравнений (которые являются детерминированными), но их также можно использовать со стохастической (случайной) структурой, которая более реалистична, но гораздо сложнее для анализа.
Эти модели используются для анализа динамики заболевания и оценки общего числа инфицированных людей, общего числа выздоровевших людей, а также для оценки эпидемиологических параметров, таких как базовое репродуктивное число или эффективное репродуктивное число . Такие модели могут показать, как различные вмешательства общественного здравоохранения могут повлиять на исход эпидемии.
Модель SIR [7] [8] [9] [10] является одной из самых простых моделей отсеков, и многие модели являются производными от этой базовой формы. Модель состоит из трех отсеков:
Эта модель является достаточно прогнозируемой [11] для инфекционных заболеваний, которые передаются от человека к человеку и при которых выздоровление приводит к стойкой резистентности, таких как корь , эпидемический паротит и краснуха .

Эти переменные ( S , I и R ) представляют собой количество людей в каждом отсеке в определенное время. Чтобы представить, что количество восприимчивых, инфекционных и удаленных лиц может меняться со временем (даже если общая численность популяции остается постоянной), мы делаем точные числа функцией t (времени): S ( t ), I ( t ) и R ( t ). Для конкретного заболевания в конкретной популяции эти функции могут быть разработаны для того, чтобы предсказать возможные вспышки и взять их под контроль. [11] Обратите внимание, что в модели SIR и являются разными величинами — первая описывает количество выздоровевших при t = 0, тогда как вторая описывает отношение между частотой контактов и частотой выздоровления.
Как следует из переменной функции t , модель является динамической в том смысле, что количество в каждом отсеке может колебаться с течением времени. Важность этого динамического аспекта наиболее очевидна в эндемическом заболевании с коротким инфекционным периодом, таком как корь в Великобритании до введения вакцины в 1968 году. Такие заболевания, как правило, возникают циклами вспышек из-за изменения количества восприимчивых лиц (S( t )) с течением времени. Во время эпидемии количество восприимчивых лиц быстро падает по мере того, как все большее их число заражается и, таким образом, попадает в инфекционные и удаленные отсеки. Болезнь не может вспыхнуть снова, пока количество восприимчивых лиц не восстановится, например, в результате рождения потомства в восприимчивом отсеке. [ необходима цитата ]

Каждый член популяции обычно прогрессирует от восприимчивого к инфицированному до выздоровевшего. Это можно изобразить в виде диаграммы потока, в которой блоки представляют различные отсеки, а стрелки — переход между отсеками (см. диаграмму).

Для полной спецификации модели стрелки должны быть помечены скоростями перехода между отсеками. Между S и I скорость перехода предполагается равной , где — общая численность населения, — среднее количество контактов на человека за единицу времени, умноженное на вероятность передачи заболевания при контакте между восприимчивым и инфекционным субъектом, и — доля всех возможных контактов, в которых участвуют инфекционный и восприимчивый человек. (Это математически похоже на закон действующих масс в химии, в котором случайные столкновения между молекулами приводят к химической реакции, а дробная скорость пропорциональна концентрации двух реагентов. [12] )
Между I и R скорость перехода предполагается пропорциональной числу инфекционных индивидуумов, что равно . Если индивидуум заразен в течение среднего периода времени , то . Это также эквивалентно предположению, что продолжительность времени, проведенного индивидуумом в инфекционном состоянии, является случайной величиной с экспоненциальным распределением . «Классическая» модель SIR может быть модифицирована путем использования более сложных и реалистичных распределений для скорости перехода IR (например, распределение Эрланга ). [13]
Для особого случая, когда нет удаления из инфекционного отсека ( ), модель SIR сводится к очень простой модели SI, которая имеет логистическое решение, в котором каждый человек в конечном итоге становится инфицированным.

Динамика эпидемии, например, гриппа , часто намного быстрее динамики рождения и смерти, поэтому рождение и смерть часто опускаются в простых компартментальных моделях. Система SIR без так называемой жизненно важной динамики (рождения и смерти, иногда называемой демографией), описанная выше, может быть выражена следующей системой обыкновенных дифференциальных уравнений : [8] [14]

где — численность восприимчивого населения, — численность инфицированного населения, — численность удаленного населения (в результате смерти или выздоровления), — сумма этих трех показателей.
Эта модель была впервые предложена Уильямом Огилви Кермаком и Андерсоном Греем Маккендриком как частный случай того, что мы сейчас называем теорией Кермака–Маккендрика , и стала продолжением работы Маккендрика с Рональдом Россом . [ требуется ссылка ]
Эта система нелинейна , однако можно вывести ее аналитическое решение в неявном виде. [7] Во-первых, отметим, что из:
отсюда следует, что:
выражая в математических терминах постоянство популяции . Обратите внимание, что приведенное выше соотношение подразумевает, что нужно изучать уравнение только для двух из трех переменных.
Во-вторых, отметим, что динамика инфекционного класса зависит от следующего соотношения:
так называемое базовое репродуктивное число (также называемое базовым репродуктивным коэффициентом). Это отношение выводится как ожидаемое число новых инфекций (эти новые инфекции иногда называют вторичными инфекциями) от одной инфекции в популяции, где все субъекты восприимчивы. [15] [16] Эту идею, вероятно, можно легче увидеть, если мы скажем, что типичное время между контактами составляет , а типичное время до удаления составляет . Отсюда следует, что в среднем число контактов инфекционного человека с другими до того, как инфекционный человек был удален, составляет:
Разделив первое дифференциальное уравнение на третье, разделив переменные и проинтегрировав, получим
где и — начальные числа соответственно восприимчивых и удаленных субъектов. Записывая начальную долю восприимчивых особей, и и для доли восприимчивых и удаленных особей соответственно в пределе, имеем
(обратите внимание, что инфекционный отсек опустошается в этом пределе). Это трансцендентное уравнение имеет решение в терминах функции Ламберта W , [17] , а именно
Это показывает, что в конце эпидемии, которая соответствует простым предположениям модели SIR, если только не все особи популяции были удалены, поэтому некоторые должны остаться восприимчивыми. Движущей силой, ведущей к окончанию эпидемии, является снижение числа заразных особей. Эпидемия обычно не заканчивается из-за полного отсутствия восприимчивых особей.
Роль как базового числа размножения, так и начальной восприимчивости чрезвычайно важна. Фактически, переписав уравнение для инфекционных особей следующим образом:
получается, что если:
затем:
т.е. будет настоящая эпидемическая вспышка с ростом числа заразившихся (которое может охватить значительную часть населения). Напротив, если
затем
т. е. независимо от первоначальной численности восприимчивой популяции болезнь никогда не может вызвать настоящую эпидемическую вспышку. Вследствие этого ясно, что как базовое репродуктивное число, так и начальная восприимчивость чрезвычайно важны.
Обратите внимание, что в приведенной выше модели функция:
моделирует скорость перехода из отсека восприимчивых особей в отсек инфекционных особей, поэтому она называется силой инфекции . Однако для больших классов инфекционных заболеваний более реалистично рассматривать силу инфекции, которая зависит не от абсолютного числа инфекционных субъектов, а от их доли (по отношению к общей постоянной популяции ):
Капассо [18] и впоследствии другие авторы предложили использовать нелинейные силы инфекции для более реалистичного моделирования процесса заражения.
В 2014 году Харко и соавторы вывели точное так называемое аналитическое решение (включающее интеграл, который можно вычислить только численно) для модели SIR. [7] В случае без настройки жизненно важной динамики, для и т. д., оно соответствует следующей временной параметризации
для
с начальными условиями
где удовлетворяет . Из трансцендентного уравнения для выше следует, что , если и .
Эквивалентное так называемое аналитическое решение (включающее интеграл, который можно вычислить только численно), найденное Миллером [19] [20] , дает
Здесь можно интерпретировать как ожидаемое количество передач, полученных индивидуумом за время . Два решения связаны соотношением .
По сути, тот же результат можно найти в оригинальной работе Кермака и Маккендрика. [4]
Эти решения можно легко понять, заметив, что все члены в правых частях исходных дифференциальных уравнений пропорциональны . Таким образом, уравнения можно разделить на , а время перемасштабировать так, чтобы дифференциальный оператор в левой части стал просто , где , т.е. . Теперь все дифференциальные уравнения линейны, а третье уравнение, имеющее вид const., показывает, что и (и выше) просто линейно связаны.
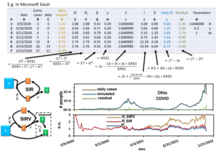
Высокоточное аналитическое приближение модели SIR, а также точные аналитические выражения для конечных значений , и были предоставлены Крёгером и Шликайзером [9] , так что нет необходимости выполнять численное интегрирование для решения модели SIR (упрощенный пример практики численного моделирования COVID-19 с использованием Microsoft Excel можно найти здесь [21] ), для получения ее параметров из существующих данных или для прогнозирования будущей динамики эпидемий, смоделированных моделью SIR. Аппроксимант включает функцию Ламберта W , которая является частью всех основных программ для визуализации данных, таких как Microsoft Excel, MATLAB и Mathematica .
В то время как Кендалл [5] рассматривал так называемую модель SIR на все времена, где начальные условия , и связаны через приведенные выше соотношения, Кермак и Маккендрик [4] предложили изучить более общий случай полувремени, для которого и оба являются произвольными. Эта последняя версия, обозначенная как модель SIR на полувремени, [9] делает прогнозы только для будущих времен . Аналитическая аппроксимация и точные выражения для конечных значений также доступны для модели SIR на полувремени. [10]
Численные решения для модели SIR можно найти в литературе. Примером является использование модели для анализа данных о распространении COVID-19 . [21] [22] Три числа воспроизводства можно вывести из данных, проанализированных с помощью численной аппроксимации,
представляет собой скорость скорости размножения в начале распространения, когда все популяции считаются восприимчивыми, например, если и означает, что один инфицированный человек в среднем заражает 0,4 восприимчивых людей в день и выздоравливает через 1/0,2=5 дней. Таким образом, когда этот человек выздоровел, есть два человека, которые все еще заразны напрямую от этого человека и , т. е. число инфицированных людей удвоилось за один цикл из 5 дней. Данные, смоделированные моделью с или реальными данными, подогнанными, дадут удвоение числа инфицированных людей быстрее, чем за 5 дней, потому что двое инфицированных людей заражают других. Из модели SIR мы можем сказать, что определяется природой заболевания, а также функцией частоты взаимодействия между инфицированным человеком и восприимчивыми людьми , а также интенсивностью/длительностью взаимодействия, например, насколько близко они взаимодействуют и как долго, и носят ли они оба маски, таким образом, он меняется со временем, когда меняется среднее поведение носителей и восприимчивых людей. Модель используется для представления этих факторов, но на самом деле она относится к начальной стадии, когда не предпринимается никаких действий для предотвращения распространения и все население восприимчиво, поэтому все изменения поглощаются изменением .
обычно более стабилен с течением времени, если предположить, что когда у заразного человека проявятся симптомы, он/она обратится за медицинской помощью или самоизолируется. Поэтому, если мы обнаружим изменения, скорее всего, поведение людей в сообществе изменилось по сравнению с их обычными моделями до вспышки, или болезнь мутировала в новую форму. Затратное массовое выявление и изоляция восприимчивых близких контактов оказывают влияние на снижение, но эффективность этого является предметом споров. Этот спор в основном касается неопределенности количества дней, сокращенных с момента заражения или обнаружения, в зависимости от того, что наступит раньше, до появления симптома у инфицированного восприимчивого человека. Если человек заразен после появления симптомов или обнаружение работает только для человека с симптомами, то эти методы профилактики не нужны, и самоизоляция и/или медицинская помощь являются лучшим способом сократить значения . Типичное начало инфекционного периода COVID-19 составляет порядка одного дня с момента появления симптомов, что делает массовое выявление с типичной частотой в течение нескольких дней бесполезным.
не говорит нам, ускорится или замедлится распространение на последних стадиях, когда доля восприимчивых людей в сообществе значительно снизится после выздоровления или вакцинации. корректирует этот эффект разбавления, умножая долю восприимчивой популяции на общую численность популяции. Он корректирует эффективное/передающееся взаимодействие между инфицированным человеком и остальной частью сообщества, когда многие из взаимодействующих являются иммунными на средних и поздних стадиях распространения болезни. Таким образом, когда , мы увидим экспоненциальную вспышку; когда , достигается устойчивое состояние и количество инфицированных людей не меняется с течением времени; и когда , болезнь затухает и исчезает с течением времени.
Используя дифференциальные уравнения модели SIR и преобразуя их в числовые дискретные формы, можно настроить рекурсивные уравнения и вычислить популяции S, I и R с любыми заданными начальными условиями, но накапливать ошибки в течение длительного времени расчета от точки отсчета. Иногда для оценки ошибок требуется тест сходимости . При наличии набора начальных условий и данных о распространении заболеваний можно также подогнать данные к модели SIR и вытащить три числа воспроизводства, когда ошибки обычно незначительны из-за короткого временного шага от точки отсчета. [21] [22] Любую точку времени можно использовать в качестве начального условия для прогнозирования будущего после нее с использованием этой числовой модели с предположением о временных параметрах, таких как популяция, и . Однако вдали от этой точки отсчета ошибки будут накапливаться с течением времени, поэтому необходим тест сходимости , чтобы найти оптимальный временной шаг для более точных результатов.
Среди этих трех чисел воспроизводства очень полезно для оценки давления контроля, например, большое значение означает, что болезнь будет распространяться очень быстро и ее очень трудно контролировать. наиболее полезно для прогнозирования будущих тенденций, например, если мы знаем, что социальные взаимодействия сократились на 50% часто по сравнению с тем, что было до вспышки, а интенсивность взаимодействия между людьми осталась прежней, то мы можем установить . Если социальное дистанцирование и маски добавляют еще 50% снижения эффективности заражения, мы можем установить . будет идеально коррелировать с волнами распространения и всякий раз , когда распространение ускоряется, а когда распространение замедляется, таким образом, полезно для установления прогноза краткосрочных тенденций. Кроме того, его можно использовать для прямого расчета пороговой популяции вакцинации/иммунизации для стадии коллективного иммунитета , установив , и , т. е . .
Рассмотрим популяцию, характеризующуюся уровнем смертности и рождаемости , и где распространяется инфекционное заболевание. [8] Модель с массовым распространением выглядит следующим образом:
для которого равновесие без заболеваний (РБЗ) равно:
В этом случае мы можем вывести базовое репродуктивное число :
который имеет пороговые свойства. Фактически, независимо от биологически значимых начальных значений, можно показать, что:
Точка EE называется эндемическим равновесием (болезнь полностью не искоренена и остается в популяции). С помощью эвристических аргументов можно показать, что можно интерпретировать как среднее число инфекций, вызванных одним инфекционным субъектом в полностью восприимчивой популяции, указанное выше соотношение биологически означает, что если это число меньше или равно единице, болезнь вымирает, тогда как если это число больше единицы, болезнь останется постоянно эндемичной в популяции.


В 1927 году WO Kermack и AG McKendrick создали модель, в которой они рассматривали фиксированную популяцию только с тремя отсеками: восприимчивый, ; инфицированный, ; и выздоровевший, . Отсеки, используемые для этой модели, состоят из трех классов: [4]
Поток этой модели можно рассматривать следующим образом:
Используя фиксированную популяцию, в трех функциях решается, что значение должно оставаться постоянным в рамках моделирования, если моделирование используется для решения модели SIR. В качестве альтернативы можно использовать аналитическую аппроксимацию [9] без выполнения моделирования. Модель запускается со значениями , и . Это количество людей в категориях восприимчивых, инфицированных и удаленных в момент времени, равный нулю. Если предполагается, что модель SIR выполняется во все времена, эти начальные условия не являются независимыми. [9] Впоследствии модель потока обновляет три переменные для каждой точки времени с заданными значениями для и . Сначала моделирование обновляет инфицированных из восприимчивых, а затем удаленная категория обновляется из категории инфицированных для следующей точки времени (t=1). Это описывает поток лиц между тремя категориями. Во время эпидемии категория восприимчивых не смещается с этой моделью, изменяется в ходе эпидемии, как и . Эти переменные определяют продолжительность эпидемии и должны обновляться с каждым циклом.
При формулировке этих уравнений было сделано несколько предположений: во-первых, индивидуум в популяции должен считаться имеющим равную вероятность заражения болезнью, как и любой другой индивидуум, с частотой и равной долей людей, с которыми индивидуум контактирует за единицу времени. Затем пусть будет произведением и . Это вероятность передачи, умноженная на частоту контактов. Кроме того, инфицированный индивидуум контактирует с людьми за единицу времени, тогда как только часть из них восприимчива. Таким образом, у нас есть каждый инфицированный может заразить восприимчивых людей, и, следовательно, общее число восприимчивых людей, инфицированных инфицированными за единицу времени, равно . Для второго и третьего уравнений считайте, что население, покидающее восприимчивый класс, равно числу, входящему в инфицированный класс. Однако число, равное доле (которая представляет собой средний показатель выздоровления/смертности или средний инфекционный период) инфицированных, покидает этот класс за единицу времени, чтобы войти в удаленный класс. Эти процессы, которые происходят одновременно, называются Законом Массового Действия, широко принятой идеей, что скорость контакта между двумя группами в популяции пропорциональна размеру каждой из затронутых групп. Наконец, предполагается, что скорость заражения и выздоровления намного быстрее, чем временная шкала рождений и смертей, и поэтому эти факторы игнорируются в этой модели. [23]
Единственное устойчивое решение для классической модели SIR, как определено дифференциальными уравнениями выше, это I=0, S и R могут тогда принимать любые значения. Модель можно изменить, сохранив три отсека, чтобы получить устойчивое эндемическое решение, добавив некоторые входные данные в отсек S.
Например, можно постулировать, что ожидаемая продолжительность восприимчивости будет равна , где отражает время жизни (ожидаемая продолжительность жизни) и отражает время в восприимчивом состоянии до заражения, что можно упростить [24] до:
таким образом, что число восприимчивых лиц равно числу, входящему в восприимчивый отсек, умноженному на продолжительность восприимчивости:
Аналогично, устойчивое число инфицированных лиц — это число, переходящее в инфицированное состояние из восприимчивого состояния (число восприимчивых, умноженное на скорость заражения), умноженное на продолжительность инфицирования :
Существует множество модификаций модели SIR, включая те, которые включают в себя рождение и смерть, где после выздоровления иммунитет отсутствует (модель SIS), где иммунитет сохраняется только в течение короткого периода времени (SIRS), где есть латентный период болезни, когда человек не заразен (SEIS и SEIR), и где младенцы могут рождаться с иммунитетом (MSIR). Компартментальные модели также могут использоваться для моделирования множественных групп риска и даже взаимодействия множественных патогенов. [25]
Некоторые инфекции, например, простудные и гриппозные , не дают длительного иммунитета. Такие инфекции могут давать временную резистентность, но не дают длительного иммунитета после выздоровления, и люди снова становятся восприимчивыми.

У нас есть модель:
Обратите внимание, что если обозначить через N общую численность населения, то получится:
Из этого следует, что:
т.е. динамика инфекционных заболеваний подчиняется логистической функции , так что :
Можно найти аналитическое решение этой модели (выполнив преобразование переменных: и подставив это в уравнения среднего поля), [26] так, чтобы базовая скорость воспроизводства была больше единицы. Решение дается как
где — эндемичная инфекционная популяция, и . Поскольку предполагается, что система закрыта, восприимчивая популяция тогда равна .
Всякий раз, когда очевидна целочисленная природа числа агентов (популяции с численностью менее десятков тысяч особей), внутренние колебания в процессе распространения заболевания, вызванные дискретными агентами, приводят к неопределенностям. [27] В этом сценарии эволюция заболевания, предсказанная компартментальными уравнениями, значительно отклоняется от наблюдаемых результатов. Эти неопределенности могут даже привести к тому, что эпидемия закончится раньше, чем предсказывают компартментальные уравнения.
В качестве особого случая можно получить обычную логистическую функцию, предположив . Это также можно рассмотреть в модели SIR с , т.е. никакого удаления не произойдет. Это модель SI . [28] Система дифференциальных уравнений с использованием таким образом сводится к:
В долгосрочной перспективе в модели SI все люди будут инфицированы.


Модель «восприимчивый-инфицированный-выздоровевший-умерший» различает «выздоровевших» (имея в виду конкретно лиц, переживших болезнь и теперь обладающих иммунитетом) и «умерших» . [15] Модель SIRD имеет полуаналитические решения, основанные на методе четырех частей. [29] Эта модель использует следующую систему дифференциальных уравнений:
где — показатели инфицирования, выздоровления и смертности соответственно. [30]
Модель « восприимчивый-инфицированный-выздоровевший-вакцинированный» представляет собой расширенную модель SIR, которая учитывает вакцинацию восприимчивого населения. [31] Эта модель использует следующую систему дифференциальных уравнений:
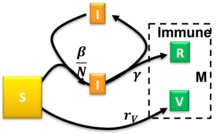
где — скорости инфицирования, выздоровления и вакцинации соответственно. Для начальных условий полупериода , и постоянных соотношений и модель была решена приблизительно. [31] Возникновение вспышки пандемии требует и существует критический сниженный уровень вакцинации, за пределами которого стационарный размер восприимчивого отсека остается относительно близким к . Произвольные начальные условия, удовлетворяющие , могут быть сопоставлены с решенным особым случаем с . [31]
Численное решение этой модели для расчета числа воспроизводства COVID-19 в реальном времени может быть реализовано на основе информации от различных групп населения в сообществе. [22] Численное решение является широко используемым методом анализа сложных кинетических сетей, когда аналитическое решение трудно получить или оно ограничено требованиями, такими как граничные условия или специальные параметры. Оно использует рекурсивные уравнения для расчета следующего шага путем преобразования численного интегрирования в сумму Римана дискретных временных шагов, например, использовать вчерашний основной долг и процентную ставку для расчета сегодняшних процентов, предполагая, что процентная ставка фиксирована в течение дня. Расчет содержит прогнозируемые ошибки, если аналитические поправки на размер числового шага не включены, например, когда процентная ставка годового сбора упрощается до 12-кратной ежемесячной ставки, вводится прогнозируемая ошибка. Таким образом, рассчитанные результаты будут нести накопительные ошибки, когда временной шаг далек от точки отсчета и для оценки ошибки требуется тест сходимости . Однако эта ошибка обычно приемлема для подгонки данных. При подгонке набора данных с близким временным шагом ошибка относительно мала, поскольку опорная точка находится близко по сравнению с прогнозированием длительного периода времени после опорной точки. После того, как реальное время извлечено, его можно сравнить с базовым репродуктивным числом . До вакцинации дает разработчикам политики и широкой общественности меру эффективности мер по смягчению социальных последствий, таких как социальное дистанцирование и ношение масок, просто разделив . При массовой вакцинации целью борьбы с болезнями является снижение эффективного репродуктивного числа , где — численность восприимчивого населения в данный момент, а — общая численность населения. Когда , распространение снижается, и ежедневные случаи заражения снижаются.
Модель эпидемического компартмента восприимчивый -инфицированный-выздоровевший-вакцинированный-умерший (SIRVD) расширяет модель SIR, чтобы включить эффекты кампаний вакцинации и зависящие от времени показатели смертности при вспышках эпидемий. Она охватывает модели SIR, SIRV, SIRD и SI как особые случаи, с индивидуальными зависящими от времени показателями, управляющими переходами между различными фракциями. [32] Эта модель использует следующую систему дифференциальных уравнений для фракций населения :

где - уровни инфицирования, вакцинации, выздоровления и смертности соответственно. Для начальных условий полупериода , , и постоянных соотношений , , и модель была решена приблизительно и точно для некоторых особых случаев, независимо от функциональной формы . [32] Это достигается путем переписывания приведенных выше уравнений модели SIRVD в эквивалентной, но сокращенной форме
где
— это сокращенное, безразмерное время. Временная зависимость инфицированной фракции и скорости новых инфекций различается при рассмотрении эффектов вакцинации и когда зависимость в реальном времени показателей смертности и выздоровления расходится. Эти различия были выделены для стационарных соотношений и постепенно уменьшающихся показателей смертности. [32] Случай стационарных соотношений позволяет построить диагностический метод для аналитического извлечения всех параметров модели SIRVD из измеренных данных COVID-19 завершенной волны пандемии. [32]
Для многих инфекций, включая корь , дети не рождаются в восприимчивом отсеке, но имеют иммунитет к болезни в течение первых нескольких месяцев жизни из-за защиты от материнских антител (передаваемых через плаценту и дополнительно через молозиво ). Это называется пассивным иммунитетом . Эта дополнительная деталь может быть отображена путем включения класса M (для иммунитета, полученного от матери) в начале модели.
Чтобы обозначить это математически, добавляется дополнительный отсек M ( t ) . Это приводит к следующим дифференциальным уравнениям:
Некоторые люди, перенесшие инфекционное заболевание, например, туберкулез, никогда полностью не выздоравливают и продолжают быть носителями инфекции, при этом сами не страдая от болезни. Затем они могут вернуться в инфекционный отсек и страдать от симптомов (как при туберкулезе) или могут продолжать заражать других в состоянии носителя, не страдая от симптомов. Самым известным примером этого, вероятно, является Мэри Маллон , которая заразила брюшным тифом 22 человека . Отсек носителя обозначен как C.
Для многих важных инфекций существует значительный латентный период, в течение которого люди инфицированы, но еще не заразны сами. В течение этого периода человек находится в отсеке E (для подвергшихся воздействию).
Предполагая, что период латентности является случайной величиной с экспоненциальным распределением с параметром (т.е. средний период латентности равен ), а также предполагая наличие динамики жизненно важных функций с уровнем рождаемости, равным уровню смертности (так что общее число является постоянным), мы имеем модель:
У нас есть, но это константа только из-за упрощающего предположения, что показатели рождаемости и смертности равны; в общем случае это переменная величина.
Для этой модели базовое репродуктивное число составляет:
Аналогично модели SIR, в этом случае мы также имеем равновесие без заболеваний ( N , 0, 0, 0) и эндемическое равновесие EE, и можно показать, что независимо от биологически значимых начальных условий
он гласит, что:
В случае периодически изменяющейся скорости контакта условием глобальной привлекательности DFE является выполнение следующей линейной системы с периодическими коэффициентами:
устойчив (т.е. имеет собственные значения Флоке внутри единичной окружности в комплексной плоскости).
Модель SEIS похожа на модель SEIR (выше), за исключением того, что в конце не приобретается иммунитет.
В этой модели инфекция не оставляет никакого иммунитета, поэтому выздоровевшие люди возвращаются к восприимчивости, перемещаясь обратно в отсек S ( t ). Следующие дифференциальные уравнения описывают эту модель:
Для случая заболевания с факторами пассивного иммунитета и латентным периодом существует модель MSEIR.
Модель MSEIRS похожа на MSEIR, но иммунитет в классе R будет временным, так что восприимчивость людей восстановится после окончания временного иммунитета.
Хорошо известно, что вероятность заболевания не постоянна во времени. По мере развития пандемии реакции на пандемию могут изменить частоту контактов, которая в более простых моделях предполагается постоянной. Контрмеры, такие как маски, социальное дистанцирование и локдаун, изменят частоту контактов таким образом, чтобы снизить скорость пандемии.
Кроме того, некоторые заболевания являются сезонными, например, вирусы простуды , которые более распространены зимой. С детскими заболеваниями, такими как корь, свинка и краснуха, существует сильная корреляция со школьным календарем, так что во время школьных каникул вероятность заболеть таким заболеванием резко снижается. Как следствие, для многих классов заболеваний следует учитывать силу инфекции с периодически («сезонной») изменяющейся частотой контактов
с периодом T, равным одному году.
Таким образом, наша модель становится
(динамика восстановленного легко следует из ), т.е. нелинейный набор дифференциальных уравнений с периодически изменяющимися параметрами. Хорошо известно, что этот класс динамических систем может претерпевать очень интересные и сложные явления нелинейного параметрического резонанса. Легко видеть, что если:
тогда как если интеграл больше единицы, болезнь не исчезнет, и могут быть такие резонансы. Например, рассматривая периодически изменяющуюся частоту контактов как «вход» системы, мы имеем, что выход является периодической функцией, период которой кратен периоду входа. Это позволило внести вклад в объяснение полигодичных (обычно двухгодичных) эпидемических вспышек некоторых инфекционных заболеваний как взаимодействия между периодом колебаний частоты контактов и псевдопериодом затухающих колебаний вблизи эндемического равновесия. Примечательно, что в некоторых случаях поведение может быть также квазипериодическим или даже хаотическим.
Пространственно-временные компартментальные модели описывают не общее число, а плотность восприимчивых/инфицированных/выздоровевших лиц. Следовательно, они также позволяют моделировать распределение инфицированных лиц в пространстве. В большинстве случаев это делается путем объединения модели SIR с уравнением диффузии
где , и являются константами диффузии. Таким образом, получается уравнение реакции-диффузии. (Обратите внимание, что по причинам размерности параметр должен быть изменен по сравнению с простой моделью SIR.) Ранние модели этого типа использовались для моделирования распространения черной смерти в Европе. [34] Расширения этой модели использовались для включения, например, эффектов нефармацевтических вмешательств, таких как социальное дистанцирование. [35]
Поскольку социальные контакты, тяжесть заболевания и летальность, а также эффективность профилактических мер могут существенно различаться между взаимодействующими субпопуляциями, например, пожилыми и молодыми, можно использовать отдельные модели SEIR для каждой подгруппы, которые взаимно связаны посредством связей взаимодействия. [33] Такие модели SEIR для взаимодействующих субпопуляций использовались для моделирования пандемии COVID-19 в масштабе континента с целью разработки персонализированных, ускоренных, ориентированных на субпопуляцию стратегий вакцинации [36] , которые обещают сокращение пандемии и снижение числа случаев заболевания и смертей в условиях ограниченного доступа к вакцинам во время волны вирусных вариантов, вызывающих беспокойство.
Модель SIR изучалась на сетях различных типов, чтобы смоделировать более реалистичную форму связи, чем условие однородного смешивания, которое обычно требуется. Простая модель эпидемий на сетях, в которых индивидуум имеет вероятность p заражения от каждого из своих инфицированных соседей в заданный временной шаг, приводит к результатам, аналогичным образованию гигантских компонентов на случайных графах Эрдоша Реньи . [37]
Динамика эпидемий зависит от того, как меняется поведение людей во времени. Например, в начале эпидемии люди невежественны и беспечны, затем, после вспышки эпидемии и тревоги, они начинают соблюдать различные ограничения и распространение эпидемий может пойти на спад. Со временем некоторые люди устают/разочаровываются ограничениями и перестают им следовать (истощение), особенно если количество новых случаев падает. Отдохнув некоторое время, они могут снова следовать ограничениям. Но во время этой паузы может прийти вторая волна и стать еще сильнее первой. Следует учитывать социальную динамику . Модели социальной физики социального стресса дополняют классические модели эпидемий. [38]
Простейшая модель SIR-социального стресса (SIR SS ) организована следующим образом. Восприимчивых лиц (S) можно разделить на три подгруппы по типу поведения: неосведомленные или не знающие об эпидемии (S sign ), рационально устойчивые (S res ) и истощенные (S exh ), которые не реагируют на внешние раздражители (это своего рода рефрактерный период). Другими словами: S(t) = S sign (t) + S res (t) + S exh (t). Символически модель социального стресса можно представить в виде «схемы реакции» (где I обозначает инфицированных лиц):
Основная реакция на эпидемию SIR
имеет разные константы скорости реакции для S sign , S res и S exh . Предположительно, для S res ниже, чем для S sign и S sign .
Различия между странами сосредоточены в двух кинетических константах: скорости мобилизации и скорости истощения, рассчитанных для эпидемии COVID-19 в 13 странах. [38] Эти константы для этой эпидемии во всех странах могут быть извлечены путем подгонки модели SIR SS к общедоступным данным [39]
На основе классической модели SIR были предложены уравнение Кортевега-де Фриза (KdV)–SIR и его аналитическое решение для иллюстрации фундаментальной динамики эпидемической волны, зависимости решений от параметров и зависимости горизонтов предсказуемости от различных типов решений. [40] Уравнение KdV-SIR записывается следующим образом:
.
Здесь,
,
,
и
.
указывает начальное значение переменной состояния . Параметры (σ-ноль) и (R-ноль) являются независимой от времени относительной скоростью роста и основным репродуктивным числом соответственно. представляет максимум переменных состояния (для числа инфицированных лиц). Аналитическое решение уравнения KdV-SIR записывается следующим образом:
,
что представляет собой решение в виде уединенной волны.
Моделирование полной популяции, возможно, из миллионов людей, с использованием двух констант и кажется неправдоподобным; у каждого человека есть личные характеристики, которые влияют на распространение: статус иммунитета, привычки контактов и так далее. Поэтому интересно узнать, что произойдет, если, например, и являются не двумя константами, а некоторыми случайными величинами (по паре для каждого человека). Эта процедура имеет несколько названий: «гетерогенная модель», «структурирование» (см. также ниже модели, структурированные по возрасту) или «байесовский» взгляд. [41] [42] [43] Появляются удивительные результаты, например, в [41] было доказано , что число инфицированных на пике гетерогенной эпидемии меньше, чем детерминированной эпидемии с тем же средним значением ; то же самое справедливо для общего размера эпидемии и других моделей, например SEIR. [41]
Модель SIR может быть модифицирована для моделирования вакцинации. [44] Обычно они вводят дополнительный отсек в модель SIR, для вакцинированных лиц. Ниже приведены некоторые примеры.
При наличии инфекционных заболеваний одной из главных задач является их искоренение с помощью профилактических мер и, по возможности, путем создания программы массовой вакцинации. Рассмотрим заболевание, от которого новорожденные вакцинируются (вакциной, дающей пожизненный иммунитет) с частотой :
где - класс вакцинированных субъектов. Непосредственно показывается, что:
таким образом, мы будем иметь дело с долгосрочным поведением и , для которого справедливо следующее:
Другими словами, если
программа вакцинации не может искоренить болезнь, напротив, она останется эндемичной, хотя и на более низком уровне, чем в случае отсутствия вакцинации. Это означает, что математическая модель предполагает, что для болезни, базовое репродуктивное число которой может достигать 18, необходимо вакцинировать не менее 94,4% новорожденных, чтобы искоренить болезнь.
Современные общества сталкиваются с проблемой «рационального» освобождения, то есть решения семьи не вакцинировать детей в результате «рационального» сравнения предполагаемого риска заражения и риска получения вреда от вакцины. Чтобы оценить, является ли такое поведение действительно рациональным, то есть может ли оно в равной степени привести к искоренению болезни, можно просто предположить, что уровень вакцинации является возрастающей функцией числа инфицированных субъектов:
В таком случае условием ликвидации становится:
т. е. базовый уровень вакцинации должен быть выше порога «обязательной вакцинации», который в случае освобождения не может быть выполнен. Таким образом, «рациональное» освобождение может быть близоруким, поскольку оно основано только на текущей низкой заболеваемости из-за высокого охвата вакцинацией, а не на будущем возобновлении инфекции из-за снижения охвата.
В случае, если вакцинация проводится также и не новорожденным с частотой ρ, уравнение для восприимчивого и вакцинированного субъекта необходимо изменить следующим образом:
приводит к следующему состоянию искоренения:
Эта стратегия многократно вакцинирует определенную возрастную когорту (например, маленьких детей или пожилых людей) в восприимчивой популяции с течением времени. Используя эту стратегию, блок восприимчивых лиц затем немедленно удаляется, что позволяет устранить инфекционное заболевание (например, корь) из всей популяции. Каждые T единиц времени постоянная доля p восприимчивых субъектов вакцинируется за относительно короткое (по отношению к динамике заболевания) время. Это приводит к следующим импульсным дифференциальным уравнениям для восприимчивых и вакцинированных субъектов:
Легко видеть, что, установив I = 0, получаем, что динамика восприимчивых субъектов определяется выражением:
и что условием ликвидации является:
Огромная литература признает, что вакцинацию можно рассматривать как игру: в популяции, где все вакцинированы, любая эпидемия немедленно сойдет на нет, поэтому дополнительный человек вообще не будет заинтересован в вакцинации. Напротив, человек, прибывающий в популяцию, где никто не вакцинирован, будет иметь все стимулы для вакцинации (эпидемия вырвется наружу в такой популяции). Таким образом, кажется, что индивидуум заинтересован делать противоположное по отношению к популяции в целом. Но популяция представляет собой сумму всех индивидуумов, и предыдущее утверждение должно быть ложным. Таким образом, фактически достигается равновесие Нэша . [45] [46] [47] [48] [49] Технические инструменты для обработки таких ситуаций включают теорию игр или современные инструменты, такие как теория игр среднего поля . [49] [50]
Возраст оказывает глубокое влияние на скорость распространения заболевания в популяции, особенно на скорость контакта. Эта скорость суммирует эффективность контактов между восприимчивыми и инфекционными субъектами. Принимая во внимание возраст эпидемических классов (чтобы ограничиться схемой восприимчивый-инфекционный-удаленный), так что:
(где - максимально допустимый возраст) и их динамика описывается не, как можно было бы подумать, «простыми» уравнениями в частных производных, а интегро-дифференциальными уравнениями :
где:
сила заражения, которая, конечно, будет зависеть, через контактное ядро, от взаимодействия между возрастами.
Сложность добавляют начальные условия для новорожденных (т.е. при a=0), которые для инфекционных просты и устраняются:
но которые нелокальны для плотности восприимчивых новорожденных:
где плодовитость взрослых особей.
Более того, определив теперь плотность всего населения, получаем:
В простейшем случае равной рождаемости в трех эпидемических классах мы имеем, что для достижения демографического равновесия должно выполняться следующее необходимое и достаточное условие, связывающее рождаемость со смертностью :
и демографическое равновесие
автоматически гарантируя существование решения, свободного от болезней:
Базовое число воспроизводства можно рассчитать как спектральный радиус соответствующего функционального оператора.
Один из способов расчета — усреднить ожидаемое число новых инфекций по всем возможным типам инфицированных. Метод следующего поколения — это общий метод вывода, когда задействовано более одного класса инфекционных агентов. Этот метод, первоначально предложенный Дикманном и др . (1990), [51] может использоваться для моделей с базовой возрастной структурой или пространственной структурой, среди прочих возможностей. [52] На этой картинке спектральный радиус матрицы следующего поколения дает базовое репродуктивное число, [53]
Рассмотрим заболевание, передающееся половым путем. В наивной популяции, где почти все восприимчивы, но семя инфекции, если ожидаемое число гендера 1 равно , а ожидаемое число инфицированных гендера 2 равно , мы можем узнать, сколько будет инфицировано в следующем поколении. Таким образом, матрицу следующего поколения можно записать как: [54] где каждый элемент является ожидаемым числом вторичных инфекций гендера, вызванных одним инфицированным индивидуумом гендера , предполагая, что популяция гендера полностью восприимчива. Диагональные элементы равны нулю, поскольку люди одного пола не могут передавать заболевание друг другу, но, например, каждый может передать заболевание в среднем . Это означает, что каждый элемент является репродуктивным числом, но таким, где учитывается, кто кого заражает. Если поколение представлено с помощью , то следующее поколение будет .
Спектральный радиус матрицы следующего поколения — это базовое репродуктивное число, , то есть здесь геометрическое среднее ожидаемого числа каждого пола в следующем поколении. Обратите внимание, что факторы умножения и чередуются, поскольку инфекционный человек должен «пройти» через второй пол, прежде чем он сможет войти в нового хозяина первого пола. Другими словами, требуется два поколения, чтобы вернуться к тому же типу, и каждые два поколения числа умножаются на × . Средний коэффициент умножения на поколение, таким образом, равен . Обратите внимание, что — это неотрицательная матрица, поэтому она имеет единственное, уникальное, положительное, действительное собственное значение, которое строго больше всех остальных.
В математическом моделировании инфекционных заболеваний динамика распространения обычно описывается с помощью набора нелинейных обыкновенных дифференциальных уравнений (ODE). Поэтому всегда существуют связанные уравнения вида , которые показывают, как число людей в отсеке изменяется с течением времени. Например, в модели SIR, , и . В отсековых моделях существует равновесие без заболеваний (DFE), что означает, что можно найти равновесие, установив число инфицированных людей равным нулю, . Другими словами, как правило, существует устойчивое состояние без инфекций . Это решение также обычно гарантирует, что равновесие без заболеваний также является равновесием системы. Существует еще одна фиксированная точка, известная как эндемическое равновесие (EE), в которой заболевание не полностью искоренено и остается в популяции. Математически это порог устойчивости равновесия без заболеваний, такой что:
Для вычисления первым шагом является линеаризация вокруг безрецидивного равновесия (DFE), но для инфицированной подсистемы нелинейных ОДУ, которые описывают производство новых инфекций и изменения состояния среди инфицированных людей. Эпидемиологически линеаризация отражает, что характеризует потенциал для начального распространения инфекционного человека в наивной популяции, предполагая, что изменение восприимчивой популяции незначительно во время начального распространения. [55] Линейная система ОДУ всегда может быть описана матрицей. Таким образом, следующим шагом является построение линейного положительного оператора, который обеспечивает следующее поколение инфицированных людей при применении к текущему поколению. Обратите внимание, что этот оператор (матрица) отвечает за количество инфицированных людей, а не за все отсеки. Итерация этого оператора описывает начальное прогрессирование инфекции в гетерогенной популяции. Таким образом, сравнение спектрального радиуса этого оператора с единицей определяет, растут ли поколения инфицированных людей или нет. может быть записана как произведение уровня инфицирования вблизи безрецидивного равновесия и средней продолжительности инфицированности. Он используется для определения пика и окончательного размера эпидемии.
Как описано в примере выше, очень много эпидемических процессов можно описать с помощью модели SIR. Однако для многих важных инфекций, таких как COVID-19 , существует значительный латентный период, в течение которого люди инфицированы, но сами еще не заразны. В течение этого периода человек находится в отсеке E (для подверженных воздействию). Здесь формирование матрицы следующего поколения из модели SEIR включает определение двух отсеков, инфицированных и неинфицированных, поскольку они являются популяциями, которые распространяют инфекцию. Поэтому нам нужно смоделировать только подвергшиеся воздействию, E , и инфицированные, I , отсеки. Рассмотрим популяцию, характеризующуюся уровнем смертности и рождаемости , где распространяется инфекционное заболевание. Как и в предыдущем примере, мы можем использовать скорости перехода между отсеками на душу населения, такие, что будут уровнем инфицирования, будут уровнем выздоровления и будут скоростью, с которой латентный человек становится заразным. Затем мы можем определить динамику модели, используя следующие уравнения: [52] [56]
Здесь у нас есть 4 отсека, и мы можем определить вектор , где обозначает количество или долю особей в -ом отсеке. Пусть будет скоростью появления новых инфекций в отсеке, такой, что она включает только инфекции, которые возникают вновь, но не включает термины, которые описывают передачу инфекционных особей из одного инфицированного отсека в другой. Тогда, если - скорость передачи особей в отсек всеми другими способами, а - скорость передачи особей из -ого отсека, то разность дает скорость изменения такой, что .
Теперь мы можем составить матрицы частных производных и такие, что
и , где - равновесие без заболеваний.
Теперь мы можем сформировать матрицу следующего поколения (оператор) . [57] [53] По сути, это неотрицательная матрица , которая представляет уровни инфицирования вблизи равновесия, и является М-матрицей для линейных переходных членов, создающих матрицу, которая представляет среднюю продолжительность инфицирования. Таким образом, дает скорость, с которой инфицированные особи в производят новые инфекции в , умноженную на среднюю продолжительность времени, которое особь проводит за один визит в отсек
Наконец, для этого процесса SEIR мы можем иметь:
и так далее
Базовое репродуктивное число можно оценить, изучив подробные цепочки передачи или с помощью геномного секвенирования . Однако чаще всего его рассчитывают с помощью эпидемиологических моделей. [58] Во время эпидемии обычно известно количество диагностированных инфекций с течением времени . На ранних стадиях эпидемии рост является экспоненциальным с логарифмической скоростью роста Для экспоненциального роста можно интерпретировать как совокупное количество диагнозов (включая выздоровевших лиц) или текущее количество случаев заражения; логарифмическая скорость роста одинакова для обоих определений. Для оценки необходимы предположения о временной задержке между заражением и постановкой диагноза и времени между заражением и началом заражения.
При экспоненциальном росте связано со временем удвоения как
Если особь, после заражения, заражает новых особей только по прошествии определенного времени (последовательного интервала), то число инфекционных особей с течением времени растет как или Базовое дифференциальное уравнение соответствия имеет вид или В этом случае или .
Например, при и мы найдем .
Если это зависит от времени, это показывает, что может быть важно поддерживать значение ниже 0, усредненное по времени, чтобы избежать экспоненциального роста.
В этой модели индивидуальная инфекция имеет следующие стадии:
Это модель SEIR, и ее можно записать в следующем виде [59] Этот метод оценки был применен к COVID-19 и SARS . Это следует из дифференциального уравнения для числа подвергшихся воздействию лиц и числа латентно инфицированных лиц , Наибольшее собственное значение матрицы — это логарифмическая скорость роста , которую можно решить относительно .
В особом случае эта модель приводит к , что отличается от простой модели выше ( ). Например, при тех же значениях и мы бы обнаружили , а не истинное значение . Разница обусловлена тонким различием в базовой модели роста; матричное уравнение выше предполагает, что недавно инфицированные пациенты в настоящее время уже способствуют инфекциям, в то время как на самом деле инфекции происходят только из-за числа инфицированных в назад. Более правильное лечение потребовало бы использования дифференциальных уравнений задержки . [60]
Латентный период — это время перехода между событием заражения и проявлением болезни. В случаях заболеваний с различными латентными периодами основное репродуктивное число можно рассчитать как сумму репродуктивных чисел для каждого времени перехода в болезнь. Примером этого является туберкулез (ТБ). Блоуэр и соавторы вычислили на основе простой модели туберкулеза следующее репродуктивное число: [61] В их модели предполагается, что инфицированные лица могут развить активный туберкулез либо путем прямого прогрессирования (болезнь развивается сразу после заражения), рассмотренного выше как БЫСТРЫЙ туберкулез, либо путем эндогенной реактивации (болезнь развивается через годы после заражения), рассмотренного выше как МЕДЛЕННЫЙ туберкулез. [62]
В случае некоторых заболеваний, таких как СПИД и гепатит В, возможно, что потомство инфицированных родителей родится инфицированным. Такая передача болезни от матери называется вертикальной передачей. Приток дополнительных членов в инфицированную категорию можно рассмотреть в рамках модели, включив часть новорожденных членов в инфицированный отсек. [63]
Болезни, передающиеся от человека к человеку косвенно, например, малярия, распространяемая комарами, передаются через переносчика. В этих случаях инфекция передается от человека к насекомому, и эпидемическая модель должна включать оба вида, что обычно требует гораздо большего количества компартментов, чем модель для прямой передачи. [63] [64]
Другие явления, которые, возможно, необходимо учитывать при моделировании эпидемии, включают в себя следующие: [63]
Представленные здесь детерминированные модели действительны только в случае достаточно больших популяций, и поэтому должны использоваться с осторожностью. [65] [66] Эти модели действительны только в термодинамическом пределе , где популяция фактически бесконечна. В стохастических моделях долгосрочное эндемическое равновесие, выведенное выше, не выполняется, поскольку существует конечная вероятность того, что число инфицированных особей в системе упадет ниже одного. В истинной системе патоген может не распространяться, поскольку ни один хозяин не будет инфицирован. Но в детерминированных моделях среднего поля число инфицированных может принимать реальные, а именно нецелые значения инфицированных хозяев, а число хозяев в модели может быть меньше одного, но больше нуля, тем самым позволяя патогену в модели распространяться. Надежность компартментальных моделей ограничена компартментальными приложениями.
Одно из возможных расширений моделей среднего поля рассматривает распространение эпидемий в сети на основе концепций теории перколяции . [37] Стохастические модели эпидемий изучались на различных сетях [67] [68] [69] и совсем недавно были применены к пандемии COVID-19 . [70]
4.1
2.1.3