Нейротрансмиссия (лат. transmissio «проход, пересечение» от transmissione «отправлять, пропускать») — это процесс, при котором сигнальные молекулы, называемые нейротрансмиттерами, высвобождаются аксональным окончанием нейрона ( пресинаптического нейрона ) и связываются с рецепторами на дендритах другого нейрона (постсинаптического нейрона) на небольшом расстоянии и реагируют с ними. Похожий процесс происходит при ретроградной нейротрансмиссии , когда дендриты постсинаптического нейрона высвобождают ретроградные нейротрансмиттеры (например, эндоканнабиноиды ; синтезируются в ответ на повышение внутриклеточного уровня кальция ), которые передают сигнал через рецепторы, расположенные на аксональном окончании пресинаптического нейрона, в основном в ГАМКергических и глутаматергических синапсах . [1] [2] [3] [4]
Нейротрансмиссия регулируется несколькими различными факторами: доступностью и скоростью синтеза нейротрансмиттера, высвобождением этого нейротрансмиттера, базовой активностью постсинаптической клетки, количеством доступных постсинаптических рецепторов, с которыми может связаться нейротрансмиттер, и последующим удалением или дезактивацией нейротрансмиттера ферментами или пресинаптическим обратным захватом. [5] [6]
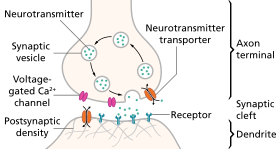
В ответ на пороговый потенциал действия или градуированный электрический потенциал нейротрансмиттер высвобождается в пресинаптическом окончании . Высвобожденный нейротрансмиттер может затем перемещаться через синапс, чтобы быть обнаруженным и связанным с рецепторами в постсинаптическом нейроне. Связывание нейротрансмиттеров может влиять на постсинаптический нейрон как ингибирующим, так и возбуждающим образом. Связывание нейротрансмиттеров с рецепторами в постсинаптическом нейроне может вызывать либо краткосрочные изменения, такие как изменения мембранного потенциала, называемые постсинаптическими потенциалами , либо долгосрочные изменения путем активации сигнальных каскадов .
Нейроны образуют сложные биологические нейронные сети, по которым движутся нервные импульсы (потенциалы действия). Нейроны не соприкасаются друг с другом (за исключением случая электрического синапса через щелевой контакт ); вместо этого нейроны взаимодействуют в точках близкого контакта, называемых синапсами. Нейрон переносит свою информацию посредством потенциала действия. Когда нервный импульс достигает синапса, он может вызвать высвобождение нейротрансмиттеров, которые влияют на другой (постсинаптический) нейрон. Постсинаптический нейрон может получать входные сигналы от многих дополнительных нейронов, как возбуждающих, так и тормозных. Возбуждающие и тормозные влияния суммируются, и если чистый эффект является тормозным, нейрон будет менее склонен «срабатывать» (т. е. генерировать потенциал действия), а если чистый эффект является возбуждающим, нейрон будет более склонен срабатывать. Насколько вероятно, что нейрон сработает, зависит от того, насколько далеко его мембранный потенциал от порогового потенциала , напряжения, при котором срабатывает потенциал действия, поскольку активируется достаточное количество зависящих от напряжения натриевых каналов , так что чистый входящий натриевый ток превышает все выходящие токи. [7] Возбуждающие входы приближают нейрон к порогу, в то время как тормозящие входы отдаляют нейрон от порога. Потенциал действия — это событие «все или ничего»; нейроны, мембраны которых не достигли порога, не будут срабатывать, в то время как те, которые достигли, должны сработать. Как только потенциал действия инициируется (традиционно в аксонном холмике ), он будет распространяться по аксону, что приведет к высвобождению нейротрансмиттеров в синаптической бутоне для передачи информации еще одному соседнему нейрону.
Нейротрансмиттеры спонтанно упаковываются в везикулы и высвобождаются в отдельных квантовых пакетах независимо от пресинаптических потенциалов действия. Это медленное высвобождение обнаруживается и производит микроингибиторные или микровозбуждающие эффекты на постсинаптический нейрон. Потенциал действия на короткое время усиливает этот процесс. Нейротрансмиттеры, содержащие везикулы, группируются вокруг активных участков и после высвобождения могут быть повторно использованы одним из трех предложенных механизмов. Первый предложенный механизм включает частичное открытие и повторное закрытие везикулы. Вторые два включают полное слияние везикулы с мембраной с последующей рециркуляцией или рециркуляцией в эндосому. Везикулярное слияние в значительной степени обусловлено концентрацией кальция в микродоменах, расположенных вблизи кальциевых каналов, что позволяет высвобождение нейротрансмиттера всего за микросекунды, в то время как возвращение к нормальной концентрации кальция занимает пару сотен микросекунд. Считается, что экзоцитоз везикул управляется белковым комплексом, называемым SNARE , который является мишенью для ботулинических токсинов . После высвобождения нейротрансмиттер попадает в синапс и сталкивается с рецепторами. Рецепторы нейротрансмиттеров могут быть ионотропными или связанными с g-белком. Ионотропные рецепторы позволяют ионам проходить через них, когда они агонизированы лигандом. Основная модель включает рецептор, состоящий из нескольких субъединиц, которые позволяют координировать предпочтение ионов. Рецепторы, связанные с G-белком, также называемые метаботропными рецепторами, при связывании с лигандом претерпевают конформационные изменения, приводящие к внутриклеточной реакции. Прекращение активности нейротрансмиттера обычно осуществляется транспортером, однако ферментативная дезактивация также возможна. [9]
Каждый нейрон соединяется с многочисленными другими нейронами, получая от них многочисленные импульсы. Суммирование — это сложение этих импульсов в аксонном холмике. Если нейрон получает только возбуждающие импульсы, он генерирует потенциал действия. Если вместо этого нейрон получает столько же тормозных, сколько и возбуждающих импульсов, торможение отменяет возбуждение, и нервный импульс на этом останавливается. [10] Генерация потенциала действия пропорциональна вероятности и схеме высвобождения нейротрансмиттера и сенсибилизации постсинаптического рецептора. [11] [12] [13]
Пространственная суммация означает, что эффекты импульсов, полученных в разных местах нейрона, складываются, так что нейрон может активироваться, когда такие импульсы получены одновременно, даже если каждый импульс сам по себе не может вызвать активацию.
Временная суммация означает, что эффекты импульсов, полученных в одном и том же месте, могут суммироваться, если импульсы получены в близкой временной последовательности. Таким образом, нейрон может активироваться при получении нескольких импульсов, даже если каждый импульс сам по себе не будет достаточным для активации. [14]
Нейротрансмиссия подразумевает как конвергенцию, так и дивергенцию информации. Сначала один нейрон подвергается влиянию многих других, что приводит к конвергенции входных данных. Когда нейрон активируется, сигнал посылается многим другим нейронам, что приводит к дивергенции выходных данных. Многие другие нейроны подвержены влиянию этого нейрона. [ необходима цитата ]
Котрансмиссия — это высвобождение нескольких типов нейромедиаторов из одного нервного окончания .
В нервном окончании нейротрансмиттеры находятся в везикулах, заключенных в мембрану, размером 35–50 нм, называемых синаптическими везикулами . Для высвобождения нейротрансмиттеров синаптические везикулы временно прикрепляются и сливаются с основанием специализированных липопротеиновых структур в форме чаши размером 10–15 нм на пресинаптической мембране, называемых поросомами . [15] Протеом нейрональной поросомы был решен, что позволило получить молекулярную архитектуру и полный состав механизма. [16]
Недавние исследования множества систем показали, что большинство нейронов, если не все, выделяют несколько различных химических посредников. [17] Котрансмиссия обеспечивает более сложные эффекты на постсинаптических рецепторах и, таким образом, позволяет осуществлять более сложную коммуникацию между нейронами.
В современной нейронауке нейроны часто классифицируются по их котрансмиттеру. Например, стриарные «ГАМКергические нейроны» используют опиоидные пептиды или вещество P в качестве своего основного котрансмиттера.
Некоторые нейроны могут высвобождать по крайней мере два нейротрансмиттера одновременно, другой из которых является котрансмиттером, чтобы обеспечить стабилизирующую отрицательную обратную связь, необходимую для осмысленного кодирования, при отсутствии ингибирующих интернейронов . [18] Вот некоторые примеры:
Норадреналин и АТФ являются симпатическими котрансмиттерами. Установлено, что эндоканнабиноид анадамид и каннабиноид WIN 55,212-2 могут изменять общую реакцию на симпатическую нервную стимуляцию и указывают на то, что пресинаптические рецепторы CB1 опосредуют симпато -ингибиторное действие. Таким образом, каннабиноиды могут ингибировать как норадренергические, так и пуринергические компоненты симпатической нейротрансмиссии. [19]
Одной из необычных пар котрансмиттеров являются ГАМК и глутамат, которые высвобождаются из одних и тех же аксонных окончаний нейронов, берущих начало в вентральной области покрышки (VTA), внутреннем бледном шаре и надсосцевидном ядре . [20] Первые два проецируются в поводок, тогда как проекции надсосцевидного ядра, как известно, нацелены на зубчатую извилину гиппокампа. [20]
Нейротрансмиссия генетически связана с другими характеристиками или особенностями. Например, анализ обогащения различных сигнальных путей привел к открытию генетической связи с внутричерепным объемом. [21]
Таким образом, можно предположить, что низкие уровни рецепторов CB1 расположены на глутаматергических и ГАМКергических терминалях, воздействующих на нейроны DA [127, 214], где они могут тонко настраивать высвобождение тормозного и возбуждающего нейротрансмиттера и регулировать активацию нейронов DA.
Электрофизиологические эксперименты in vitro, проведенные в независимых лабораториях, последовательно предоставили доказательства локализации рецептора CB1 на глутаматергических и ГАМКергических аксональных окончаниях в VTA и SNc.
Прямое взаимодействие CB1-HcrtR1 было впервые предложено в 2003 г. (Hilairet et al., 2003). Действительно, 100-кратное увеличение эффективности гипокретина-1 для активации сигнализации ERK наблюдалось при совместной экспрессии CB1 и HcrtR1 ... В этом исследовании сообщалось о более высокой эффективности гипокретина-1 для регуляции гетеромера CB1-HcrtR1 по сравнению с гомомером HcrtR1-HcrtR1 (Ward et al., 2011b). Эти данные обеспечивают однозначную идентификацию гетеромеризации CB1-HcrtR1, которая имеет существенное функциональное влияние. ... Существование перекрестных помех между гипокретинэргической и эндоканнабиноидной системами убедительно подтверждается их частично перекрывающимся анатомическим распределением и общей ролью в нескольких физиологических и патологических процессах. Однако мало что известно о механизмах, лежащих в основе этого взаимодействия. ... Действуя как ретроградный мессенджер, эндоканнабиноиды модулируют глутаматергические возбуждающие и ГАМКергические ингибирующие синаптические входы в дофаминергические нейроны VTA и глутаматную передачу в NAc. Таким образом, активация рецепторов CB1, присутствующих на аксональных окончаниях ГАМКергических нейронов в VTA, ингибирует передачу ГАМК, устраняя этот ингибирующий вход на дофаминергические нейроны (Riegel и Lupica, 2004). Глутаматная синаптическая передача в VTA и NAc, в основном от нейронов PFC, аналогичным образом модулируется активацией рецепторов CB1 (Melis и др., 2004).