
Фотохимия — раздел химии, изучающий химические эффекты света. Обычно этот термин используется для описания химической реакции, вызванной поглощением ультрафиолетового ( длина волны от 100 до 400 нм ), видимого (400–750 нм) или инфракрасного излучения (750–2500 нм). [1]
В природе фотохимия имеет огромное значение, поскольку она является основой фотосинтеза, зрения и образования витамина D под действием солнечного света. [2] Она также отвечает за появление мутаций ДНК, приводящих к раку кожи. [3]
Фотохимические реакции протекают иначе, чем реакции, управляемые температурой. Фотохимические пути обеспечивают доступ к высокоэнергетическим промежуточным продуктам, которые не могут быть получены термически, тем самым преодолевая большие активационные барьеры за короткий промежуток времени и позволяя реакциям, которые в противном случае были бы недоступны для термических процессов. Фотохимия также может быть разрушительной, как показано на примере фотодеградации пластика.
Фотовозбуждение — это первый шаг в фотохимическом процессе, где реагент переходит в состояние с более высокой энергией, возбужденное состояние . Первый закон фотохимии, известный как закон Гротгуса-Дрейпера (в честь химиков Теодора Гротгуса и Джона В. Дрейпера ), гласит, что свет должен быть поглощен химическим веществом для того, чтобы произошла фотохимическая реакция . Согласно второму закону фотохимии, известному как закон Штарка-Эйнштейна (в честь физиков Иоганнеса Штарка и Альберта Эйнштейна ), для каждого фотона света, поглощенного химической системой, не более одной молекулы активируется для фотохимической реакции, что определяется квантовым выходом . [4] [5]
Когда молекула или атом в основном состоянии (S 0 ) поглощает свет, один электрон возбуждается на более высокий орбитальный уровень. Этот электрон сохраняет свой спин в соответствии с правилом отбора по спину; другие переходы нарушили бы закон сохранения углового момента . Возбуждение в более высокое синглетное состояние может быть от HOMO к LUMO или к более высокой орбитали, так что возможны синглетные возбужденные состояния S 1 , S 2 , S 3 ... при различных энергиях.
Правило Каши гласит, что более высокие синглетные состояния быстро релаксируют посредством безызлучательного распада или внутреннего преобразования (IC) в S 1 . Таким образом, S 1 обычно, но не всегда, является единственным соответствующим синглетным возбужденным состоянием. Это возбужденное состояние S 1 может далее релаксировать до S 0 посредством IC, но также посредством разрешенного радиационного перехода из S 1 в S 0 , который испускает фотон; этот процесс называется флуоресценцией .
Альтернативно, возможно, что возбужденное состояние S 1 претерпит инверсию спина и сгенерирует триплетное возбужденное состояние T 1 , имеющее два неспаренных электрона с одинаковым спином. Это нарушение правила отбора спина возможно посредством интеркомбинационного пересечения (ISC) колебательных и электронных уровней S 1 и T 1 . Согласно правилу максимальной множественности Хунда , это состояние T 1 будет несколько более стабильным, чем S 1 .
Это триплетное состояние может релаксировать в основное состояние S 0 посредством безызлучательного ISC или посредством пути излучения, называемого фосфоресценцией . Этот процесс подразумевает изменение электронного спина, что запрещено правилами отбора спина, делая фосфоресценцию (от T 1 до S 0 ) намного медленнее, чем флуоресценцию (от S 1 до S 0 ). Таким образом, триплетные состояния обычно имеют более длительное время жизни, чем синглетные состояния. Эти переходы обычно суммируются в диаграмме энергии состояний или диаграмме Яблонского , парадигме молекулярной фотохимии.
Эти возбужденные виды, либо S 1 , либо T 1 , имеют полупустую низкоэнергетическую орбиталь и, следовательно, более окислительные, чем основное состояние. Но в то же время, они имеют электрон на высокоэнергетической орбитали и, таким образом, более восстановительные . В целом, возбужденные виды склонны участвовать в процессах переноса электронов. [6]

Фотохимические реакции требуют источника света, который излучает длины волн, соответствующие электронному переходу в реагенте. В ранних экспериментах (и в повседневной жизни) источником света был солнечный свет, хотя он и полихроматичен. [7] Ртутные лампы более распространены в лаборатории. Ртутные лампы низкого давления в основном излучают на длине волны 254 нм. Для полихроматических источников диапазоны длин волн можно выбирать с помощью фильтров. В качестве альтернативы лазерные лучи обычно монохромны (хотя с помощью нелинейной оптики можно получить две или более длины волны ), а светодиоды имеют относительно узкую полосу , которую можно эффективно использовать, как и лампы Rayonet, для получения приблизительно монохроматических лучей.

Излучаемый свет должен достигать целевой функциональной группы, не блокируясь реактором, средой или другими присутствующими функциональными группами . Во многих случаях для реакторов, а также для удержания лампы используется кварц . Пирекс поглощает на длинах волн короче 275 нм. Растворитель является важным экспериментальным параметром. Растворители являются потенциальными реагентами, и по этой причине хлорированные растворители избегаются, поскольку связь C–Cl может привести к хлорированию субстрата. Сильно поглощающие растворители не позволяют фотонам достичь субстрата. Углеводородные растворители поглощают только на коротких длинах волн и поэтому предпочтительны для фотохимических экспериментов, требующих высокоэнергетических фотонов. Растворители, содержащие ненасыщенность, поглощают на более длинных волнах и могут эффективно отфильтровывать короткие волны. Например, циклогексан и ацетон «отрезают» (сильно поглощают) на длинах волн короче 215 и 330 нм соответственно.
Обычно длина волны, используемая для индуцирования фотохимического процесса, выбирается на основе спектра поглощения реагирующих видов, чаще всего максимума поглощения. Однако в последние годы [ когда? ] было показано, что в большинстве реакций образования связей спектр поглощения не позволяет выбрать оптимальную длину волны для достижения наивысшего выхода реакции на основе поглощательной способности. Это фундаментальное несоответствие между поглощательной способностью и реакционной способностью было объяснено с помощью так называемых графиков фотохимического действия . [8] [9]
Непрерывно-поточная фотохимия предлагает множество преимуществ по сравнению с периодической фотохимией. Фотохимические реакции управляются количеством фотонов, которые способны активировать молекулы, вызывая желаемую реакцию. Большое отношение площади поверхности к объему микрореактора максимизирует освещение и в то же время обеспечивает эффективное охлаждение, что снижает тепловые побочные продукты. [10]
В случае фотохимических реакций свет обеспечивает энергию активации . Проще говоря, свет является одним из механизмов обеспечения энергии активации, необходимой для многих реакций. Если используется лазерный свет, можно выборочно возбуждать молекулу, чтобы создать желаемое электронное и колебательное состояние. [11] Аналогично, излучение из определенного состояния может выборочно контролироваться, обеспечивая измерение популяции этого состояния. Если химическая система находится под низким давлением, это позволяет ученым наблюдать распределение энергии продуктов химической реакции до того, как различия в энергии будут размыты и усреднены повторными столкновениями.
Поглощение фотона молекулой реагента может также позволить реакции произойти не только за счет приведения молекулы к необходимой энергии активации, но и за счет изменения симметрии электронной конфигурации молекулы, что делает возможным иным образом недоступный путь реакции, как описано в правилах отбора Вудворда-Хоффмана . Реакция циклоприсоединения [2+2] является одним из примеров перициклической реакции , которую можно проанализировать с использованием этих правил или связанной с ними пограничной теории молекулярных орбиталей .
Некоторые фотохимические реакции протекают на несколько порядков быстрее термических реакций; часто наблюдаются реакции со скоростью 10−9 секунд и сопутствующие процессы со скоростью 10−15 секунд .
Фотон может быть поглощен непосредственно реагентом или фотосенсибилизатором , который поглощает фотон и передает энергию реагенту. Противоположный процесс, когда фотовозбужденное состояние дезактивируется химическим реагентом, называется тушением .
Большинство фотохимических превращений происходят через ряд простых шагов, известных как первичные фотохимические процессы. Одним из распространенных примеров таких процессов является перенос протона в возбужденном состоянии.
Примерами фотохимических органических реакций являются электроциклические реакции , радикальные реакции , фотоизомеризация и реакции Норриша . [20] [21]
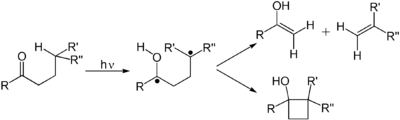
Алкены подвергаются многим важным реакциям, которые протекают через индуцированный фотоном переход π в π*. Первое электронно-возбужденное состояние алкена не имеет π-связи , поэтому вращение вокруг связи C–C происходит быстро, и молекула участвует в реакциях, не наблюдаемых термически. Эти реакции включают цис-транс-изомеризацию и циклоприсоединение к другому (основному состоянию) алкену с образованием производных циклобутана . Цис-транс-изомеризация (поли)алкена участвует в ретинале , компоненте зрительного аппарата . Димеризация алкенов имеет отношение к фотоповреждению ДНК , где димеры тимина наблюдаются при освещении ДНК УФ-излучением. Такие димеры мешают транскрипции . Благотворное влияние солнечного света связано с фотохимически индуцированной реакцией ретроциклизации (дециклизации) эргостерола с образованием витамина D. В реакции ДеМайо алкен реагирует с 1,3-дикетоном, реагирует через свой енол , давая 1,5-дикетон. Еще одна распространенная фотохимическая реакция — это ди-π-метановая перегруппировка Говарда Циммермана .
В промышленном применении ежегодно получают около 100 000 тонн бензилхлорида путем газофазной фотохимической реакции толуола с хлором . [22] Свет поглощается молекулами хлора, низкая энергия этого перехода указывается желтоватым цветом газа. Фотон вызывает гомолиз связи Cl-Cl, и образующийся радикал хлора преобразует толуол в радикал бензила:
Меркаптаны могут быть получены путем фотохимического присоединения сероводорода ( H2S ) к альфа- олефинам .
Координационные комплексы и металлоорганические соединения также фотореактивны. Эти реакции могут включать цис-транс-изомеризацию. Чаще всего фотореакции приводят к диссоциации лигандов, поскольку фотон возбуждает электрон на металле на орбиталь, которая является антисвязывающей по отношению к лигандам. Таким образом, карбонилы металлов , которые устойчивы к термическому замещению, подвергаются декарбонилированию при облучении УФ-светом. УФ-облучение раствора гексакарбонила молибдена в ТГФ дает комплекс ТГФ, который полезен в синтетических целях:
В родственной реакции фотолиз пентакарбонила железа дает нонакарбонил дижелеза (см. рисунок):
Отдельные фотореактивные координационные комплексы могут подвергаться окислительно-восстановительным процессам посредством одноэлектронного переноса. Этот перенос электронов может происходить во внутренней или внешней координационной сфере металла. [23]
Вот несколько различных типов фотохимических реакций:
Хотя отбеливание практикуется уже давно, первая фотохимическая реакция была описана Троммсдорфом в 1834 году. [24] Он наблюдал, что кристаллы соединения α-сантонина под воздействием солнечного света желтели и лопались. В исследовании 2007 года реакция была описана как последовательность из трех этапов, происходящих в пределах одного кристалла. [25]
Первый шаг — это реакция перегруппировки в промежуточный циклопентадиенон ( 2 ), второй — димеризация в реакции Дильса-Альдера ( 3 ), а третий — внутримолекулярное [2+2] циклоприсоединение ( 4 ). Эффект разрыва объясняется большим изменением объема кристалла при димеризации.
Организацию этих конференций поддерживает Международный фонд фотохимии. [26]