Никель -кадмиевая батарея ( батарея Ni–Cd или батарея NiCad ) — это тип перезаряжаемой батареи, использующей гидроксид никеля и металлический кадмий в качестве электродов. Аббревиатура Ni–Cd происходит от химических символов никеля ( Ni ) и кадмия ( Cd ) : аббревиатура NiCad является зарегистрированной торговой маркой SAFT Corporation , хотя эта торговая марка обычно используется для описания всех Ni–Cd батарей.
Никель-кадмиевые батареи с жидким электролитом были изобретены в 1899 году. Напряжение на клеммах никель-кадмиевой батареи во время разряда составляет около 1,2 В, которое немного уменьшается почти до конца разряда. Максимальная электродвижущая сила , предлагаемая никель-кадмиевой батареей, составляет 1,3 В. Никель-кадмиевые батареи производятся в широком диапазоне размеров и емкостей, от портативных герметичных типов, взаимозаменяемых с угольно-цинковыми сухими элементами, до больших вентилируемых ячеек, используемых для резервного питания и движущей силы. По сравнению с другими типами перезаряжаемых ячеек они предлагают хороший срок службы и производительность при низких температурах с приемлемой емкостью, но их существенным преимуществом является способность обеспечивать практически полную номинальную емкость при высоких скоростях разряда (разрядка за один час или меньше). Однако материалы более дорогие, чем у свинцово -кислотной батареи , и ячейки имеют высокие скорости саморазряда.
Герметичные Ni–Cd элементы в свое время широко использовались в портативных электроинструментах, фотооборудовании, фонариках , аварийном освещении, любительских радиоуправляемых устройствах и портативных электронных устройствах. Превосходная емкость никель-металлгидридных батарей и недавняя более низкая стоимость в значительной степени вытеснили использование Ni–Cd. Кроме того, воздействие на окружающую среду утилизации токсичного металлического кадмия значительно способствовало сокращению их использования. В пределах Европейского Союза Ni–Cd батареи теперь могут поставляться только для замены или для определенных типов нового оборудования, такого как медицинские приборы. [2]
Более крупные вентилируемые Ni–Cd батареи с жидким электролитом используются в аварийном освещении, резервном питании, источниках бесперебойного питания и других приложениях.
Первая Ni-Cd батарея была создана Вальдемаром Юнгнером из Швеции в 1899 году. В то время единственным прямым конкурентом была свинцово-кислотная батарея , которая была менее физически и химически прочной. С небольшими улучшениями первых прототипов плотность энергии быстро увеличилась примерно до половины от первичных батарей и значительно больше, чем у свинцово-кислотных батарей. Юнгнер экспериментировал с заменой кадмия железом в различных количествах, но обнаружил, что формулы железа недостаточны. Работа Юнгнера была в значительной степени неизвестна в Соединенных Штатах. Томас Эдисон запатентовал никель- или кобальт-кадмиевую батарею в 1902 году [3] и адаптировал конструкцию батареи, когда он представил никель-железную батарею в США через два года после того, как Юнгнер ее построил. В 1906 году Юнгнер основал завод недалеко от Оскарсхамна, Швеция, для производства затопленных Ni-Cd батарей.
В 1932 году активные материалы были помещены внутрь пористого никелированного электрода, а пятнадцать лет спустя началась работа над герметичной никель-кадмиевой батареей.
Первое производство в Соединенных Штатах началось в 1946 году. До этого момента батареи были «карманного типа», изготовленные из никелированных стальных карманов, содержащих никель и кадмиевые активные материалы. Примерно в середине двадцатого века спеченные пластинчатые никель-кадмиевые батареи стали все более популярными. Сплавление никелевого порошка при температуре значительно ниже его точки плавления с использованием высокого давления создает спеченные пластины. Образованные таким образом пластины являются высокопористыми, около 80 процентов по объему. Положительные и отрицательные пластины производятся путем замачивания никелевых пластин в никель- и кадмиево-активных материалах соответственно. Спеченные пластины обычно намного тоньше, чем карманного типа, что приводит к большей площади поверхности на единицу объема и более высоким токам. В общем, чем больше площадь поверхности реактивного материала в батарее, тем ниже ее внутреннее сопротивление .
Начиная с 2000-х годов, все потребительские Ni–Cd аккумуляторы используют конфигурацию «желе-рулон» . [ требуется ссылка ]
Максимальная скорость разряда для Ni–Cd батареи зависит от размера. Для обычной ячейки размера AA максимальная скорость разряда составляет приблизительно 1,8 ампера; для батареи размера D скорость разряда может достигать 3,5 ампер. [ необходима цитата ]
Производители моделей самолетов и лодок часто берут гораздо большие токи до сотни ампер или около того от специально сконструированных Ni–Cd аккумуляторов, которые используются для привода главных двигателей. 5–6 минут работы модели легко достижимы от довольно маленьких аккумуляторов, поэтому достигается достаточно высокий показатель мощности на единицу веса, сравнимый с двигателями внутреннего сгорания , хотя и с меньшей продолжительностью. Однако в этом отношении они были в значительной степени вытеснены литий-полимерными (LiPo) и литий-железо-фосфатными (LiFe) аккумуляторами, которые могут обеспечивать еще более высокую плотность энергии.
Ni–Cd элементы имеют номинальный потенциал элемента 1,2 вольта (В). Это ниже, чем 1,5 В щелочных и цинково-угольных первичных элементов, и, следовательно, они не подходят в качестве замены во всех приложениях. Однако 1,5 В первичного щелочного элемента относится к его начальному, а не среднему напряжению. В отличие от щелочных и цинково-угольных первичных элементов, напряжение на клеммах Ni–Cd элемента изменяется лишь немного по мере разряда. Поскольку многие электронные устройства предназначены для работы с первичными элементами, которые могут разряжаться до 0,90–1,0 В на элемент, относительно стабильного напряжения 1,2 В Ni–Cd элемента достаточно для работы. Некоторые посчитают почти постоянное напряжение недостатком, поскольку оно затрудняет определение низкого заряда батареи.
Ni–Cd батареи, используемые для замены 9 В батарей, обычно имеют только шесть ячеек для конечного напряжения 7,2 В. Хотя большинство карманных радиоприемников будут удовлетворительно работать при этом напряжении, некоторые производители, такие как Varta, выпускают 8,4-вольтовые батареи с семью ячейками для более критических применений.
Ni–Cd аккумуляторы можно заряжать с разными скоростями, в зависимости от способа изготовления элемента. Скорость заряда измеряется на основе процента емкости в ампер-часах , который батарея получает в качестве постоянного тока в течение всего заряда. Независимо от скорости заряда, в аккумулятор должно подаваться больше энергии, чем его фактическая емкость, чтобы учесть потери энергии во время зарядки, причем более быстрая зарядка более эффективна. Например, «ночная» зарядка может заключаться в подаче тока, равного одной десятой номинала в ампер-часах (C/10) в течение 14–16 часов; то есть аккумулятор емкостью 100 мАч потребляет 10 мА в течение 14 часов, что в общей сложности составляет 140 мАч для зарядки с такой скоростью. При скорости быстрой зарядки, выполняемой при 100% номинальной емкости аккумулятора за 1 час (1C), аккумулятор удерживает примерно 80% заряда, поэтому аккумулятор емкостью 100 мАч заряжается за 125 мАч (то есть примерно за 1 час и 15 минут). Некоторые специализированные батареи можно зарядить всего за 10–15 минут при скорости заряда 4C или 6C, но это встречается очень редко. Это также значительно увеличивает риск перегрева и вентилирования ячеек из-за внутреннего избыточного давления: скорость повышения температуры ячейки регулируется ее внутренним сопротивлением и квадратом скорости заряда. При скорости 4C количество тепла, выделяемого в ячейке, в шестнадцать раз выше, чем при скорости 1C. Недостатком более быстрой зарядки является более высокий риск перезаряда , что может повредить батарею, и повышенные температуры, которые должна выдерживать ячейка (что потенциально сокращает ее срок службы).
Безопасный диапазон температур при использовании составляет от −20 °C до 45 °C. Во время зарядки температура аккумулятора обычно остается низкой, примерно такой же, как температура окружающей среды (реакция зарядки поглощает энергию), но по мере приближения аккумулятора к полной зарядке температура повышается до 45–50 °C. Некоторые зарядные устройства для аккумуляторов обнаруживают это повышение температуры, чтобы отключить зарядку и предотвратить перезарядку.
Если аккумулятор Ni–Cd не находится под нагрузкой или зарядкой, он будет саморазряжаться примерно на 10% в месяц при 20 °C, достигая 20% в месяц при более высоких температурах. Примечание: в 2022 году предыдущее предложение, безусловно, было верным, когда был представлен NiCad, и даже 50 лет назад. Однако постоянные улучшения, наблюдавшиеся около 40 лет назад, привели к 5% в месяц, и сегодня аккумуляторы NiCad имеют существенно более низкий саморазряд, порядка 1% или 2% в месяц. Можно выполнять непрерывную зарядку при уровнях тока, достаточно высоких, чтобы компенсировать эту скорость разрядки; чтобы поддерживать аккумулятор полностью заряженным. Однако, если аккумулятор будет храниться без использования в течение длительного периода времени, его следует разрядить максимум до 40% емкости (некоторые производители рекомендуют полностью разрядить и даже закоротить после полной разрядки [ требуется ссылка ] ), и хранить в прохладном, сухом месте.
Герметичные Ni–Cd элементы состоят из сосуда под давлением, который должен содержать любое образование газов кислорода и водорода до тех пор, пока они не смогут рекомбинировать обратно в воду. Такое образование обычно происходит во время быстрой зарядки и разрядки, и чрезвычайно в условиях перезарядки. Если давление превышает предел предохранительного клапана, вода в виде газа теряется. Поскольку сосуд предназначен для содержания точного количества электролита, эта потеря быстро повлияет на емкость элемента и его способность принимать и отдавать ток. Для обнаружения всех состояний перезарядки требуется большая сложность от схемы зарядки, и дешевое зарядное устройство в конечном итоге повредит даже самые качественные элементы. [4]
Полностью заряженный Ni–Cd элемент содержит:
Ni–Cd аккумуляторы обычно имеют металлический корпус с уплотнительной пластиной, оснащенной самоуплотняющимся предохранительным клапаном . Положительные и отрицательные электродные пластины, изолированные друг от друга сепаратором, свернуты в спиральную форму внутри корпуса. Это известно как конструкция «желейный рулон» и позволяет Ni–Cd элементу выдавать гораздо более высокий максимальный ток, чем эквивалентный по размеру щелочной элемент. Щелочные элементы имеют конструкцию бобины, в которой корпус элемента заполнен электролитом и содержит графитовый стержень, который действует как положительный электрод. Поскольку относительно небольшая площадь электрода находится в контакте с электролитом (в отличие от конструкции «желейный рулон»), внутреннее сопротивление для эквивалентного по размеру щелочного элемента выше, что ограничивает максимальный ток, который может быть выдан.
Химические реакции на кадмиевом электроде во время разряда следующие:
Реакции на электроде из оксида никеля следующие:
Чистая реакция во время разряда составляет
Во время перезарядки реакции идут справа налево. Щелочной электролит (обычно KOH) в этой реакции не расходуется, и поэтому его удельный вес , в отличие от свинцово-кислотных аккумуляторов, не является показателем его состояния заряда.
Когда Юнгнер построил первые Ni–Cd батареи, он использовал оксид никеля в положительном электроде, а железо и кадмиевые материалы в отрицательном. Только позже стали использоваться чистый металлический кадмий и гидроксид никеля . Примерно до 1960 года химическая реакция не была полностью понята. Было несколько предположений относительно продуктов реакции. Спор был окончательно разрешен инфракрасной спектроскопией , которая выявила гидроксид кадмия и гидроксид никеля.
Еще одним исторически важным изменением базовой ячейки Ni–Cd является добавление гидроксида лития к электролиту гидроксида калия. Считалось [ кем? ] , что это продлит срок службы, сделав ячейку более устойчивой к электрическому воздействию. Ni–Cd батарея в ее современной форме в любом случае чрезвычайно устойчива к электрическому воздействию, поэтому эта практика была прекращена.

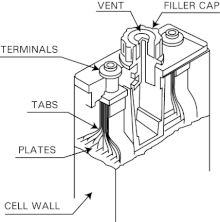
Более крупные затопленные элементы используются в пусковых батареях самолетов , в качестве резервного источника питания и в небольших количествах в электромобилях .
Вентилируемые ( влажные , затопленные ) Ni–Cd батареи используются, когда требуются большие емкости и высокие скорости разряда. В отличие от типичных Ni–Cd ячеек, которые герметичны (см. следующий раздел), вентилируемые ячейки имеют вентиляционный клапан или клапан сброса низкого давления , который выпускает любые образующиеся кислородные и водородные газы при перезарядке или быстрой разрядке. Поскольку батарея не является сосудом под давлением , она безопаснее, весит меньше и имеет более простую и экономичную конструкцию. Это также означает, что батарея обычно не повреждается чрезмерными скоростями перезарядки, разрядки или даже отрицательного заряда.
Они используются в авиации, железнодорожном и общественном транспорте, резервном питании для телекоммуникаций, запуске двигателей для резервных турбин и т. д. Использование вентилируемых Ni–Cd батарей приводит к уменьшению размера, веса и требований к обслуживанию по сравнению с другими типами батарей. Вентилируемые Ni–Cd батареи имеют длительный срок службы (до 20 лет и более, в зависимости от типа) и работают при экстремальных температурах (от −40 до 70 °C).
Стальной корпус аккумулятора содержит ячейки, соединенные последовательно для получения желаемого напряжения (1,2 В на ячейку номиналом). Ячейки обычно изготавливаются из легкого и прочного полиамида ( нейлона ) с несколькими никель-кадмиевыми пластинами, сваренными вместе для каждого электрода внутри. Сепаратор или вкладыш из силиконовой резины действует как изолятор и газовый барьер между электродами. Ячейки залиты электролитом из 30% водного раствора гидроксида калия ( KOH ). Удельный вес электролита не указывает, разряжена ли батарея или полностью заряжена, но изменяется в основном с испарением воды. Верхняя часть ячейки содержит пространство для избытка электролита и выпускное отверстие для сброса давления. Большие никелированные медные шпильки и толстые соединительные звенья обеспечивают минимальное эквивалентное последовательное сопротивление для батареи.
Выпуск газов означает, что аккумулятор либо разряжается с высокой скоростью, либо заряжается с более высокой скоростью, чем номинальная. Это также означает, что электролит, потерянный во время выпуска воздуха, должен периодически заменяться в ходе планового обслуживания. В зависимости от циклов заряда-разряда и типа аккумулятора это может означать период обслуживания от нескольких месяцев до года.
Напряжение вентилируемых ячеек быстро возрастает в конце заряда, что позволяет использовать очень простую схему зарядного устройства. Обычно аккумулятор заряжается постоянным током со скоростью 1 CA, пока все ячейки не достигнут по крайней мере 1,55 В. Затем следует еще один цикл зарядки со скоростью 0,1 CA, снова пока все ячейки не достигнут 1,55 В. Зарядка завершается выравнивающим или дозарядным зарядом, обычно в течение не менее 4 часов со скоростью 0,1 CA. Целью перезаряда является удаление как можно большего количества (если не всех) газов, собранных на электродах, водорода на отрицательном и кислорода на положительном, и некоторые из этих газов рекомбинируют, образуя воду, которая, в свою очередь, поднимет уровень электролита до самого высокого уровня, после чего можно безопасно регулировать уровни электролита. Во время перезаряда или дозаряда напряжение ячеек превысит 1,6 В, а затем начнет медленно падать. Ни одна ячейка не должна подниматься выше 1,71 В (сухая ячейка) или опускаться ниже 1,55 В (нарушен газовый барьер). [ необходима ссылка ]
В установке самолета с плавающей аккумуляторной электрической системой напряжение регулятора установлено для зарядки аккумулятора при постоянном потенциале заряда (обычно 14 или 28 В). Если это напряжение установлено слишком высоким, это приведет к быстрой потере электролита. Неисправный регулятор заряда может позволить напряжению заряда подняться значительно выше этого значения, вызывая массивный перезаряд с выкипанием электролита. [ необходима цитата ]

Большинство описанных ниже вариантов использования показаны в исторических целях, поскольку герметичные (портативные) никель-кадмиевые аккумуляторы постепенно вытесняются более производительными литий-ионными элементами, а их размещение на рынке ЕС по большей части запрещено с 2006 года Директивой ЕС о батареях 2006/66/EC.
Герметичные Ni–Cd элементы использовались по отдельности или собирались в аккумуляторные батареи, содержащие две или более ячеек. Маленькие элементы используются для портативной электроники и игрушек (например, солнечных садовых фонарей), часто с использованием ячеек, изготовленных в тех же размерах, что и первичные элементы . Когда Ni–Cd элементы заменяются первичными элементами, более низкое напряжение на клеммах и меньшая емкость в ампер-часах могут снизить производительность по сравнению с первичными элементами. Миниатюрные таблеточные элементы иногда используются в фотооборудовании, ручных лампах (фонариках или факелах), резервных компьютерных запоминающих устройствах, игрушках и новинках.
Специальные Ni–Cd батареи использовались в беспроводных и беспроводных телефонах, аварийном освещении и других приложениях. Имея относительно низкое внутреннее сопротивление , они могут обеспечивать высокие импульсные токи . Это делает их предпочтительным выбором для дистанционно управляемых электрических моделей самолетов, лодок и автомобилей, а также беспроводных электроинструментов и вспышек камер.
Достижения в области технологий производства батарей во второй половине двадцатого века сделали производство батарей все более дешевым. Устройства на батарейном питании в целом стали более популярными. По состоянию на 2000 год ежегодно производилось около 1,5 миллиарда Ni–Cd батарей. [5] До середины 1990-х годов Ni–Cd батареи занимали подавляющее большинство доли рынка перезаряжаемых батарей в бытовой электронике.
В какой-то момент на никель-кадмиевые батареи приходилось 8% всех продаж портативных вторичных (перезаряжаемых) батарей в ЕС, в Великобритании — 9,2% (утилизация), а в Швейцарии — 1,3% всех продаж портативных батарей. [6] [7] [8]
В ЕС Директива о батареях 2006 года ограничила продажу никель-кадмиевых батарей потребителям для портативных устройств.
Элементы Ni–Cd доступны в тех же размерах, что и щелочные батареи , от AAA до D, а также в нескольких размерах с несколькими ячейками, включая эквивалент 9-вольтовой батареи. Полностью заряженная одна ячейка Ni–Cd без нагрузки имеет разность потенциалов от 1,25 до 1,35 вольт, которая остается относительно постоянной по мере разрядки батареи. Поскольку напряжение щелочной батареи, почти полностью разряженной, может упасть до 0,9 вольт, элементы Ni–Cd и щелочные элементы, как правило, взаимозаменяемы для большинства применений.
Помимо отдельных ячеек существуют батареи, содержащие до 300 ячеек (номинально 360 вольт, фактическое напряжение без нагрузки от 380 до 420 вольт). Такая многоэлементная конструкция в основном используется в автомобильной и тяжелой промышленной технике. Для портативных приложений количество ячеек обычно составляет менее 18 ячеек (24 В). Промышленные залитые батареи доступны с емкостью от 12,5 Ач до нескольких сотен Ач.
Недавно никель-металлгидридные и литий-ионные аккумуляторы стали коммерчески доступными и более дешевыми, первый тип теперь соперничает по стоимости с никель-кадмиевыми аккумуляторами. Там, где важна плотность энергии, никель-кадмиевые аккумуляторы теперь находятся в невыгодном положении по сравнению с никель-металлгидридными и литий-ионными аккумуляторами. Однако никель-кадмиевый аккумулятор по-прежнему очень полезен в приложениях, требующих очень высоких скоростей разряда, поскольку он может выдерживать такой разряд без повреждений или потери емкости.
По сравнению с другими типами аккумуляторных батарей никель-кадмиевые батареи имеют ряд явных преимуществ:
Основным недостатком Ni–Cd аккумуляторов является их более высокая стоимость и использование кадмия. Этот тяжелый металл представляет опасность для окружающей среды и является высокотоксичным для всех высших форм жизни. Они также более дороги, чем свинцово-кислотные аккумуляторы, поскольку никель и кадмий стоят дороже. Одним из самых больших недостатков является то, что аккумулятор демонстрирует очень выраженный отрицательный температурный коэффициент. Это означает, что при повышении температуры элемента внутреннее сопротивление падает. Это может вызвать значительные проблемы с зарядкой, особенно с относительно простыми системами зарядки, используемыми для свинцово-кислотных аккумуляторов. В то время как свинцово-кислотные аккумуляторы можно заряжать, просто подключив к ним динамо-машину с простой системой электромагнитного отключения, когда динамо-машина неподвижна или происходит перегрузка по току, Ni–Cd аккумулятор при аналогичной схеме зарядки будет демонстрировать тепловой разгон, при котором зарядный ток будет продолжать расти до тех пор, пока не сработает предохранитель от перегрузки по току или аккумулятор не разрушится. Это главный фактор, который препятствует его использованию в качестве аккумуляторов для запуска двигателя. Сегодня, при наличии систем зарядки на основе генератора переменного тока с твердотельными регуляторами, создание подходящей системы зарядки было бы относительно простым, но производители автомобилей не хотят отказываться от проверенной технологии. [9]
Ni–Cd аккумуляторы могут страдать от « эффекта памяти », если они разряжаются и перезаряжаются до одного и того же состояния заряда сотни раз. Очевидным симптомом является то, что аккумулятор «запоминает» точку в своем цикле разрядки, где началась перезарядка, и при последующем использовании испытывает внезапное падение напряжения в этой точке, как если бы аккумулятор был разряжен. Емкость аккумулятора на самом деле существенно не уменьшается. Некоторые электронные устройства, предназначенные для питания от Ni–Cd аккумуляторов, способны выдерживать это пониженное напряжение достаточно долго, чтобы напряжение вернулось к норме. Однако, если устройство не может работать в течение этого периода пониженного напряжения, оно не сможет получить достаточно энергии от аккумулятора, и для всех практических целей аккумулятор кажется «мертвым» раньше, чем обычно.
Есть доказательства того, что история эффекта памяти возникла из орбитальных спутников, где они аналогичным образом заряжались и разряжались с каждым оборотом вокруг Земли в течение нескольких лет. [10] По прошествии этого времени было обнаружено, что емкость батарей значительно снизилась, но они все еще были пригодны для использования. Маловероятно, что эта точная повторяющаяся зарядка (например, 1000 зарядов/разрядов с изменчивостью менее 2%) когда-либо могла быть воспроизведена людьми, использующими электротовары. Первоначальная статья, описывающая эффект памяти, была написана учеными GE в их отделе аккумуляторного бизнеса в Гейнсвилле, Флорида, и позже отозвана ими, но ущерб был нанесен. [11]
Аккумулятор выдерживает тысячи циклов заряда/разряда. Также можно снизить эффект памяти, полностью разряжая аккумулятор примерно раз в месяц. [ необходима цитата ] Таким образом, аккумулятор, по-видимому, не «запоминает» точку в своем цикле заряда.
Эффект с похожими симптомами на эффект памяти — так называемое падение напряжения или эффект ленивой батареи . Это происходит из-за многократной перезарядки; симптом заключается в том, что батарея кажется полностью заряженной, но быстро разряжается уже после короткого периода работы. В редких случаях большую часть потерянной емкости можно восстановить несколькими циклами глубокой разрядки, функция, часто предоставляемая автоматическими зарядными устройствами. Однако этот процесс может сократить срок годности батареи. [ необходима цитата ] При правильном обращении никель-кадмиевая батарея может прослужить 1000 циклов или более, прежде чем ее емкость упадет ниже половины первоначальной емкости. Многие домашние зарядные устройства утверждают, что это «умные зарядные устройства», которые отключатся и не повредят батарею, но это, похоже, распространенная проблема. [ необходима цитата ]
Аккумуляторы Ni–Cd содержат от 6% (для промышленных аккумуляторов) до 18% (для коммерческих аккумуляторов) кадмия , который является токсичным тяжелым металлом и поэтому требует особой осторожности при утилизации аккумуляторов.
В Соединенных Штатах ожидаемая стоимость переработки батареи (которая будет использована для надлежащей утилизации по окончании срока службы) включена в цену покупки батареи.
Согласно так называемой «директиве о батареях» ( 2006/66/EC ), продажа потребительских Ni–Cd батарей теперь запрещена в Европейском Союзе, за исключением использования в медицинских целях, системах сигнализации, аварийном освещении и портативных электроинструментах. Последняя категория была запрещена с 2016 года. [12] Согласно той же директиве ЕС, использованные промышленные Ni–Cd батареи должны собираться их производителями для переработки на специальных предприятиях.