Кадмий — химический элемент ; он имеет символ Cd и атомный номер 48. Этот мягкий, серебристо-белый металл химически похож на два других стабильных металла в группе 12 , цинк и ртуть . Как и цинк, он демонстрирует степень окисления +2 в большинстве своих соединений, и, как ртуть, имеет более низкую температуру плавления, чем переходные металлы в группах с 3 по 11. Кадмий и его родственные соединения в группе 12 часто не считаются переходными металлами, поскольку они не имеют частично заполненных электронных оболочек d или f в элементарных или общих степенях окисления. Средняя концентрация кадмия в земной коре составляет от 0,1 до 0,5 частей на миллион (ppm). Он был открыт в 1817 году одновременно Штромейером и Германом , оба в Германии, как примесь в карбонате цинка .
Кадмий встречается в качестве второстепенного компонента в большинстве цинковых руд и является побочным продуктом производства цинка. Он использовался в течение длительного времени в 1900-х годах в качестве коррозионно-стойкого покрытия на стали , а соединения кадмия используются в качестве красных, оранжевых и желтых пигментов , для окраски стекла и стабилизации пластика . Использование кадмия в целом сокращается, поскольку он токсичен (он специально указан в Европейской директиве по ограничению опасных веществ [7] ), а никель-кадмиевые батареи были заменены никель-металлгидридными и литий-ионными батареями. Поскольку он является нейтронным ядом , кадмий также используется в качестве компонента стержней управления в ядерных реакторах деления. Одним из немногих его новых применений являются солнечные панели на основе теллурида кадмия .
Хотя кадмий не имеет известной биологической функции в высших организмах, в морских диатомовых водорослях обнаружена кадмий-зависимая карбоангидраза .
Кадмий — мягкий, ковкий , пластичный , серебристо-белый двухвалентный металл. Во многих отношениях он похож на цинк, но образует сложные соединения. [8] В отличие от большинства других металлов, кадмий устойчив к коррозии и используется в качестве защитной пластины на других металлах. Как объемный металл, кадмий нерастворим в воде [9] и не горюч ; однако в порошкообразной форме он может гореть и выделять токсичные пары . [10]
Хотя кадмий обычно имеет степень окисления +2, он также существует в состоянии +1. Кадмий и его конгенеры не всегда считаются переходными металлами, поскольку они не имеют частично заполненных электронных оболочек d или f в элементарных или обычных степенях окисления. [11] Кадмий сгорает на воздухе, образуя коричневый аморфный оксид кадмия (CdO); кристаллическая форма этого соединения — темно-красный цвет, который меняет цвет при нагревании, подобно оксиду цинка . Соляная кислота , серная кислота и азотная кислота растворяют кадмий, образуя хлорид кадмия (CdCl 2 ), сульфат кадмия (CdSO 4 ) или нитрат кадмия (Cd(NO 3 ) 2 ). Степень окисления +1 может быть получена путем растворения кадмия в смеси хлорида кадмия и хлорида алюминия , образуя катион Cd22 + , который аналогичен катиону Hg22 + в хлориде ртути(I) . [8]
Определены структуры многих комплексов кадмия с азотистыми основаниями , аминокислотами и витаминами . [12]
Кадмий, встречающийся в природе, состоит из восьми изотопов . Два из них радиоактивны , а три, как ожидается, распадутся , но не были измерены в лабораторных условиях. Два природных радиоактивных изотопа — это 113 Cd ( бета-распад , период полураспада7,7 × 10 15 лет ) и 116 Cd ( двойной бета-распад с двумя нейтрино , период полураспада составляет2,9 × 10 19 лет ). Остальные три — это 106 Cd, 108 Cd (оба с двойным электронным захватом ) и 114 Cd (двойной бета-распад); были определены только нижние пределы этих периодов полураспада. По крайней мере три изотопа — 110 Cd, 111 Cd и 112 Cd — стабильны. Среди изотопов, которые не встречаются в природе, наиболее долгоживущими являются 109 Cd с периодом полураспада 462,6 дня и 115 Cd с периодом полураспада 53,46 часа. Все остальные радиоактивные изотопы имеют период полураспада менее 2,5 часов, а большинство имеют период полураспада менее 5 минут. Кадмий имеет 8 известных метасостояний , наиболее стабильными из которых являются 113m Cd ( t 1⁄2 = 14,1 года), 115m Cd ( t 1⁄2 = 44,6 дня) и 117m Cd ( t 1⁄2 = 3,36 часа). [13]
Известные изотопы кадмия имеют атомную массу от 94,950 u ( 95 Cd) до 131,946 u ( 132 Cd). Для изотопов легче 112 u основным способом распада является захват электронов , а доминирующим продуктом распада является элемент 47 ( серебро ). Более тяжелые изотопы распадаются в основном через бета-излучение, производя элемент 49 ( индий ). [13]
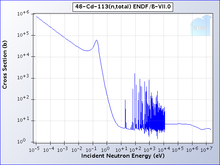
Один изотоп кадмия, 113 Cd, поглощает нейтроны с высокой селективностью: с очень высокой вероятностью нейтроны с энергией ниже порогового значения кадмия будут поглощены; те, что выше порогового значения, будут переданы . Пороговое значение кадмия составляет около 0,5 эВ, и нейтроны ниже этого уровня считаются медленными нейтронами , в отличие от промежуточных и быстрых нейтронов . [14]
Кадмий создается посредством s-процесса в звездах малой и средней массы с массой от 0,6 до 10 солнечных масс в течение тысяч лет. В этом процессе атом серебра захватывает нейтрон и затем подвергается бета-распаду . [15]

Кадмий ( лат. cadmia , греч. καδμεία , что означает « каламин », кадмиесодержащая смесь минералов, названная в честь греческого мифологического персонажа Κάδμος, Кадма , основателя Фив ) был обнаружен в загрязненных цинковых соединениях, продаваемых в аптеках в Германии [16] в 1817 году Фридрихом Штромейером . [17] Карл Самуэль Леберехт Германн одновременно исследовал изменение цвета в оксиде цинка и обнаружил примесь, сначала предположительно мышьяк , из-за желтого осадка с сероводородом . Кроме того, Штромейер обнаружил, что один поставщик продавал карбонат цинка вместо оксида цинка. [7] Штромейер обнаружил новый элемент как примесь в карбонате цинка (каламине), и в течение 100 лет Германия оставалась единственным крупным производителем этого металла. Металл был назван в честь латинского слова «каламин», потому что он был найден в этой цинковой руде. Штромейер заметил, что некоторые неочищенные образцы каламина изменили цвет при нагревании, но чистый каламин не изменился. Он был настойчив в изучении этих результатов и в конечном итоге выделил металлический кадмий путем обжига и восстановления сульфида . Потенциал кадмиевого желтого как пигмента был признан в 1840-х годах, но отсутствие кадмия ограничило это применение. [18] [19] [20]
Несмотря на то, что кадмий и его соединения токсичны в определенных формах и концентрациях, Британский фармацевтический кодекс 1907 года гласит, что йодид кадмия использовался в качестве лекарства для лечения «увеличенных суставов, золотушных желез и обморожений». [21]
В 1907 году Международный астрономический союз определил международный ангстрем в терминах спектральной линии красного кадмия (1 длина волны = 6438,46963 Å). [22] [23] Это было принято 7-й Генеральной конференцией по мерам и весам в 1927 году. В 1960 году определения метра и ангстрема были изменены с использованием криптона . [24]
После начала промышленного производства кадмия в 1930-х и 1940-х годах основным применением кадмия стало покрытие железа и стали для предотвращения коррозии; в 1944 году 62% и в 1956 году 59% кадмия в Соединенных Штатах использовалось для гальванопокрытия . [7] [25] В 1956 году 24% кадмия в Соединенных Штатах использовалось для вторичного применения в красных, оранжевых и желтых пигментах из сульфидов и селенидов кадмия. [25]
Стабилизирующий эффект химических веществ кадмия, таких как карбоксилаты лаурат кадмия и стеарат кадмия на ПВХ, привел к увеличению использования этих соединений в 1970-х и 1980-х годах. Спрос на кадмий в пигментах, покрытиях, стабилизаторах и сплавах снизился в результате экологических и санитарных норм в 1980-х и 1990-х годах; в 2006 году только 7% от общего потребления кадмия было использовано для гальванизации, и только 10% было использовано для пигментов. [7] В то же время это снижение потребления было компенсировано растущим спросом на кадмий для никель-кадмиевых батарей, которые составляли 81% потребления кадмия в Соединенных Штатах в 2006 году. [26]

Кадмий составляет около 0,1 ppm земной коры и является 65-м наиболее распространенным элементом. [27] Он встречается гораздо реже, чем цинк, который составляет около 65 ppm. [28] Неизвестно никаких значительных месторождений руд, содержащих кадмий. Единственный важный минерал кадмия, гринокит (Cd S ), почти всегда связан со сфалеритом (ZnS). Эта связь вызвана геохимическим сходством между цинком и кадмием, при этом нет геологического процесса, который мог бы их разделить. Таким образом, кадмий производится в основном как побочный продукт добычи, плавки и очистки сульфидных руд цинка и, в меньшей степени, свинца и меди . Небольшие количества кадмия, около 10% потребления, производятся из вторичных источников, в основном из пыли, образующейся при переработке железного и стального лома. Производство в США началось в 1907 году, [20] но широкое использование началось после Первой мировой войны. [29] [30]
Металлический кадмий можно найти в бассейне реки Вилюй в Сибири . [31]
Камни, добываемые для производства фосфатных удобрений, содержат различное количество кадмия, что приводит к концентрации кадмия до 300 мг/кг в удобрениях и высокому содержанию кадмия в сельскохозяйственных почвах. [32] [33] Уголь может содержать значительное количество кадмия, который в основном попадает в летучую золу угля . [34]
Кадмий в почве может поглощаться такими культурами, как рис и какао. В 2002 году министерство сельского хозяйства Китая измерило, что 28% отобранного им риса имели избыточное содержание свинца, а 10% имели избыточное содержание кадмия сверх установленных законом пределов. Consumer Reports проверили 28 марок темного шоколада, проданных в Соединенных Штатах в 2022 году, и обнаружили кадмий во всех из них, причем 13 из них превысили максимально допустимую дозу в Калифорнии. [35]
Было обнаружено, что некоторые растения, такие как ивы и тополя, очищают почву от свинца и кадмия. [36]
Типичные фоновые концентрации кадмия не превышают 5 нг/м3 в атмосфере; 2 мг/кг в почве; 1 мкг/л в пресной воде и 50 нг/л в морской воде. [37] Концентрации кадмия выше 10 мкг/л могут быть стабильными в воде с низкими общими концентрациями растворенных веществ и pH и их может быть трудно удалить с помощью обычных процессов очистки воды. [38]
Кадмий является распространенной примесью в цинковых рудах, и чаще всего его выделяют во время производства цинка . Некоторые концентраты цинковых руд из сульфатных руд цинка содержат до 1,4% кадмия. [39] В 1970-х годах выход кадмия составлял 2,9 килограмма (6,5 фунта) на тонну цинка. [39] Руды сульфида цинка обжигают в присутствии кислорода , преобразуя сульфид цинка в оксид . Металлический цинк получают либо плавкой оксида с углеродом , либо электролизом в серной кислоте . Кадмий выделяют из металлического цинка вакуумной перегонкой, если цинк плавится, или сульфат кадмия осаждают из электролизного раствора. [30] [40]
По данным Британской геологической службы , в 2001 году Китай был крупнейшим производителем кадмия, на его долю приходилось почти одна шестая часть мирового производства, за ним следовали Южная Корея и Япония. [41]
Кадмий является распространенным компонентом электрических батарей, пигментов , [42] покрытий, [43] и гальванопокрытий. [44]

В 2009 году 86% кадмия использовалось в батареях , преимущественно в перезаряжаемых никель-кадмиевых батареях . Никель-кадмиевые ячейки имеют номинальный потенциал ячейки 1,2 В. Ячейка состоит из положительного электрода из гидроксида никеля и отрицательной пластины из кадмиевого электрода, разделенных щелочным электролитом ( гидроксидом калия ). [45] Европейский союз установил ограничение на кадмий в электронике в 2004 году в размере 0,01%, [46] с некоторыми исключениями, а в 2006 году снизил ограничение на содержание кадмия до 0,002%. [47] Другим типом батареи на основе кадмия является серебряно-кадмиевая батарея .

Кадмиевое гальванопокрытие , потребляющее 6% мирового производства, используется в авиационной промышленности для снижения коррозии стальных компонентов. [44] Это покрытие пассивируется хроматными солями. [43] Ограничением кадмирования является водородная хрупкость высокопрочных сталей от процесса гальванопокрытия. Поэтому стальные детали, подвергнутые термообработке до предела прочности на разрыв выше 1300 МПа (200 ksi), должны покрываться альтернативным методом (например, специальными процессами кадмиевого гальванопокрытия с низкой хрупкостью или физическим осаждением из паровой фазы).
Охрупчивание титана из-за остатков кадмированного инструмента привело к запрету использования таких инструментов (и внедрению плановых испытаний инструментов для обнаружения загрязнения кадмием) в программах по созданию самолетов A-12/SR-71, U-2 и последующих, в которых использовался титан. [48]
Кадмий используется в стержнях управления ядерных реакторов, выступая в качестве очень эффективного нейтронного яда для управления потоком нейтронов при ядерном делении . [44] Когда кадмиевые стержни вставляются в активную зону ядерного реактора, кадмий поглощает нейтроны, [49] не давая им создавать дополнительные события деления, тем самым контролируя количество реактивности. Водо-водяной реактор под давлением , разработанный Westinghouse Electric Company, использует сплав, состоящий из 80% серебра, 15% индия и 5% кадмия. [44]
В конструкции телевизоров QLED начали использовать кадмий. Некоторые компании пытались уменьшить воздействие на окружающую среду, связанное с воздействием на человека и загрязнением материала в телевизорах во время производства. [50]
Комплексы на основе кадмия и других тяжелых металлов имеют потенциал для лечения рака, но их применение часто ограничено из-за токсических побочных эффектов. [51]

Оксид кадмия использовался в черно-белых телевизионных люминофорах, а также в синих и зеленых люминофорах электронно-лучевых трубок цветного телевидения. [52] Сульфид кадмия (CdS) используется в качестве фотопроводящего поверхностного покрытия для барабанов фотокопировальных аппаратов. [53]

Различные соли кадмия используются в пигментах красок, причем наиболее распространенным является CdS в качестве желтого пигмента . Селенид кадмия — красный пигмент, обычно называемый кадмиевым красным . Для художников, работающих с пигментом, кадмий обеспечивает самые яркие и стойкие желтые, оранжевые и красные цвета — настолько, что во время производства эти цвета значительно приглушаются, прежде чем их растирают с маслами и связующими веществами или смешивают с акварелью , гуашью , акрилом и другими красками и пигментными составами. Поскольку эти пигменты потенциально токсичны, пользователи должны использовать защитный крем на руках, чтобы предотвратить всасывание через кожу [42] , хотя количество кадмия, всасываемого в организм через кожу, составляет менее 1%. [10]
В ПВХ кадмий использовался в качестве стабилизаторов тепла, света и атмосферных воздействий. [44] [54] В настоящее время кадмиевые стабилизаторы полностью заменены барий-цинковыми, кальций-цинковыми и органо-оловянными стабилизаторами. Кадмий используется во многих видах припоев и подшипниковых сплавов, поскольку он имеет низкий коэффициент трения и усталостную прочность. [44] Он также встречается в некоторых сплавах с самой низкой температурой плавления , таких как металл Вуда . [55]
Кадмий является элементом некоторых полупроводниковых материалов. Сульфид кадмия, селенид кадмия и теллурид кадмия используются в некоторых фотодетекторах и солнечных элементах . Детекторы HgCdTe чувствительны к среднему инфракрасному свету [44] и используются в некоторых детекторах движения.

Гелий-кадмиевые лазеры являются распространенным источником синего или ультрафиолетового лазерного света. Лазеры на длинах волн 325, 354 и 442 нм производятся с использованием этой среды усиления ; некоторые модели могут переключаться между этими длинами волн. Они особенно используются во флуоресцентной микроскопии , а также в различных лабораторных применениях, требующих лазерного света на этих длинах волн. [56] [57]
Квантовые точки селенида кадмия испускают яркую люминесценцию при УФ-возбуждении (например, He–Cd-лазер). Цвет этой люминесценции может быть зеленым, желтым или красным в зависимости от размера частиц. Коллоидные растворы этих частиц используются для визуализации биологических тканей и растворов с помощью флуоресцентного микроскопа . [58]
В молекулярной биологии кадмий используется для блокирования потенциалзависимых кальциевых каналов от потока ионов кальция, а также в исследованиях гипоксии для стимуляции протеасомозависимой деградации Hif-1α . [59]
Кадмий-селективные датчики на основе флуорофора BODIPY были разработаны для визуализации и обнаружения кадмия в клетках. [60] Один из эффективных методов мониторинга кадмия в водных средах включает электрохимию . Используя самоорганизующийся монослой , можно получить кадмий-селективный электрод с чувствительностью на уровне ppt . [61]
Кадмий не имеет известной функции в высших организмах и считается токсичным. [62] Кадмий считается загрязнителем окружающей среды, опасным для живых организмов. [63] Кадмий-зависимая карбоангидраза была обнаружена у некоторых морских диатомовых водорослей , [64] которые живут в средах с низкой концентрацией цинка. [65]
Кадмий преимущественно поглощается почками человека. До 30 мг кадмия обычно вдыхается в течение детства и юности человека. [66]
Кадмий исследуется на предмет его потенциальной токсичности, которая может увеличить риск возникновения рака , сердечно-сосудистых заболеваний и остеопороза . [67] [68] [69] [70]
Биогеохимия кадмия и его выбросы в окружающую среду находятся в стадии изучения. [71] [72]
Отдельные лица и организации рассматривают бионеорганические аспекты кадмия на предмет его токсичности. [74] Наиболее опасной формой профессионального воздействия кадмия является вдыхание мелкой пыли и паров или прием внутрь высокорастворимых соединений кадмия. [7] Вдыхание паров кадмия может изначально привести к металлической лихорадке , но может прогрессировать до химического пневмонита , отека легких и смерти. [75]
Кадмий также представляет опасность для окружающей среды. Воздействие на человека в основном происходит из-за сжигания ископаемого топлива, фосфатных удобрений, природных источников, производства железа и стали, производства цемента и связанных с этим видов деятельности, производства цветных металлов и сжигания твердых бытовых отходов. [7] Другие источники кадмия включают хлеб, корнеплоды и овощи. [76]

Было несколько случаев отравления населения в результате длительного воздействия кадмия в загрязненной пище и воде. Исследования мимикрии эстрогена, которая может вызывать рак груди, продолжаются по состоянию на 2012 год [обновлять]. [76] В десятилетия, предшествовавшие Второй мировой войне , горнодобывающие работы загрязняли реку Дзиндзу в Японии кадмием и следами других токсичных металлов. В результате кадмий накапливался в рисовых посевах вдоль берегов реки ниже по течению от шахт. Некоторые члены местных сельскохозяйственных общин потребляли загрязненный рис и заболели болезнью итай-итай и почечными аномалиями, включая протеинурию и глюкозурию . [77] Жертвами этого отравления были почти исключительно женщины в постменопаузе с низким содержанием железа и низкими запасами других минералов в организме. Аналогичное воздействие кадмия на население в других частях мира не привело к таким же проблемам со здоровьем, поскольку население поддерживало достаточный уровень железа и других минералов. Таким образом, хотя кадмий является основным фактором заболевания итай-итай в Японии, большинство исследователей пришли к выводу, что это был один из нескольких факторов. [7]
Кадмий является одним из десяти веществ, запрещенных директивой Европейского союза об ограничении использования опасных веществ (RoHS), которая регулирует содержание опасных веществ в электрическом и электронном оборудовании, но допускает определенные исключения из сферы действия закона. [78]
Международное агентство по изучению рака классифицировало кадмий и его соединения как канцерогенные для человека. [79] Хотя профессиональное воздействие кадмия связано с раком легких и простаты, все еще существует неопределенность относительно канцерогенности кадмия при низком воздействии окружающей среды. Последние данные эпидемиологических исследований показывают, что потребление кадмия через пищу связано с более высоким риском рака эндометрия, груди и простаты, а также с остеопорозом у людей. [80] [81] [82] [83] Недавнее исследование продемонстрировало, что ткань эндометрия характеризуется более высокими уровнями кадмия у нынешних и бывших курящих женщин. [84]
Воздействие кадмия связано с большим количеством заболеваний, включая заболевания почек, [85] ранний атеросклероз, гипертонию и сердечно-сосудистые заболевания. [86] Хотя исследования показывают значительную корреляцию между воздействием кадмия и возникновением заболеваний в человеческих популяциях, молекулярный механизм еще не выявлен. Одна из гипотез гласит, что кадмий является эндокринным разрушителем , и некоторые экспериментальные исследования показали, что он может взаимодействовать с различными гормональными сигнальными путями. Например, кадмий может связываться с рецептором эстрогена альфа, [87] [88] и влиять на передачу сигнала по сигнальным путям эстрогена и MAPK в низких дозах. [89] [90] [91]
Табачное растение поглощает и накапливает тяжелые металлы , такие как кадмий, из окружающей почвы в своих листьях. После вдыхания табачного дыма они легко всасываются в организм пользователей. [92] Курение табака является наиболее важным источником воздействия кадмия на население в целом. По оценкам, 10% содержания кадмия в сигарете вдыхается через курение. Поглощение кадмия через легкие более эффективно, чем через кишечник. Может быть поглощено до 50% кадмия, вдыхаемого с сигаретным дымом. [93] В среднем концентрация кадмия в крови курильщиков в 4-5 раз выше, чем у некурящих, а в почках - в 2-3 раза выше, чем у некурящих. Несмотря на высокое содержание кадмия в сигаретном дыме, пассивное курение, по-видимому, оказывает незначительное воздействие кадмия . [94]
У некурящего населения пища является наибольшим источником воздействия. Большое количество кадмия можно найти в ракообразных , моллюсках , потрохах , лягушачьих лапках , твердых частицах какао , горьком и полугорьком шоколаде , морских водорослях , грибах и продуктах из водорослей . Однако зерновые, овощи и крахмалистые корни и клубни потребляются в гораздо большем количестве в США и являются там источником наибольшего пищевого воздействия. [95] Большинство растений биоаккумулируют металлические токсины, такие как кадмий, и при компостировании для образования органических удобрений дают продукт, который часто может содержать большое количество (например, более 0,5 мг) металлических токсинов на каждый килограмм удобрения. Удобрения, изготовленные из навоза животных (например, коровьего навоза) или городских отходов, могут содержать аналогичное количество кадмия. Кадмий, добавленный в почву из удобрений (фосфатов или органических удобрений), становится биодоступным и токсичным только при низком pH почвы (т. е. кислых почвах). В Европейском Союзе анализ почти 22 000 образцов верхнего слоя почвы с помощью обследования LUCAS показал, что 5,5% образцов имеют концентрацию выше 1 мг кг −1 . [96]
Ионы цинка, меди, кальция и железа, а также селен с витамином С используются для лечения кадмиевой интоксикации, хотя ее нелегко вылечить. [85]
Из-за неблагоприятного воздействия кадмия на окружающую среду и здоровье человека его поставки и использование в Европе ограничены Регламентом REACH .
Группа экспертов EFSA по загрязняющим веществам в пищевой цепи указывает, что 2,5 мкг/кг веса тела является допустимым еженедельным потреблением для человека. [95] Объединенный комитет экспертов ФАО/ВОЗ по пищевым добавкам объявил 7 мкг/кг веса тела предварительным допустимым еженедельным уровнем потребления. [97] Штат Калифорния требует, чтобы на этикетке пищевых продуктов содержалось предупреждение о потенциальном воздействии кадмия на такие продукты, как какао-порошок. [98] Европейская комиссия ввела в действие регламент ЕС (2019/1009) об удобрениях (ЕС, 2019), принятый в июне 2019 года и полностью применимый с июля 2022 года , устанавливает предельное значение Cd в фосфатных удобрениях на уровне 60 мг кг − 1 P2O5 .
Управление по охране труда и здоровья США (OSHA) установило допустимый предел воздействия (PEL) для кадмия на уровне средневзвешенного по времени значения (TWA) 0,005 ppm. Национальный институт охраны труда и здоровья (NIOSH) не установил рекомендуемый предел воздействия (REL) и обозначил кадмий как известный канцероген для человека. Уровень IDLH (непосредственно опасный для жизни и здоровья) для кадмия составляет 9 мг/м3 . [ 99]
Помимо ртути, наличие кадмия в некоторых батареях привело к необходимости надлежащей утилизации (или переработки) батарей.
В мае 2006 года распродажа сидений со старого стадиона футбольного клуба «Арсенал» Хайбери в Лондоне, Англия, была отменена, когда в сиденьях были обнаружены следы кадмия. [101] Сообщения о высоком уровне использования кадмия в детских ювелирных изделиях в 2010 году привели к расследованию Комиссии по безопасности потребительских товаров США . [102] Комиссия по безопасности потребительских товаров США выпустила специальные уведомления об отзыве в связи с содержанием кадмия в ювелирных изделиях, продаваемых магазинами Claire's [103] и Wal-Mart [104] .
В июне 2010 года McDonald's добровольно отозвал более 12 миллионов коллекционных стаканов для питья Shrek Forever After 3D из-за содержания кадмия в пигментах краски на стеклянной посуде. [105] Стаканы были произведены компанией Arc International из Миллвилла, штат Нью-Джерси , США. [106]