Рецепторы эстрогена ( ER ) — это белки, обнаруженные в клетках , которые функционируют как рецепторы для гормона эстрогена ( 17β-эстрадиола ). [1] Существует два основных класса ER. Первый включает внутриклеточные рецепторы эстрогена, а именно ERα и ERβ , которые принадлежат к семейству ядерных рецепторов . Второй класс состоит из мембранных рецепторов эстрогена (mER), таких как GPER (GPR30), ER-X и G q -mER , которые в основном являются рецепторами, связанными с G-белком . В этой статье основное внимание уделяется ядерным рецепторам эстрогена (ERα и ERβ).
При активации эстрогеном внутриклеточные ER подвергаются транслокации в ядро, где они связываются со специфическими последовательностями ДНК. Как факторы транскрипции , связывающие ДНК , они регулируют активность различных генов. Однако ER также проявляют функции, которые не зависят от их способности связывать ДНК. [2] Эти негеномные действия способствуют разнообразным эффектам сигнализации эстрогена в клетках.
Рецепторы эстрогена (ER) принадлежат к семейству рецепторов стероидных гормонов , которые являются гормональными рецепторами для половых стероидов . Наряду с рецепторами андрогенов (AR) и рецепторами прогестерона (PR), ER играют важную роль в регуляции полового созревания и беременности . Эти рецепторы опосредуют эффекты своих соответствующих гормонов, способствуя развитию и поддержанию репродуктивных функций и вторичных половых признаков .
У человека две формы рецептора эстрогена кодируются разными генами : ESR1 и ESR2 на шестой и четырнадцатой хромосоме (6q25.1 и 14q23.2) соответственно.
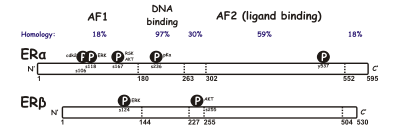
Существует две различные формы рецептора эстрогена, обычно называемые α и β , каждая из которых кодируется отдельным геном ( ESR1 и ESR2 соответственно). Гормонально-активируемые рецепторы эстрогена образуют димеры , и, поскольку эти две формы коэкспрессируются во многих типах клеток, рецепторы могут образовывать гомодимеры ERα (αα) или ERβ (ββ) или гетеродимеры ERαβ (αβ). [3] Рецепторы эстрогена альфа и бета демонстрируют значительную общую гомологию последовательностей, и оба состоят из пяти доменов, обозначенных A/B через F (перечислены от N- к C-концу; номера последовательностей аминокислот относятся к человеческому ER). [ необходима цитата ]
N -концевой домен A/B способен трансактивировать транскрипцию гена в отсутствие связанного лиганда (например, гормона эстрогена). Хотя этот регион способен активировать транскрипцию гена без лиганда, эта активация слабая и более избирательная по сравнению с активацией, обеспечиваемой доменом E. Домен C, также известный как домен связывания ДНК , связывается с элементами ответа эстрогена в ДНК. Домен D представляет собой шарнирную область, которая соединяет домены C и E. Домен E содержит полость связывания лиганда, а также сайты связывания для белков -коактиваторов и корепрессоров . Домен E в присутствии связанного лиганда способен активировать транскрипцию гена. Функция домена F C-конца не совсем ясна и имеет переменную длину. [ необходима цитата ]
Из-за альтернативного сплайсинга РНК известно о существовании нескольких изоформ ER. Было идентифицировано по крайней мере три изоформы ERα и пять изоформ ERβ. Подтипы рецепторов изоформ ERβ могут трансактивировать транскрипцию только при образовании гетеродимера с функциональным рецептором ERß1 массой 59 кДа. Рецептор ERß3 был обнаружен на высоком уровне в яичках. Две другие изоформы ERα имеют массу 36 и 46 кДа. [4] [5]
Рецептор ERγ описан только у рыб, но не у людей. [6]
Оба ЭР широко экспрессируются в различных типах тканей, однако существуют некоторые заметные различия в их паттернах экспрессии: [7]
В не связанном состоянии ER считаются цитоплазматическими рецепторами, но исследования с визуализацией показали, что лишь небольшая часть ER находится в цитоплазме, а большая часть ER находится в ядре. [11] Первичный транскрипт «ERα» дает начало нескольким альтернативно сплайсированным вариантам неизвестной функции. [12]
Поскольку эстроген является стероидным гормоном , он может легко диффундировать через фосфолипидные мембраны клеток из-за своей липофильной природы. В результате рецепторы эстрогена могут быть расположены внутриклеточно и не обязательно должны быть связаны с мембраной, чтобы взаимодействовать с эстрогеном. [13] Однако существуют как внутриклеточные, так и связанные с мембраной рецепторы эстрогена, каждый из которых опосредует различные клеточные реакции на эстроген. [14]
При отсутствии гормона эстрогеновые рецепторы преимущественно расположены в цитоплазме. [15] Связывание гормона запускает ряд событий, начиная с миграции рецептора из цитоплазмы в ядро. Затем следует димеризация рецептора, при которой две молекулы рецептора объединяются. Наконец, димер рецептора связывается со специфическими последовательностями ДНК, известными как элементы ответа гормона , инициируя процесс регуляции гена .
Затем комплекс ДНК/рецептор привлекает другие белки, ответственные за транскрипцию ДНК ниже по течению в мРНК и, в конечном итоге, в белок, что приводит к изменениям в функции клетки. [15] Рецепторы эстрогена также присутствуют в ядре клетки , и оба подтипа рецепторов эстрогена (ERα и ERβ) содержат домен связывания ДНК , что позволяет им функционировать как факторы транскрипции , регулирующие выработку белка . [16]
Рецептор также взаимодействует с факторами транскрипции, такими как активаторный белок 1 и Sp-1, для стимуляции транскрипции через несколько коактиваторов, включая PELP-1 . [15] Киназа супрессора опухолей LKB1 коактивирует ERα в ядре клетки посредством прямого связывания, привлекая его к промотору генов, чувствительных к ERα. Каталитическая активность LKB1 усиливает трансактивацию ERα по сравнению с каталитически дефицитными мутантами LKB1. [17] Прямое ацетилирование эстрогенового рецептора альфа по остаткам лизина в шарнирной области с помощью p300 регулирует трансактивацию и чувствительность к гормонам. [18]
Ядерные рецепторы эстрогена также могут связываться с клеточной поверхностной мембраной и подвергаться быстрой активации при воздействии эстрогена на клетку. [19] [20]
Некоторые ER взаимодействуют с клеточными мембранами, связываясь с кавеолином-1 и образуя комплексы с G-белками , стриатином , рецепторными тирозинкиназами (например, EGFR и IGF-1 ) и нерецепторными тирозинкиназами (например, Src ). [2] [19] Мембранно-связанные ER, связанные со стриатином, могут повышать уровни Ca 2+ и оксида азота (NO). [21] Взаимодействие с рецепторными тирозинкиназами запускает передачу сигналов в ядро через пути митоген-активируемой протеинкиназы (MAPK/ERK) и фосфоинозитид-3-киназы (Pl3K/ AKT ). [22]
Гликогенсинтазы киназа-3 (GSK)-3β ингибирует ядерную транскрипцию ER, предотвращая фосфорилирование серина 118 на ядерном ERα. Пути PI3K/AKT и MAPK/ ERK могут фосфорилировать GSK-3β, тем самым устраняя его ингибирующий эффект, причем последний путь действует через rsk .
Было показано, что 17β-эстрадиол активирует рецептор GPR30, связанный с G-белком . [23] Однако субклеточная локализация и точная роль этого рецептора остаются спорными. [24]


Рецепторы эстрогена сверхэкспрессируются примерно в 70% случаев рака груди , называемых « ER-положительными », и могут быть выявлены в таких тканях с помощью иммуногистохимии . Было предложено две гипотезы, чтобы объяснить, почему это вызывает опухолеобразование , и имеющиеся данные свидетельствуют о том, что оба механизма способствуют:
Результатом обоих процессов является нарушение клеточного цикла , апоптоза и репарации ДНК , что увеличивает вероятность образования опухолей. ERα, безусловно, связан с более дифференцированными опухолями, в то время как доказательства того, что ERβ участвует, являются спорными. Были идентифицированы различные версии гена ESR1 (с однонуклеотидными полиморфизмами ), которые связаны с различными рисками развития рака молочной железы. [25]
Эстроген и ER также были вовлечены в рак груди , рак яичников , рак толстой кишки , рак простаты и рак эндометрия . Распространенный рак толстой кишки связан с потерей ERβ, преобладающего ER в тканях толстой кишки, и рак толстой кишки лечится ERβ-специфическими агонистами. [26]
Эндокринная терапия рака молочной железы включает селективные модуляторы эстрогеновых рецепторов (SERMS), такие как тамоксифен , которые ведут себя как антагонисты ER в тканях молочной железы, или ингибиторы ароматазы , такие как анастрозол . Статус ER используется для определения чувствительности поражений рака молочной железы к тамоксифену и ингибиторам ароматазы. [27] Другой SERM, ралоксифен , использовался в качестве профилактической химиотерапии для женщин, у которых, как считается, высокий риск развития рака молочной железы. [28] Другой химиотерапевтический антиэстроген, ICI 182,780 (Faslodex), который действует как полный антагонист, также способствует деградации рецептора эстрогена.
Однако de novo резистентность к эндокринной терапии подрывает эффективность использования конкурентных ингибиторов, таких как тамоксифен. Гормональная депривация посредством использования ингибиторов ароматазы также оказывается бесполезной. [29] Массовое параллельное секвенирование генома выявило общее присутствие точечных мутаций на ESR1 , которые являются драйверами резистентности и способствуют агонистической конформации ERα без связанного лиганда . Такая конститутивная, независимая от эстрогена активность обусловлена специфическими мутациями, такими как мутации D538G или Y537S/C/N, в лиганд-связывающем домене ESR1 и способствуют пролиферации клеток и прогрессированию опухоли без гормональной стимуляции. [30]
Метаболические эффекты эстрогена у женщин в постменопаузе связаны с генетическим полиморфизмом рецептора эстрогена бета (ER-β) . [31]
Исследования на самках мышей показали, что уровень эстрогеновых рецепторов альфа снижается в преоптическом гипоталамусе по мере их старения. Самки мышей, которым давали диету с ограничением калорий в течение большей части жизни, поддерживали более высокий уровень ERα в преоптическом гипоталамусе, чем их коллеги, не ограничивавшие калорий. [8]
Яркая демонстрация важности эстрогенов в регуляции отложения жира была получена на примере трансгенных мышей , которые были генетически модифицированы, чтобы у них отсутствовал функциональный ген ароматазы . У этих мышей очень низкий уровень эстрогена, и они страдают ожирением. [32] Ожирение также наблюдалось у самок мышей с дефицитом эстрогена, у которых отсутствовал рецептор фолликулостимулирующего гормона . [33] Влияние низкого уровня эстрогена на повышенное ожирение было связано с рецептором эстрогена альфа. [34]
Также изучаются СЭРМ для лечения миомы матки [35] и эндометриоза . [36] Доказательства, подтверждающие использование СЭРМ для лечения миомы матки (уменьшение размера миомы и улучшение других клинических результатов), не являются окончательными, и необходимы дополнительные исследования. [35] Также не ясно, эффективны ли СЭРМ для лечения эндометриоза. [36]
Синдром нечувствительности к эстрогену — редкое интерсексуальное состояние с 5 зарегистрированными случаями, при котором рецепторы эстрогена не функционируют. Фенотип приводит к обширной маскулинизации . В отличие от синдрома нечувствительности к андрогенам , EIS не приводит к фенотипической смене пола . Это невероятно редкое явление, аналогичное AIS и формам гиперплазии надпочечников . Причина, по которой AIS распространен, а EIS исключительно редок, заключается в том, что XX AIS не приводит к бесплодию и, следовательно, может наследоваться по материнской линии , в то время как EIS всегда приводит к бесплодию независимо от кариотипа . Отрицательная обратная связь между эндокринной системой также возникает при EIS, при котором гонады вырабатывают заметно более высокие уровни эстрогена у людей с EIS (119–272 пг/мл XY и 750–3500 пг/мл XX, см. средние уровни ), однако никаких феминизирующих эффектов не происходит. [37] [38]
Домен спирали 12 ЭР играет решающую роль в определении взаимодействий с коактиваторами и корепрессорами и, следовательно, соответствующего агонистического или антагонистического эффекта лиганда. [39] [40]
Различные лиганды могут отличаться по своему сродству к альфа- и бета-изоформам эстрогенового рецептора:
Подтип селективных модуляторов эстрогеновых рецепторов преимущественно связывается либо с α-, либо с β-подтипом рецептора. Кроме того, различные комбинации эстрогеновых рецепторов могут по-разному реагировать на различные лиганды, что может приводить к селективным агонистическим и антагонистическим эффектам тканей. [42] Было высказано предположение, что соотношение концентрации α- и β-подтипов играет роль в некоторых заболеваниях. [43]
Концепция селективных модуляторов эстрогеновых рецепторов основана на способности стимулировать взаимодействия ER с различными белками, такими как транскрипционные коактиваторы или корепрессоры . Кроме того, соотношение коактиватора и корепрессорного белка варьируется в разных тканях. [44] Как следствие, один и тот же лиганд может быть агонистом в некоторых тканях (где преобладают коактиваторы), но антагонистом в других тканях (где преобладают корепрессоры). Тамоксифен, например, является антагонистом в молочной железе и, следовательно, используется для лечения рака молочной железы [25], но агонистом ER в кости (тем самым предотвращая остеопороз ) и частичным агонистом в эндометрии (увеличивая риск рака матки ).
Рецепторы эстрогена были впервые идентифицированы Элвудом В. Дженсеном в Чикагском университете в 1958 году, [45] [46], за что Дженсен был удостоен премии Ласкера . [47] Ген второго рецептора эстрогена (ERβ) был идентифицирован в 1996 году Кёйпером и др. в предстательной железе и яичниках крыс с использованием вырожденных праймеров ERalpha. [48]