Биологические перекрестные помехи относятся к случаям, когда один или несколько компонентов одного пути передачи сигнала влияют на другой. Это может быть достигнуто несколькими способами, наиболее распространенной формой которых является перекрестная помеха между белками сигнальных каскадов. В этих путях передачи сигнала часто есть общие компоненты, которые могут взаимодействовать с любым из путей. Более сложный случай перекрестной помехи можно наблюдать при трансмембранной перекрестной помехе между внеклеточным матриксом (ECM) и цитоскелетом .
Один из примеров перекрестных помех между белками в сигнальном пути можно увидеть на примере роли циклического аденозинмонофосфата (цАМФ) в регуляции пролиферации клеток путем взаимодействия с путем митоген-активируемой протеинкиназы (МАР). цАМФ — это соединение, синтезируемое в клетках аденилатциклазой в ответ на различные внеклеточные сигналы. [1] цАМФ в первую очередь действует как внутриклеточный вторичный мессенджер, основным внутриклеточным рецептором которого является цАМФ-зависимая протеинкиназа (ПКА), которая действует через фосфорилирование целевых белков. [2] Путь передачи сигнала начинается с взаимодействия лиганда с рецептором внеклеточно. Затем этот сигнал передается через мембрану, стимулируя аденилатциклазу на внутренней поверхности мембраны для катализа преобразования АТФ в цАМФ. [3] [4]
ERK, участвующий белок в сигнальном пути MAPK, может быть активирован или ингибирован цАМФ. [5] цАМФ может ингибировать ERK различными способами, большинство из которых включают цАМФ-зависимую протеинкиназу (PKA) и ингибирование Ras-зависимых сигналов к Raf-1. [6] Однако цАМФ также может стимулировать пролиферацию клеток, стимулируя ERK. Это происходит посредством индукции специфических генов посредством фосфорилирования фактора транскрипции CREB цАМФ. [5] Хотя ERK, по-видимому, не являются обязательным условием для этого фосфорилирования CREB, путь MAPK снова играет роль в перекрестных помехах, поскольку ERK необходимы для фосфорилирования белков ниже CREB. [5] Другие известные примеры необходимости ERK для транскрипционных эффектов, вызванных цАМФ, включают индукцию гена пролактина в клетках гипофиза и гена бета-гидроксилата дофамина в феохромоцитомных клетках (PC12). [6] Существует ряд разнообразных механизмов, посредством которых цАМФ может влиять на сигнализацию ERK. Большинство механизмов, включающих ингибирование цАМФ ERK, разъединяют Raf-1 от активации Ras через прямое взаимодействие PKA с Raf-1 или косвенно через взаимодействие PKA с ГТФазой Rap1 [6] (см. рисунок 1). PKA также может негативно регулировать ERK путем активации PTPases. Механизмы активации ERK цАМФ еще более разнообразны, обычно включая Rap1 или Ras, и даже цАМФ напрямую. [6]

Перекрестные помехи можно наблюдать даже через мембраны. Мембранные взаимодействия с внеклеточным матриксом (ECM) и с соседними клетками могут вызывать различные реакции внутри клетки. Однако топография и механические свойства ECM также начинают играть важную роль в мощных, сложных перекрестных помехах с клетками, растущими на матриксе или внутри него. [7] Например, сборка цитоскелета , опосредованная интегрином , и даже подвижность клеток зависят от физического состояния ECM. [7] Связывание интегрина α5β1 с его лигандом ( фибронектином ) активирует образование фибриллярных адгезий и актиновых нитей . [5] Однако, если ECM иммобилизован, реорганизация матрикса такого рода и образование фибриллярных адгезий ингибируется. [7] В свою очередь, связывание того же интегрина (α5β1) с иммобилизованным лигандом фибронектина, как видно, образует высокофосфорилированные фокальные контакты/ фокальную адгезию (клетки, участвующие в адгезии матрицы) внутри мембраны и снижает скорость миграции клеток [7] В другом примере перекрестных помех это изменение в составе фокальных контактов в цитоскелете может быть ингибировано членами еще одного пути: ингибиторами киназ легких цепей миозина или Rho-киназ, H-7 или ML-7, которые снижают сократимость клеток и, следовательно, подвижность. [7] (см. рисунок 2).

Более сложный, конкретный пример перекрестных помех между двумя основными сигнальными путями можно наблюдать при взаимодействии сигнальных путей цАМФ и МАРК при активации лимфоцитов . В этом случае компоненты пути цАМФ напрямую и косвенно влияют на сигнальный путь МАРК, предназначенный для активации генов, связанных с иммунитетом и лимфоцитами.
Вновь образованный цАМФ высвобождается из мембраны и диффундирует через внутриклеточное пространство , где он служит для активации PKA. Каталитическая субъединица PKA должна связать четыре молекулы цАМФ, чтобы активироваться, после чего активация состоит из расщепления между регуляторной и каталитической субъединицами. [4] Это расщепление, в свою очередь, активирует PKA, обнажая каталитические сайты субъединиц C, которые затем могут фосфорилировать массив белков в клетке. [4]
В лимфоцитах внутриклеточные уровни цАМФ увеличиваются при стимуляции антиген-рецептора и еще больше в ответ на простагландин Е и другие иммуносупрессивные агенты. [8] В этом случае цАМФ служит для ингибирования игроков иммунитета. PKA типа I колокализуется с рецепторами антигена Т-клеток и В-клеток [9] и вызывает ингибирование активации Т- и В-клеток. PKA даже был выделен как прямой индуктор генов, способствующих иммуносупрессии. [10]
Кроме того, путь цАМФ также взаимодействует с путем MAPK более косвенным образом через его взаимодействие с гемопоэтической PTPase (HePTP). HePTP экспрессируется во всех лейкоцитах. При сверхэкспрессии в Т-клетках HePTP снижает транскрипционную активацию промотора интерлейкина -2 , обычно индуцируемую активированным рецептором Т-клеток через каскад сигнализации MAPK. [11] Способ, которым HePTP эффективно ингибирует сигнализацию MAPK, заключается в взаимодействии с MAP-киназами Erk1, Erk2 и p38 через короткую последовательность в некаталитическом N-конце HePTP, называемом мотивом взаимодействия киназы (KIM)., [11] [12] Высокоспецифичное связывание Erk и p38 с этой субъединицей HePTP приводит к быстрой инактивации каскада сигнализации (см. рисунок 3).
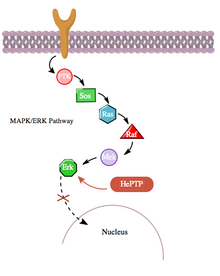
Тем не менее, поскольку и HePTP, и Erk являются цитозольными ферментами , [13] разумно заключить, что существует механизм прекращения ингибирования Erk HePTP, чтобы обеспечить транслокацию активированного Erk в ядро . Действительно, как и во многих других случаях белок-белкового взаимодействия, HePTP, по-видимому, фосфорилируется Erk и p38 на участках Thr45 и Ser72. [11] Однако важно отметить, что был обнаружен третий участок фосфорилирования в некаталитическом N-конце (область KIM) HePTP — тот, который фосфорилируется до гораздо более высокой стехиометрии путем цАМФ, [1] в еще одном случае перекрестных помех между путями цАМФ и MAPK.
Фосфорилирование этого третьего сайта PKA из пути цАМФ ингибирует связывание MAP-киназ с HePTP и тем самым активирует каскад сигнализации MAPK/ERK. Путь MAPK через Ras, Raf, Mek и Erk демонстрирует низкую активность в присутствии нефосфорилированного (активного) HePTP. Однако активация пути цАМФ стимулирует активацию PKA, которая, в свою очередь, фосфорилирует HePTP в Ser23. Это предотвращает связывание HePTP с Erk и освобождает путь MAPK от ингибирования, позволяя продолжить нисходящую сигнализацию (см. рисунок 4).

Более того, исследования с участием гладкомышечных клеток предсердия сердца показали, что PKA может снижать активацию MAP-киназ в ответ на фактор роста тромбоцитов ( PDGF ) путем фосфорилирования киназы c-Raf . [14] Таким образом, кажется правдоподобным, что PKA в пути цАМФ может даже далее участвовать в регуляции активации лимфоцитов не только путем ингибирования сигнального пути антиген-рецептор MAPK на его конечной стадии, но и далее вверх по течению.