
Ферменты ( / ˈ ɛ n z aɪ m z / ) — это белки , которые действуют как биологические катализаторы , ускоряя химические реакции . Молекулы , на которые могут действовать ферменты, называются субстратами , и фермент превращает субстраты в различные молекулы, известные как продукты . Почти все метаболические процессы в клетке нуждаются в ферментативном катализе , чтобы протекать с достаточной скоростью для поддержания жизни. [1] : 8.1. Метаболические пути зависят от ферментов, катализирующих отдельные этапы. Изучение ферментов называется энзимологией , и в области анализа псевдоферментов признается, что в ходе эволюции некоторые ферменты утратили способность осуществлять биологический катализ, что часто отражается на их аминокислотных последовательностях и необычных «псевдокаталитических» свойствах. [2] [3]
Известно, что ферменты катализируют более 5000 типов биохимических реакций. [4] Другими биокатализаторами являются каталитические молекулы РНК , называемые рибозимами . Специфичность фермента обусловлена его уникальной трехмерной структурой .
Как и все катализаторы, ферменты увеличивают скорость реакции за счет снижения ее энергии активации . Некоторые ферменты могут ускорять превращение субстрата в продукт во много миллионов раз. Крайним примером является оротидин-5'-фосфатдекарбоксилаза , которая позволяет реакции, которая в противном случае заняла бы миллионы лет, протекать за миллисекунды. [5] [6] С химической точки зрения ферменты подобны любому катализатору: они не расходуются в химических реакциях и не изменяют равновесие реакции . Ферменты отличаются от большинства других катализаторов гораздо более специфичностью. На активность фермента могут влиять другие молекулы: ингибиторы — это молекулы, которые снижают активность фермента, а активаторы — это молекулы, которые повышают активность. Многие терапевтические препараты и яды являются ингибиторами ферментов. Активность фермента заметно снижается за пределами оптимальной температуры и pH , и многие ферменты (постоянно) денатурируются при воздействии чрезмерного тепла, теряя свою структуру и каталитические свойства.
Некоторые ферменты используются в коммерческих целях, например, при синтезе антибиотиков . В некоторых предметах домашнего обихода используются ферменты для ускорения химических реакций: ферменты в биологических стиральных порошках расщепляют белковые, крахмальные или жировые пятна на одежде, а ферменты в размягчителях мяса расщепляют белки на более мелкие молекулы, благодаря чему мясо легче пережевывать.

К концу 17-го и началу 18-го веков переваривание мяса желудочными выделениями [7] и превращение крахмала в сахара растительными экстрактами и слюной были известны, но механизмы, посредством которых это происходило, не были идентифицированы. [8]
Французский химик Ансельм Пайен был первым, кто открыл фермент диастазу , в 1833 году. [9] Несколько десятилетий спустя, изучая ферментацию сахара в спирт с помощью дрожжей , Луи Пастер пришел к выводу, что это брожение было вызвано жизненной силой, содержащейся внутри дрожжевые клетки, называемые «ферментами», которые, как считалось, функционируют только внутри живых организмов. Он писал, что «спиртовое брожение — это процесс, связанный с жизнью и организацией дрожжевых клеток, а не с гибелью или гниением клеток». [10]
В 1877 году немецкий физиолог Вильгельм Кюне (1837–1900) впервые использовал термин « фермент» , который происходит от древнегреческого ἔνζυμον (énzymon) « заквашенный в дрожжах», для описания этого процесса. [11] Слово « фермент» использовалось позже для обозначения неживых веществ, таких как пепсин , а слово « фермент» использовалось для обозначения химической активности, производимой живыми организмами. [12]
Эдуард Бюхнер представил свою первую работу по изучению дрожжевых экстрактов в 1897 году. В серии экспериментов в Берлинском университете он обнаружил, что сахар сбраживается дрожжевыми экстрактами даже тогда, когда в смеси не было живых дрожжевых клеток. [13] Он назвал фермент, вызывающий ферментацию сахарозы, « зимазой ». [14] В 1907 году он получил Нобелевскую премию по химии за «открытие бесклеточного брожения». Следуя примеру Бюхнера, ферменты обычно называют в соответствии с проводимой ими реакцией: суффикс -аза сочетается с названием субстрата (например, лактаза — фермент, расщепляющий лактозу ) или с типом реакции (например, ДНК-полимераза). образует полимеры ДНК). [15]
Биохимическая идентичность ферментов была еще неизвестна в начале 1900-х годов. Многие ученые отмечали, что ферментативная активность связана с белками, но другие (например, нобелевский лауреат Рихард Вильштеттер ) утверждали, что белки были просто носителями настоящих ферментов и что белки сами по себе неспособны к катализу. [16] В 1926 году Джеймс Б. Самнер показал, что фермент уреаза представляет собой чистый белок, и кристаллизовал его; он сделал то же самое для фермента каталазы в 1937 году. Вывод о том, что чистые белки могут быть ферментами, был окончательно продемонстрирован Джоном Говардом Нортропом и Уэнделлом Мередит Стэнли , которые работали над пищеварительными ферментами пепсином (1930), трипсином и химотрипсином . Эти трое учёных были удостоены Нобелевской премии по химии 1946 года. [17]
Открытие возможности кристаллизации ферментов в конечном итоге позволило определить их структуру с помощью рентгеновской кристаллографии . Впервые это было сделано для лизоцима , фермента, содержащегося в слезах, слюне и яичных белках , который расщепляет оболочки некоторых бактерий; структура была расшифрована группой под руководством Дэвида Чилтона Филлипса и опубликована в 1965 году. [18] Эта структура лизоцима с высоким разрешением положила начало области структурной биологии и попыткам понять, как ферменты работают на атомном уровне детализации. . [19]
Ферменты можно классифицировать по двум основным критериям: сходству аминокислотных последовательностей (и, следовательно, эволюционному родству) или ферментативной активности.
Ферментативная активность . Название фермента часто происходит от его субстрата или химической реакции, которую он катализирует, причем слово заканчивается на -аза . [1] : 8.1.3 Примерами являются лактаза , алкогольдегидрогеназа и ДНК-полимераза . Различные ферменты, катализирующие одну и ту же химическую реакцию, называются изоферментами . [1] : 10,3
Международный союз биохимии и молекулярной биологии разработал номенклатуру ферментов, номера ЕС (от «Комиссия по ферментам») . Каждый фермент описывается буквой «EC», за которой следует последовательность из четырех чисел, которые представляют иерархию ферментативной активности (от очень общей до очень специфической). То есть первая цифра широко классифицирует фермент на основе его механизма, в то время как другие цифры добавляют все больше и больше специфичности. [20]
Классификация верхнего уровня:
Эти разделы подразделяются по другим признакам, таким как субстрат, продукты и химический механизм . Фермент полностью определяется четырьмя цифровыми обозначениями. Например, гексокиназа (EC 2.7.1.1) представляет собой трансферазу (EC 2), которая присоединяет фосфатную группу (EC 2.7) к гексозному сахару, молекуле, содержащей спиртовую группу (EC 2.7.1). [21]
Сходство последовательности . Категории EC не отражают сходство последовательностей. Например, две лигазы с одинаковым номером ЕС, катализирующие одну и ту же реакцию, могут иметь совершенно разные последовательности. Независимо от своей функции ферменты, как и любые другие белки, по сходству последовательностей подразделяются на многочисленные семейства. Эти семейства были задокументированы в десятках баз данных различных белков и семейств белков, таких как Pfam . [22]
негомологичные изофункциональные ферменты . Неродственные ферменты, обладающие одинаковой ферментативной активностью, получили название негомологичных изофункциональных ферментов . [23] Горизонтальный перенос генов может распространить эти гены на несвязанные виды, особенно на бактерии, где они могут заменять эндогенные гены с той же функцией, что приводит к смещению гомологичных генов.

Ферменты обычно представляют собой глобулярные белки , действующие по отдельности или в более крупных комплексах . Последовательность аминокислот определяет структуру, которая, в свою очередь, определяет каталитическую активность фермента. [24] Хотя структура определяет функцию, новую ферментативную активность еще нельзя предсказать только на основе структуры. [25] Структуры ферментов разворачиваются ( денатурируют ) при нагревании или воздействии химических денатурантов, и это нарушение структуры обычно приводит к потере активности. [26] Денатурация фермента обычно связана с температурой выше нормального уровня вида; в результате ферменты бактерий, живущих в вулканической среде, такой как горячие источники, ценятся промышленными пользователями за их способность функционировать при высоких температурах, что позволяет протекать катализируемых ферментами реакциям с очень высокой скоростью.
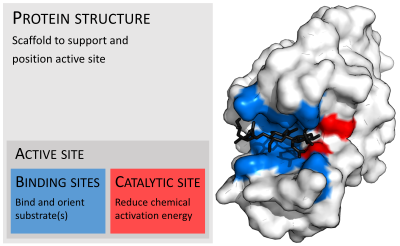
Ферменты обычно намного крупнее своих субстратов. Размеры варьируются от всего лишь 62 аминокислотных остатков у мономера 4 -оксалокротонаттаутомеразы [27] до более 2500 остатков у синтазы жирных кислот животных . [28] Только небольшая часть их структуры (около 2–4 аминокислот) непосредственно участвует в катализе: каталитический сайт. [29] Этот каталитический сайт расположен рядом с одним или несколькими сайтами связывания , где остатки ориентируют субстраты. Каталитический сайт и сайт связывания вместе составляют активный центр фермента . Оставшаяся большая часть структуры фермента служит для поддержания точной ориентации и динамики активного центра. [30]
В некоторых ферментах аминокислоты непосредственно не участвуют в катализе; вместо этого фермент содержит сайты для связывания и ориентации каталитических кофакторов . [30] Ферментные структуры могут также содержать аллостерические сайты , где связывание небольшой молекулы вызывает конформационные изменения , которые увеличивают или уменьшают активность. [31]
Существует небольшое количество биологических катализаторов на основе РНК , называемых рибозимами , которые также могут действовать отдельно или в комплексе с белками. Наиболее распространенной из них является рибосома , представляющая собой комплекс белков и каталитических компонентов РНК. [1] : 2,2
Ферменты должны связать свои субстраты, прежде чем они смогут катализировать любую химическую реакцию. Ферменты обычно очень специфичны в отношении того, какие субстраты они связывают, а затем катализируют химическую реакцию. Специфичность достигается за счет связывания с субстратами карманов с комплементарной формой, зарядом и гидрофильными / гидрофобными характеристиками. Таким образом, ферменты могут различать очень похожие молекулы субстрата на хемоселективные , региоселективные и стереоспецифические . [32]
Некоторые из ферментов, демонстрирующие наивысшую специфичность и точность, участвуют в копировании и экспрессии генома . Некоторые из этих ферментов имеют механизмы « корректуры ». Здесь фермент, такой как ДНК-полимераза, катализирует реакцию на первом этапе, а затем проверяет правильность продукта на втором этапе. [33] Этот двухэтапный процесс приводит к средней частоте ошибок менее 1 ошибки на 100 миллионов реакций в высокоточных полимеразах млекопитающих. [1] : 5.3.1 Подобные механизмы корректуры также обнаружены в РНК-полимеразе , [34] аминоацил-тРНК-синтетазах [35] и рибосомах . [36]
И наоборот, некоторые ферменты демонстрируют неразборчивость ферментов , обладают широкой специфичностью и действуют на ряд различных физиологически значимых субстратов. Многие ферменты обладают небольшой побочной активностью, возникшей случайно (т.е. нейтрально ), что может стать отправной точкой для эволюционного отбора новой функции. [37] [38]
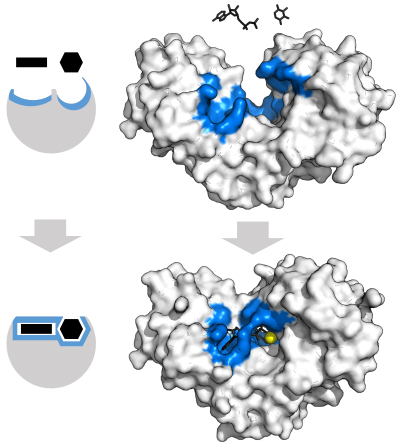
Чтобы объяснить наблюдаемую специфичность ферментов, в 1894 году Эмиль Фишер предположил, что и фермент, и субстрат обладают определенными дополнительными геометрическими формами, которые точно соответствуют друг другу. [39] Эту модель часто называют моделью «замок и ключ». [1] : 8.3.2 Эта ранняя модель объясняет специфичность ферментов, но не может объяснить стабилизацию переходного состояния, которой достигают ферменты. [40]
В 1958 году Дэниел Кошланд предложил модификацию модели замка и ключа: поскольку ферменты представляют собой довольно гибкие структуры, форма активного центра постоянно изменяется в результате взаимодействия с субстратом, когда субстрат взаимодействует с ферментом. [41] В результате субстрат не просто связывается с жестким активным центром; Боковые цепи аминокислот , составляющие активный центр, занимают точные положения, которые позволяют ферменту выполнять свою каталитическую функцию. В некоторых случаях, например, при гликозидазах , молекула субстрата также слегка меняет форму при входе в активный центр. [42] Активный центр продолжает меняться до тех пор, пока подложка не будет полностью связана, после чего определяется окончательная форма и распределение заряда. [43] Индуцированное соответствие может повысить точность молекулярного распознавания в присутствии конкуренции и шума посредством механизма конформационной корректуры . [44]
Ферменты могут ускорять реакции несколькими способами, каждый из которых снижает энергию активации (ΔG ‡ , свободную энергию Гиббса ) [45]
Ферменты могут использовать несколько из этих механизмов одновременно. Например, протеазы, такие как трипсин, осуществляют ковалентный катализ с использованием каталитической триады , стабилизируют накопление заряда в переходных состояниях с помощью оксианионной дырки , осуществляют полный гидролиз с использованием ориентированного водного субстрата. [51]
Ферменты не являются жесткими статическими структурами; вместо этого они имеют сложные внутренние динамические движения – то есть движения частей структуры фермента, таких как отдельные аминокислотные остатки, группы остатков, образующие белковую петлю или единицу вторичной структуры , или даже целый белковый домен . Эти движения порождают конформационный ансамбль несколько различных структур, которые в равновесии взаимопревращаются друг в друга . Различные состояния внутри этого ансамбля могут быть связаны с разными аспектами функции фермента. Например, различные конформации фермента дигидрофолатредуктазы связаны со стадиями связывания субстрата, катализа, высвобождения кофактора и высвобождения продукта каталитического цикла [52] , что согласуется с теорией каталитического резонанса .
Презентация субстрата — это процесс, при котором фермент отделяется от субстрата. Ферменты могут быть секвестрированы на плазматической мембране вдали от субстрата в ядре или цитозоле. Или внутри мембраны фермент может быть изолирован в липидных плотах вдали от своего субстрата в неупорядоченной области. Когда фермент высвобождается, он смешивается со своим субстратом. Альтернативно, фермент можно изолировать рядом с его субстратом для активации фермента. Например, фермент может быть растворимым и при активации связываться с липидом плазматической мембраны, а затем действовать на молекулы плазматической мембраны.
Аллостерические сайты — это карманы фермента, отличные от активного центра, которые связываются с молекулами клеточной среды. Эти молекулы затем вызывают изменение конформации или динамики фермента, которое переносится в активный центр и, таким образом, влияет на скорость реакции фермента. [53] Таким образом, аллостерические взаимодействия могут либо ингибировать, либо активировать ферменты. Аллостерические взаимодействия с метаболитами выше или ниже метаболического пути фермента вызывают регуляцию по принципу обратной связи , изменяя активность фермента в соответствии с потоком через остальную часть пути. [54]

Некоторым ферментам не нужны дополнительные компоненты для проявления полной активности. Другие требуют, чтобы небелковые молекулы, называемые кофакторами, были связаны для активности. [55] Кофакторы могут быть либо неорганическими (например, ионы металлов и железо-серные кластеры ), либо органическими соединениями (например, флавин и гем ). Эти кофакторы служат многим целям; например, ионы металлов могут помочь в стабилизации нуклеофильных частиц внутри активного центра. [56] Органическими кофакторами могут быть либо коферменты , которые высвобождаются из активного центра фермента во время реакции, либо простетические группы , которые прочно связаны с ферментом. Органические простетические группы могут быть связаны ковалентно (например, биотин в таких ферментах, как пируваткарбоксилаза ). [57]
Примером фермента, содержащего кофактор, является карбоангидраза , которая использует кофактор цинка, связанный как часть его активного центра. [58] Эти прочно связанные ионы или молекулы обычно находятся в активном центре и участвуют в катализе. [1] : 8.1.1 Например, в окислительно-восстановительных реакциях часто участвуют кофакторы флавина и гема. [1] : 17
Ферменты, которым требуется кофактор, но не имеют с ним связи, называются апоферментами или апопротеинами . Фермент вместе с кофактором(ами), необходимым для активности, называется голоферментом ( или галоферментом). Термин «холофермент» также можно применять к ферментам, которые содержат несколько белковых субъединиц, таким как ДНК-полимеразы ; здесь холофермент представляет собой полный комплекс, содержащий все субъединицы, необходимые для деятельности. [1] : 8.1.1
Коферменты – это небольшие органические молекулы, которые могут быть слабо или прочно связаны с ферментом. Коферменты переносят химические группы от одного фермента к другому. [59] Примеры включают НАДН , НАДФН и аденозинтрифосфат (АТФ). Некоторые коферменты, такие как флавинмононуклеотид (FMN), флавинадениндинуклеотид (FAD), тиаминпирофосфат (TPP) и тетрагидрофолат (THF), являются производными витаминов . Эти коферменты не могут синтезироваться организмом de novo , и близкородственные соединения (витамины) должны поступать с пищей. Перевозимые химические группы включают:
Поскольку коферменты химически изменяются в результате действия ферментов, полезно рассматривать коферменты как особый класс субстратов или вторых субстратов, которые являются общими для многих различных ферментов. Например, известно около 1000 ферментов, использующих кофермент НАДН. [60]
Коэнзимы обычно постоянно регенерируются, и их концентрация внутри клетки поддерживается на постоянном уровне. Например, НАДФН регенерируется посредством пентозофосфатного пути , а S -аденозилметионин — с помощью метионин-аденозилтрансферазы . Эта непрерывная регенерация означает, что небольшие количества коферментов могут использоваться очень интенсивно. Например, человеческое тело каждый день превращает собственный вес в АТФ. [61]
Как и все катализаторы, ферменты не изменяют положения химического равновесия реакции. В присутствии фермента реакция протекает в том же направлении, что и без фермента, только быстрее. [1] : 8.2.3 Например, карбоангидраза катализирует свою реакцию в любом направлении в зависимости от концентрации реагирующих веществ: [62]
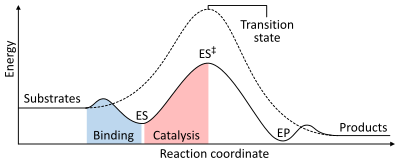
Скорость реакции зависит от энергии активации , необходимой для образования переходного состояния , которое затем распадается на продукты. Ферменты увеличивают скорость реакции за счет снижения энергии переходного состояния. Во-первых, связывание образует низкоэнергетический фермент-субстратный комплекс (ES). Во-вторых, фермент стабилизирует переходное состояние, так что для его достижения требуется меньше энергии по сравнению с некатализируемой реакцией (ES ‡ ). Наконец, комплекс фермент-продукт (ЭП) диссоциирует с высвобождением продуктов. [1] : 8,3
Ферменты могут связывать две или более реакции, так что термодинамически благоприятная реакция может быть использована для «управления» термодинамически неблагоприятной, так что объединенная энергия продуктов будет ниже, чем у субстратов. Например, гидролиз АТФ часто используется для запуска других химических реакций. [63]
Кинетика ферментов — это исследование того, как ферменты связывают субстраты и превращают их в продукты. [64] Данные о скорости, используемые в кинетическом анализе, обычно получают с помощью ферментных анализов . В 1913 году Леонор Михаэлис и Мод Леонора Ментен предложили количественную теорию кинетики ферментов, которая получила название кинетики Михаэлиса-Ментен . [65] Основным вкладом Михаэлиса и Ментена было представление о ферментативных реакциях, состоящих из двух стадий. В первом случае субстрат обратимо связывается с ферментом, образуя фермент-субстратный комплекс. В их честь иногда это называют комплексом Михаэлиса-Ментен. Затем фермент катализирует химическую стадию реакции и высвобождает продукт. Эта работа получила дальнейшее развитие Дж. Э. Бриггса и Дж. Б. С. Холдейна , которые вывели кинетические уравнения, которые широко используются до сих пор. [66]
Скорость ферментов зависит от условий раствора и концентрации субстрата . Чтобы найти максимальную скорость ферментативной реакции, концентрацию субстрата увеличивают до тех пор, пока не будет достигнута постоянная скорость образования продукта. Это показано на кривой насыщения справа. Насыщение происходит потому, что по мере увеличения концентрации субстрата все больше и больше свободного фермента превращается в связанный с субстратом комплекс ES. При максимальной скорости реакции ( V max ) фермента все активные центры фермента связаны с субстратом, и количество ES-комплекса равно общему количеству фермента. [1] : 8,4
V max является лишь одним из нескольких важных кинетических параметров. Также важно количество субстрата, необходимое для достижения заданной скорости реакции. Это определяется константой Михаэлиса-Ментена ( K m ), которая представляет собой концентрацию субстрата, необходимую для того, чтобы фермент достиг половины максимальной скорости реакции; как правило, каждый фермент имеет характеристику K M для данного субстрата. Другая полезная константа — k cat , также называемая числом оборота , которое представляет собой количество молекул субстрата, обрабатываемых одним активным центром в секунду. [1] : 8,4
Эффективность фермента можно выразить через kкат / Км . Ее также называют константой специфичности, и она включает константы скорости для всех стадий реакции, включая первую необратимую стадию. Поскольку константа специфичности отражает как сродство, так и каталитическую способность, она полезна для сравнения различных ферментов друг с другом или одного и того же фермента с разными субстратами. Теоретический максимум константы специфичности называется диффузионным пределом и составляет примерно от 10 8 до 10 9 (М -1 с -1 ). В этот момент каждое столкновение фермента с его субстратом будет приводить к катализу, и скорость образования продукта ограничивается не скоростью реакции, а скоростью диффузии. Ферменты, обладающие этим свойством, называются каталитически совершенными или кинетически совершенными . Примерами таких ферментов являются триозофосфатизомераза , карбоангидраза , ацетилхолинэстераза , каталаза , фумараза , β-лактамаза и супероксиддисмутаза . [1] : 8.4.2 Скорость оборота таких ферментов может достигать нескольких миллионов реакций в секунду. [1] : 9,2 Но большинство ферментов далеки от совершенства: средние значения и составляют около и соответственно. [67]
Кинетика Михаэлиса-Ментен основана на законе действия масс , который выведен из предположений о свободной диффузии и термодинамически обусловленном случайном столкновении. Многие биохимические или клеточные процессы значительно отклоняются от этих условий из-за скученности макромолекул и ограниченного молекулярного движения. [68] Более поздние комплексные расширения модели пытаются скорректировать эти эффекты. [69]
Скорость ферментативной реакции можно снизить с помощью различных типов ингибиторов ферментов. [70] : 73–74
Конкурентный ингибитор и субстрат не могут связываться с ферментом одновременно. [71] Часто конкурентные ингибиторы сильно напоминают настоящий субстрат фермента. Например, препарат метотрексат является конкурентным ингибитором фермента дигидрофолатредуктазы , катализирующего восстановление дигидрофолата до тетрагидрофолата. [72] Сходство структур дигидрофолата и этого препарата показано на прилагаемом рисунке. Этот тип ингибирования можно преодолеть с помощью высокой концентрации субстрата. В некоторых случаях ингибитор может связываться с сайтом, отличным от сайта связывания обычного субстрата, и оказывать аллостерический эффект, изменяя форму обычного сайта связывания. [73]
Неконкурентный ингибитор связывается с сайтом, отличным от места связывания субстрата. Субстрат по-прежнему связывается с обычным сродством, и, следовательно, K m остается прежним. Однако ингибитор снижает каталитическую эффективность фермента, так что V max снижается. В отличие от конкурентного ингибирования, неконкурентное ингибирование невозможно преодолеть высокой концентрацией субстрата. [70] : 76–78
Неконкурентный ингибитор не может связываться со свободным ферментом, а только с фермент-субстратным комплексом; следовательно, эти типы ингибиторов наиболее эффективны при высоких концентрациях субстрата. В присутствии ингибитора фермент-субстратный комплекс неактивен. [70] : 78 Этот тип торможения встречается редко. [74]
Смешанный ингибитор связывается с аллостерическим сайтом, и связывание субстрата и ингибитора влияют друг на друга. Функция фермента снижается, но не устраняется при связывании с ингибитором. Этот тип ингибитора не подчиняется уравнению Михаэлиса-Ментен. [70] : 76–78
Необратимый ингибитор навсегда инактивирует фермент, обычно образуя ковалентную связь с белком. [75] Пенициллин [76] и аспирин [77] являются распространенными препаратами, действующими таким образом.
У многих организмов ингибиторы могут действовать как часть механизма обратной связи . Если фермент производит слишком много одного вещества в организме, это вещество может действовать как ингибитор фермента в начале пути его производства, вызывая замедление или остановку выработки этого вещества, когда его будет достаточно. Это форма отрицательной обратной связи . Этот механизм используется в основных метаболических путях, таких как цикл лимонной кислоты . [1] : 17.2.2
Поскольку ингибиторы модулируют функцию ферментов, их часто используют в качестве лекарств. Многие такие препараты являются обратимыми конкурентными ингибиторами, напоминающими нативный субстрат фермента, подобно метотрексату, указанному выше; другие хорошо известные примеры включают статины , используемые для лечения высокого уровня холестерина [ 78] и ингибиторы протеазы , используемые для лечения ретровирусных инфекций, таких как ВИЧ . [79] Распространенным примером необратимого ингибитора, который используется в качестве лекарства, является аспирин , который ингибирует ферменты ЦОГ-1 и ЦОГ-2 , которые производят простагландин , посредник воспаления . [77] Другие ингибиторы ферментов являются ядами. Например, яд цианид является необратимым ингибитором ферментов, который соединяется с медью и железом в активном центре фермента цитохром-с-оксидазы и блокирует клеточное дыхание . [80]
Поскольку ферменты состоят из белков, их действие чувствительно к изменению многих физико-химических факторов, таких как pH, температура, концентрация субстрата и т. д.
В следующей таблице показаны оптимальные значения pH для различных ферментов. [81]
Ферменты выполняют широкий спектр функций внутри живых организмов. Они незаменимы для передачи сигналов и регуляции клеток, часто посредством киназ и фосфатаз . [82] Они также генерируют движение, при этом миозин гидролизует аденозинтрифосфат (АТФ), вызывая сокращение мышц , а также транспортируют грузы по клетке как часть цитоскелета . [83] Другие АТФазы в клеточной мембране представляют собой ионные насосы, участвующие в активном транспорте . Ферменты также участвуют в более экзотических функциях, таких как люцифераза , генерирующая свет у светлячков . [84] Вирусы также могут содержать ферменты для заражения клеток, такие как интеграза ВИЧ и обратная транскриптаза , или для высвобождения вируса из клеток, такие как нейраминидаза вируса гриппа . [85]
Важная функция ферментов заключается в пищеварительной системе животных. Ферменты, такие как амилазы и протеазы, расщепляют крупные молекулы ( крахмал или белки соответственно) на более мелкие, чтобы они могли всасываться в кишечнике. Молекулы крахмала, например, слишком велики, чтобы всасываться из кишечника, но ферменты гидролизуют цепи крахмала на более мелкие молекулы, такие как мальтоза и, в конечном итоге , на глюкозу , которые затем могут всасываться. Разные ферменты переваривают разные пищевые вещества. У жвачных животных , питающихся травоядными животными, микроорганизмы в кишечнике вырабатывают другой фермент, целлюлазу , разрушающую целлюлозные клеточные стенки растительной клетчатки. [86]
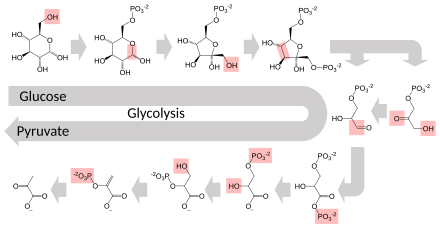
Несколько ферментов могут работать вместе в определенном порядке, создавая метаболические пути . [1] : 30.1 В метаболическом пути один фермент принимает в качестве субстрата продукт другого фермента. После каталитической реакции продукт передается другому ферменту. Иногда одну и ту же реакцию могут катализировать несколько ферментов параллельно; это может обеспечить более сложную регуляцию: например, с низкой постоянной активностью, обеспечиваемой одним ферментом, но индуцируемой высокой активностью со стороны второго фермента. [87]
Ферменты определяют, какие этапы происходят на этих путях. Без ферментов метаболизм не мог бы проходить одни и те же этапы и не мог бы регулироваться для удовлетворения потребностей клетки. Большинство центральных метаболических путей регулируются в несколько ключевых этапов, обычно с помощью ферментов, активность которых включает гидролиз АТФ. Поскольку эта реакция высвобождает так много энергии, другие термодинамически неблагоприятные реакции могут быть связаны с гидролизом АТФ, запуская общую серию связанных метаболических реакций. [1] : 30,1
Существует пять основных способов контроля активности ферментов в клетке. [1] : 30.1.1
Ферменты могут быть активированы или ингибированы другими молекулами. Например, конечные продукты метаболического пути часто являются ингибиторами одного из первых ферментов этого пути (обычно первый необратимый этап, называемый фиксированным этапом), регулируя таким образом количество конечного продукта, вырабатываемого этими путями. Такой механизм регулирования называется механизмом отрицательной обратной связи , поскольку количество вырабатываемого конечного продукта регулируется его собственной концентрацией. [88] : 141–48 Механизм отрицательной обратной связи может эффективно регулировать скорость синтеза промежуточных метаболитов в соответствии с потребностями клеток. Это помогает эффективно распределять материалы и экономить энергию, а также предотвращает избыточное производство конечной продукции. Как и другие гомеостатические устройства , контроль ферментативного действия помогает поддерживать стабильную внутреннюю среду живых организмов. [88] : 141
Примеры посттрансляционной модификации включают фосфорилирование , миристоилирование и гликозилирование . [88] : 149–69 Например , в ответ на инсулин фосфорилирование множества ферментов, включая гликогенсинтазу , помогает контролировать синтез или распад гликогена и позволяет клетке реагировать на изменения уровня сахара в крови . [89] Другим примером посттрансляционной модификации является расщепление полипептидной цепи. Химотрипсин , пищеварительная протеаза, вырабатывается в неактивной форме в виде химотрипсиногена в поджелудочной железе и транспортируется в этой форме в желудок , где активируется. Это мешает ферменту переваривать поджелудочную железу или другие ткани до того, как он попадет в кишечник. Этот тип неактивного предшественника фермента известен как зимоген [88] : 149–53 или профермент.
Производство ферментов ( транскрипция и трансляция генов ферментов) может усиливаться или уменьшаться клеткой в ответ на изменения в клеточной среде. Эта форма регуляции генов называется индукцией ферментов . Например, бактерии могут стать устойчивыми к антибиотикам, таким как пенициллин , потому что индуцируются ферменты, называемые бета-лактамазами, которые гидролизуют важнейшее бета-лактамное кольцо в молекуле пенициллина. [90] Другой пример связан с ферментами печени, называемыми цитохромоксидазами P450 , которые играют важную роль в метаболизме лекарств . Индукция или ингибирование этих ферментов может вызвать лекарственное взаимодействие . [91] Уровни ферментов также можно регулировать, изменяя скорость ферментативной деградации . [1] : 30.1.1 Противоположностью индукции ферментов является их репрессия .
Ферменты могут быть разделены на компартменты, при этом в разных клеточных компартментах происходят разные метаболические пути . Например, жирные кислоты синтезируются одним набором ферментов в цитозоле , эндоплазматическом ретикулуме и аппарате Гольджи и используются другим набором ферментов в качестве источника энергии в митохондриях посредством β-окисления . [92] Кроме того, перенос фермента в разные компартменты может изменить степень протонирования (например, нейтральная цитоплазма и кислая лизосома ) или окислительного состояния (например, окисление периплазмы или восстановление цитоплазмы ), что, в свою очередь, влияет на активность фермента. [93] В отличие от разделения на мембраносвязанные органеллы, субклеточная локализация ферментов также может быть изменена посредством полимеризации ферментов в макромолекулярные цитоплазматические нити. [94] [95]
У многоклеточных эукариот клетки в разных органах и тканях имеют разные модели экспрессии генов и, следовательно, имеют разные наборы ферментов (известных как изоферменты ), доступных для метаболических реакций. Это обеспечивает механизм регуляции общего метаболизма организма. Например, гексокиназа , первый фермент пути гликолиза , имеет специализированную форму, называемую глюкокиназой , экспрессируемую в печени и поджелудочной железе , которая имеет более низкое сродство к глюкозе, но более чувствительна к концентрации глюкозы. [96] Этот фермент участвует в определении уровня сахара в крови и регулировании выработки инсулина. [97]


Поскольку жесткий контроль активности ферментов важен для гомеостаза , любой сбой (мутация, перепроизводство, недостаточное производство или удаление) одного критического фермента может привести к генетическому заболеванию. Нарушение работы хотя бы одного типа ферментов из тысяч, присутствующих в организме человека, может привести к летальному исходу. Примером смертельного генетического заболевания, вызванного недостаточностью фермента, является болезнь Тея-Сакса , при которой у пациентов отсутствует фермент гексозаминидаза . [98] [99]
Одним из примеров дефицита ферментов является наиболее распространенный тип фенилкетонурии . Множество различных мутаций отдельных аминокислот в ферменте фенилаланингидроксилазе , который катализирует первый этап деградации фенилаланина , приводят к накоплению фенилаланина и связанных с ним продуктов. Некоторые мутации происходят в активном центре, непосредственно нарушая связывание и катализ, но многие из них находятся далеко от активного центра и снижают активность, дестабилизируя структуру белка или влияя на правильную олигомеризацию. [100] [101] Это может привести к умственной отсталости , если заболевание не лечить. [102] Другим примером является дефицит псевдохолинэстеразы , при котором способность организма расщеплять препараты эфиров холина нарушается. [103] Пероральное введение ферментов можно использовать для лечения некоторых функциональных дефицитов ферментов, таких как недостаточность поджелудочной железы [104] и непереносимость лактозы . [105]
Другой способ, которым сбои в работе ферментов могут вызвать заболевание, связан с мутациями зародышевой линии в генах, кодирующих ферменты репарации ДНК . Дефекты этих ферментов вызывают рак, поскольку клетки менее способны восстанавливать мутации в своих геномах . Это вызывает медленное накопление мутаций и приводит к развитию рака . Примером такого наследственного ракового синдрома является пигментная ксеродермия , вызывающая развитие рака кожи в ответ даже на минимальное воздействие ультрафиолета . [106] [107]
Как и любой другой белок, ферменты со временем изменяются в результате мутаций и дивергенции последовательностей. Учитывая их центральную роль в метаболизме , эволюция ферментов играет решающую роль в адаптации . Поэтому ключевой вопрос заключается в том, могут ли ферменты и каким образом одновременно изменять свою ферментативную активность. Принято считать, что многие новые активности ферментов возникли в результате дупликации генов и мутации дубликатов, хотя эволюция может происходить и без дупликации. Одним из примеров фермента, изменившего свою активность, является предок метиониламинопептидазы (MAP) и креатинаминогидролазы ( креатиназы ), которые явно гомологичны, но катализируют очень разные реакции (MAP удаляет аминоконцевой метионин в новых белках, в то время как креатиназа гидролизует креатин до саркозин и мочевина ). Кроме того, MAP зависит от ионов металлов, а кретиназа — нет, поэтому это свойство также со временем утрачивается. [108] Небольшие изменения ферментативной активности чрезвычайно распространены среди ферментов. В частности, специфичность связывания субстрата (см. выше) может легко и быстро меняться при изменении отдельных аминокислот в карманах связывания субстрата. Это часто наблюдается в основных классах ферментов, таких как киназы . [109]
Искусственная (in vitro) эволюция в настоящее время широко используется для изменения активности или специфичности ферментов в промышленных целях (см. ниже).
Ферменты используются в химической промышленности и других отраслях промышленности, когда требуются чрезвычайно специфические катализаторы. Ферменты в целом ограничены в количестве реакций, которые они способны катализировать, а также из-за их недостаточной стабильности в органических растворителях и при высоких температурах. Как следствие, белковая инженерия является активной областью исследований и включает в себя попытки создать новые ферменты с новыми свойствами либо посредством рационального проектирования, либо посредством эволюции in vitro . [110] [111] Эти усилия начали приносить успех, и теперь «с нуля» разработано несколько ферментов, катализирующих реакции, которые не встречаются в природе. [112]